조합화학
Combinatorial chemistry조합 화학은 하나의 공정에서 많은 (수천에서 수백만까지) 화합물을 만들 수 있는 화학 합성 방법으로 구성됩니다.이러한 복합 라이브러리는 컴퓨터 소프트웨어에 [1]의해 생성된 혼합물, 개별 화합물 세트 또는 화학 구조물로 만들어질 수 있다.조합 화학은 작은 분자의 합성과 펩타이드에 사용될 수 있다.
라이브러리의 유용한 구성요소를 식별할 수 있는 전략 또한 조합 화학의 일부이다.조합 화학에서 사용되는 방법들은 화학 이외에도 적용된다.
역사
조합 화학은 1982년 [2]공증된 문서에서 그것의 원리, 조합 합성 및 디콘볼루션 절차를 기술한 Furka AH(외트뵈스 Lorand University Budapast Hungary)에 의해 발명되었다.조합법의 원리는 다성분 화합물 혼합물(콤비네이터 라이브러리)을 단일 단계적 절차로 합성하고 이를 선별하여 단일 프로세스에서 약물 후보 또는 기타 유용한 화합물을 찾는 것이다.조합법의 가장 중요한 혁신은 공정의 높은 생산성을 보장하는 합성 및 스크리닝에 혼합물을 사용하는 것입니다.이 발명에 이르게 된 동기는 [3]2002년에 발표되었다.
서론
조합적인 방식으로 분자를 합성하는 것은 빠르게 많은 분자로 이어질 수 있다.\times N_{R_{2}}}N_{R_{3}\times 예를 들어, 다양성(L, R2, 그리고 R3)의 3점으로 분자}}NR1×NR2×NR3{\displaystyle N_{R_{1}이 NR1{\displaystyle N_{R_{1}}}, NR2{\displaystyle N_{R_{2}}}, NR3{\di 가능한 구조, 발생할 수 있다.s N_은 사용되는 [2]다른 치환기 수입니다.
조합 화학의 기본 원리는 매우 많은 화합물의 라이브러리를 준비하고 라이브러리의 유용한 구성요소를 확인하는 것입니다.
조합 화학은 1990년대 [4]이후 산업에만 도입되었지만, 그 뿌리는 록펠러 대학의 연구원 브루스 메리필드가 펩타이드의 고체상 합성을 연구하기 시작한 1960년대까지 거슬러 올라갈 수 있다.
현대적 형태에서 조합 화학은 아마도 제약 [5]산업에서 가장 큰 영향을 미쳤을 것입니다.화합물의 활성 프로파일을 최적화하려고 시도하는 연구원들은 다양하지만 관련이 있는 많은 [6]화합물들로 이루어진 '도서관'을 만든다.[7] 로보틱스의 진보는 조합 합성에 대한 산업적 접근으로 이어졌고, 기업은 매년 [8]10만 개 이상의 새롭고 독특한 화합물을 일상적으로 생산할 수 있게 되었습니다.
방대한 수의 구조적 가능성을 다루기 위해, 연구자들은 종종 주어진 약물의 모든 가능한 구조를 모든 [9]가용 반응물과 함께 계산적으로 열거하는 '가상 라이브러리'를 만든다.이러한 라이브러리는 수천에서 수백만 개의 '가상' 복합체로 구성될 수 있습니다.연구자는 다양한 계산과 기준을 기반으로 실제 합성을 위해 '가상 라이브러리'의 하위 집합을 선택할 것이다(ADME, 계산 화학 및 QSAR 참조).
폴리머(펩타이드 및 올리고뉴클레오티드)
조합 스플릿 믹스(스플릿과 풀) 합성
조합 스플릿 [12]믹스(스플릿 및 풀) 합성은 메리필드가 개발한 고체상 합성에 기초한다.20개의 아미노산(또는 다른 종류의 구성 블록)을 사용하여 조합 펩타이드 라이브러리를 합성하면 비드는 20개의 동일한 부분으로 분할됩니다.그 후 각 부분에 다른 아미노산을 결합한다.세 번째 단계는 모든 부분을 섞는 것입니다.이 세 단계는 하나의 사이클을 구성합니다.사이클의 단계를 반복하는 것만으로 펩타이드 사슬의 신장을 실현할 수 있다.
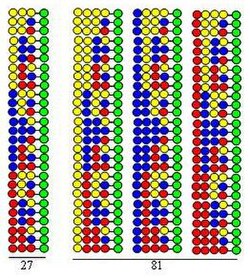
이 절차는 두 사이클에서 구성 블록과 동일한 세 개의 아미노산을 사용하여 디펩타이드 라이브러리를 합성하는 것으로 설명됩니다.이 라이브러리의 각 구성요소는 서로 다른 순서로 배열된 두 개의 아미노산을 포함합니다.커플링에 사용되는 아미노산은 그림에서 노란색, 파란색 및 빨간색 원으로 표시됩니다.발산 화살표는 솔리드 서포트 수지(녹색 원)를 동일한 부분으로 나누고, 수직 화살표는 커플링을 의미하며, 수렴 화살표는 서포트 부분의 혼합 및 균질화를 나타냅니다.
그림은 2개의 합성 사이클에서 9개의 디펩타이드가 형성되는 것을 보여준다.세 번째와 네 번째 사이클에서는 각각 27개의 곱창과 81개의 테트라펩타이드가 형성된다.
"split-mix 합성"에는 다음과 같은 뛰어난 기능이 있습니다.
- 매우 효율적입니다.그림과 같이 합성공정(3, 9, 27, 81)에서 형성되는 펩타이드의 수는 실행된 사이클의 수에 따라 기하급수적으로 증가한다.각 합성 사이클에서 20개의 아미노산을 사용하여 형성된 펩타이드의 수는 각각 400, 8,000, 160,000 및 3,200,000입니다.즉, 펩타이드의 수는 실행된 사이클의 수와 함께 기하급수적으로 증가합니다.
- 모든 펩타이드 배열은 사이클에 사용되는 아미노산의 조합에 의해 추론될 수 있는 프로세스에서 형성된다.
- 서포트를 동일한 샘플로 분할하면 라이브러리의 구성요소가 거의 동일한 몰 양으로 형성됩니다.
- 서포트의 각 구슬에는 단일 펩타이드만 형성됩니다.이것은 결합 단계에서 하나의 아미노산만 사용한 결과입니다.그러나 선택된 구슬을 차지하는 펩타이드가 무엇인지 전혀 알려져 있지 않다.
- 분할혼합법은 단계적 프로세스로 구성 블록에서 준비할 수 있는 유기물 또는 다른 종류의 라이브러리를 합성하기 위해 사용할 수 있습니다.
1990년에 세 그룹은 생물학적 방법에[13][14][15] 의한 펩타이드 라이브러리 작성 방법을 설명하였고, 1년 후 Fodor 등은 작은 유리 슬라이드에 [16]펩타이드 어레이의 합성을 위한 주목할 만한 방법을 발표했다.
"병렬 합성" 방법은 마리오 가이센과 그의 동료들에 의해 펩타이드 [17]배열의 준비를 위해 개발되었다.그들은 단단한 지지대로 끝을 코팅한 플라스틱 막대(핀)에 96개의 펩타이드를 합성했다.핀을 마이크로타이터 플레이트의 웰에 배치된 시약 용액에 담갔다.이 방법은 특히 자동 병렬 신시사이저를 사용하여 널리 적용된다.병렬 방법은 실제 조합 방법보다 훨씬 느리지만, 각 핀에 어떤 펩타이드 또는 다른 화합물이 형성되는지 정확히 알 수 있다는 것이 장점이다.
분할 혼합과 병렬 합성의 장점을 결합하기 위해 추가 절차가 개발되었다.두 그룹에[18][19] 의해 기술된 방법에서 고체 지지체는 캡슐 내에 형성되는 화합물의 코드를 포함하는 무선주파수 태그와 함께 투과성 플라스틱 캡슐에 봉입되었다.절차는 split-mix 방식과 유사하게 수행되었습니다.그러나 분할공정에서 캡슐은 캡슐의 무선주파수 태그에서 읽어낸 코드에 따라 반응용기 간에 분배된다.
Furka 등이 동일한 목적을 위해 개발한 [20]다른 방법은 "끈 합성"이다.이 방법에서 캡슐은 코드를 포함하지 않았다.그것들은 목걸이의 진주처럼 끈으로 매여져 반응 용기에 실 모양으로 넣어진다.캡슐의 정체와 내용물은 줄에 있는 위치에 따라 저장됩니다.각 결합 공정 후에 캡슐은 일정한 규칙에 따라 새로운 문자열 간에 재배포된다.
소분자
이 섹션은 주제에 대한 백과사전적 설명이라기보다는 검토처럼 읽힌다.(2018년 7월) |
약물 발견 과정에서 관심 있는 작은 분자의 합성과 생물학적 평가는 일반적으로 길고 힘든 과정이었다.조합 화학은 많은 수의 잠재적 소분자 약물 후보를 빠르고 효율적으로 합성하기 위한 접근법으로 최근 수십 년 동안 등장했습니다.전형적인 합성에서는 합성 스킴의 마지막에 단 하나의 표적 분자만이 생성되며, 합성에서의 각 단계는 단 하나의 생성물만을 생성한다.조합합성에서는 하나의 시작 물질만을 사용할 때 동일한 반응 조건을 사용하여 분자의 큰 라이브러리를 합성할 수 있으며, 그 후 생물학적 활성을 위해 선별할 수 있다.이 제품 풀은 세 가지 제품을 각각 포함하는 세 개의 동일한 부분으로 분할된 다음, 세 개의 개별 풀 각각이 다른 시약 B, C 또는 D 단위와 반응하여 이전 3개에서 9개의 고유한 화합물을 생성합니다.그런 다음 이 과정을 반복하여 원하는 수의 빌딩 블록이 추가되어 많은 화합물이 생성됩니다.다단계 합성에 의한 복합물의 라이브러리를 합성할 때는 효율적인 반응 방법을 사용해야 하며, 각 반응 단계 후에 전통적인 정제 방법을 사용하면 수율 및 효율이 저하된다.
고체상 합성은 합성 화학에서 종종 사용되는 전형적인 담금질 및 정제 단계의 필요성을 없애기 위한 잠재적 해결책을 제공합니다.일반적으로 시작 분자는 고체 지지체(일반적으로 불용성 고분자)에 접착된 후 추가 반응을 하고 최종 생성물을 정제하여 고체 지지체로부터 분리한다.관심 분자는 고체 지지체에 부착되어 있기 때문에 단일 여과/세척 공정으로 반응할 때마다 정제량을 줄일 수 있으므로 대부분의 합성 화학이 수반하는 지루한 액체 추출 및 용매 증발 단계가 필요하지 않습니다.또한 이종반응물을 사용함으로써 잉여시약을 사용하여 완성을 위한 느린 반응을 유도할 수 있어 수율을 더욱 향상시킬 수 있다.여분의 시약은 크로마토그래피와 같은 추가적인 정제 단계 없이도 간단히 씻어낼 수 있습니다.
수년간 합성 및 정제 용이성을 높이기 위한 노력과 중간생성물을 특징짓는 비전통적인 방법을 포함하여 조합화학에서 고체상 유기합성의 사용을 정교화하기 위한 다양한 방법이 개발되어 왔다.여기에 설명된 예제의 대부분은 모든 반응 단계에서 이종 반응 매체를 사용하지만, Booth와 Hodges는 기존 용액 단계 [21]합성물의 정제 단계에서만 고체 지지 시약을 사용하는 초기 예를 제공합니다.그들의 견해에 따르면, 용액상 화학은 확립된 용액상 반응의 고체상 유추체를 재현할 필요가 없을 뿐만 아니라 분자를 수지에 고정시키고 제거하는 데 필요한 부착 및 균열 반응을 피할 수 있는 이점을 제공한다.
문제가 되는 불순물의 화학적 구조를 알고 있다고 가정할 때 합성 끝에 있는 단일 정제 단계를 통해 하나 이상의 불순물을 제거할 수 있습니다.고체 지지 시약을 사용하면 화합물의 합성이 크게 간소화되지만, 많은 조합 합성에는 여러 단계가 필요하며, 각 단계는 여전히 어떤 형태로든 정화가 필요합니다.Armstrong 등은 다중 구성 요소 응축(MCC)[22]이라고 하는 조합 라이브러리를 생성하는 원포트 방법을 설명합니다.이 방법에서는 3개 이상의 시약이 반응하여 각 시약이 한 번에 최종 제품에 통합되므로 여러 정제 단계를 수반하는 다단계 합성이 필요하지 않습니다.MCC에서는 어레이의 각 합성이 하나의 생성물만을 가지기 때문에 어떤 화합물이 생물학적으로 활성인지 결정하는 데 필요한 디콘볼루션(deconvolution)이 필요하지 않다. 따라서 화합물의 정체를 명확하게 알 수 있어야 한다.
또 다른 어레이 합성에서 스틸은 분할 [23]합성에 의해 올리고펩티드의 큰 라이브러리를 생성했다.수천 개의 화합물을 만드는 것의 단점은 형성된 화합물의 구조를 알아내기 어렵다는 것이다.그들의 해결책은 분자 태그를 사용하는 것입니다. 분자 태그는 소량의 염료가 구슬에 부착되어 있으며, 특정 구슬의 정체는 구슬에 어떤 태그가 있는지 분석하여 확인할 수 있습니다.태그를 부착하면 수용체를 쉽게 식별할 수 있지만, 수용체 결합 능력을 위해 각 화합물을 개별적으로 선별하는 것은 매우 불가능하기 때문에, 각 수용체에 염료를 부착하여, 기질에 결합하는 수용체만 색 변화를 일으킨다.
어레이 내에서 많은 반응을 실행해야 할 경우(암스트롱의 MCC 어레이 중 하나에 설명된 96 반응 등), 보다 지루한 합성 측면 중 일부를 자동화하여 효율성을 개선할 수 있습니다.DeWitt와 Czarnik은 "DiversOMER 방법"이라고 불리는 방법을 자세히 설명하고 있는데, 이 방법에서는 여러 가지 축소된 화학 반응이 [24]동시에 실행됩니다.이 방법은 반응 사이클 모니터링 및 정제뿐만 아니라 수지 로드 및 세척 사이클을 자동화하는 장치를 사용하며, 히단토인, 벤조디아제핀 등 다양한 분자 클래스를 합성하기 위해 사용하는 방법 및 장치의 타당성을 입증하며, 대부분의 경우 40가지 개별 반응을 실행한다.
종종 값비싼 장비를 사용할 수 없으며, Schwabacher 등은 라이브러리 구성원의 병렬 합성과 전체 [25]복합 라이브러리의 평가를 결합하는 간단한 방법을 설명한다.다른 영역으로 분할된 실을 실린더에 감싼 후 다른 시약을 단일 종만을 가진 각 영역에 결합하는 방법.그런 다음 나사산을 다시 분할하여 다른 크기의 실린더에 감싼 다음 이 과정을 반복합니다.이 방법의 장점은 각 제품의 동일성을 단순히 나사산을 따라 위치함으로써 알 수 있고, 대응하는 생물학적 활동은 형광 신호의 푸리에 변환에 의해 식별된다는 것이다.
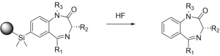
여기에 설명된 대부분의 합성물은 고체 지지대에 시작 시약을 부착 및 제거해야 합니다.이는 수산기 생성으로 이어질 수 있으며, 이는 잠재적으로 표적 화합물의 생물학적 활성에 영향을 미칠 수 있습니다.Ellman은 다단계 합성 스킴에서 고체상 서포트를 사용하여 192개의 개별 1,4-벤조디아제핀 유도체를 얻으며, 이는 잘 알려진 치료제이다.[26]잠재적인 히드록실기 간섭 가능성을 제거하기 위해 실릴 아릴 화학을 이용한 새로운 방법을 사용하여 지지대에서 갈라져 링커의 흔적을 남기지 않는 고체 지지대에 분자를 연결한다.
분자를 고체 지지대에 고정할 때, 중간체는 수지에서 분자를 분리하지 않고는 서로 분리할 수 없다.반응 진행 상황을 추적하고 제품 구조를 확인하는 데 사용되는 기존의 특성화 기법 중 많은 부분이 솔루션 기반이기 때문에 서로 다른 기술을 사용해야 합니다.겔상 13 [27]C NMR 분광법, MALDI 질량 분석, IR 분광법을 사용하여 구조를 확인하고 고체상 반응의 진행 상황을 모니터링하였다.Gordon 등은 [27]작은 분자의 조합 라이브러리를 생성하기 위해 이미인과 펩티딜 포스포네이트를 이용하는 몇 가지 사례 연구를 설명한다.수지에 묶인 아미노산을 알데히드 존재 하에서 반응시켜 이민 라이브러리를 생성한다.저자들은 반응 진행 상황을 모니터링하기 위해 빠른 13C 겔상 NMR 분광법과 1H NMR 회전 매직 앵글의 사용을 시연했으며, 트리메틸 오르토포름산염이 용매로 사용되었을 때 상온에서 10분 이내에 대부분의 이미인을 형성할 수 있음을 보여주었다.생성된 이미인은 4-티아졸리디논, B-락탐 및 피롤리딘을 생성하기 위해 유도되었다.
고체상 서포트를 사용하면 화합물의 대규모 조합 라이브러리의 합성을 크게 단순화할 수 있습니다.이것은 시작 재료를 단단한 서포트에 고정시킨 후 충분히 큰 라이브러리가 구축될 때까지 후속 반응을 실행한 후 제품을 서포트에서 분리함으로써 이루어집니다.고체상 정화의 사용은 또한 표준 액체 추출 정제 기술과 함께 용액상 합성 체계에서 사용하기 위해 입증되었다.
디콘볼루션 및 스크리닝
조합 라이브러리
조합 라이브러리는 단일 단계적 프로세스로 합성되는 소분자 화학 화합물의 특수 다성분 혼합물입니다.그것들은 개별 화합물의 집합뿐만 아니라 병렬 합성에 의해 만들어진 일련의 화합물들과도 다르다.혼합물이 그들의 합성에 사용된다는 것은 중요한 특징이다.혼합물을 사용하면 공정의 효율성이 매우 높아집니다.두 반응물은 혼합물이 될 수 있으며 이 경우 절차가 훨씬 더 효율적입니다.그러나 실제적인 이유로 두 가지 혼합물 중 하나를 단일 구성 블록(BB)으로 대체하는 분할 혼합 방법을 사용하는 것이 좋습니다.혼합물은 매우 중요하기 때문에 합성에 혼합물을 사용하지 않는 조합 라이브러리가 없으며 혼합물이 불가피하게 조합 라이브러리 형태로 사용되는 경우.스플릿 믹스 합성은 보통 솔리드 서포트를 사용하여 실현되지만 용액에도 적용할 수 있습니다.구성 요소가 알려지지 않은 디콘볼루션 방법을 선별에 사용해야 한다.조합 라이브러리의 가장 중요한 특징 중 하나는 전체 혼합물을 단일 프로세스로 스크리닝할 수 있다는 것입니다.이것은 이러한 도서관을 제약 연구에 매우 유용하게 만든다.완전한 조합 라이브러리의 부분 라이브러리도 합성할 수 있습니다.그 중 일부는 디콘볼루션에[28] 사용될 수 있다.
견고한 서포트에서 분리된 라이브러리 디콘볼루션
조합 라이브러리의 합성 분자가 고체 지지체로부터 절단되면 수용성 혼합물 형태가 된다.이러한 용액에서 수백만 가지의 다른 화합물이 발견될 수 있다.이 합성법이 개발되었을 때, 처음에는 분자를 식별하고 유용한 성질을 가진 분자를 찾는 것이 불가능해 보였다.그러나 이 문제를 해결하기 위해 유용한 구성 요소를 식별하는 전략이 개발되었습니다.이 모든 전략은 부분 라이브러리의 통합 및 테스트에 기초하고 있습니다.최초의 반복 전략은 1982년에 공증된 위의 Furka 문서에 설명되어 있다.[2]이 방법은 나중에 Erb 등에 의해 독립적으로 발표되었다.'재귀 디콘볼루션'[29]이라는 이름으로
재귀 디콘볼루션
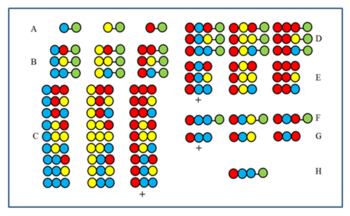
그 방법은 그림으로 알 수 있다.3개의 아미노산으로부터 27개의 펩타이드 라이브러리를 합성한다.첫 번째(A) 및 두 번째(B) 사이클이 끝나면 샘플을 혼합하기 전에 따로 보관합니다.세 번째 사이클(C)의 제품은 혼합하기 전에 분해한 후 활성 여부를 테스트합니다.+ 기호로 표시된 그룹이 활성 상태라고 가정합니다.모든 구성원은 마지막 결합위치(CP)에서 빨간색 아미노산을 가진다.따라서 활성부재는 마지막 CP에서도 적색아미노산을 가진다.그리고 두 번째 주기(B) 후에 남겨진 세 개의 시료에 빨간색 아미노산을 결합하여 시료 D를 얻는다.절단 후 3개의 E 시료를 형성한다.+로 표시된 시료가 활성 시료인 경우 파란색 아미노산이 활성 성분에서 두 번째 CP를 차지하는 것으로 나타납니다.그런 다음 먼저 파란색 A 시료 3개에 빨간색 아미노산을 결합(F)한 후 분해(G) 후 다시 검사한다.+ 성분이 활성으로 판명되면 활성 성분의 시퀀스가 결정되어 H로 표시됩니다.
위치 스캔
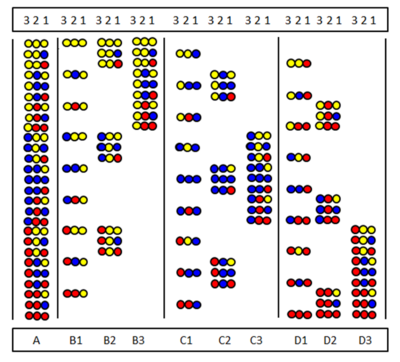
위치 스캔은 Furka 등 [30]및 [31]Pinilla 등에 의해 독립적으로 도입되었다.이 방법은 일련의 하위 라이브러리의 합성과 테스트를 기반으로 합니다.특정 배열 위치가 동일한 아미노산에 의해 점유되는 경우.그림에는 3개의 아미노산으로 이루어진 전체 펩타이드 삼량체 라이브러리(A)의 9개의 서브 라이브러리(B1-D3)가 나와 있습니다.서브 라이브러리에는 모든 구성 요소에서 동일한 아미노산이 차지하는 위치가 있습니다.서브라이브러리 합성에 있어서 지지체는 분할되지 않고 하나의 아미노산만 전체 시료에 결합된다.그 결과 모든 성분에서 동일한 아미노산이 한 위치를 차지하게 됩니다.예를 들어 B2 서브라이브러리 위치 2는 9가지 성분 모두에서 γ노란색 아미노산이 차지하고 있다.스크리닝 테스트에서 이 하위 라이브러리가 양성 반응을 보인다면 활성 펩타이드의 위치 2도 γ노란색 아미노산에 의해 점유되고 있음을 의미한다.아미노산 배열은 9개의 서브라이브러리 모두를 테스트함으로써 결정될 수 있습니다.
누락 라이브러리
누락[32][33] 라이브러리에서 특정 아미노산이 혼합물의 모든 펩타이드에서 누락된다.그림은 전체 라이브러리와 3개의 생략 라이브러리를 나타내고 있습니다.맨 위에는 누락된 아미노산이 표시되어 있습니다.누락 라이브러리가 음성 검사를 하는 경우 생략된 아미노산이 활성 성분에 존재한다.
테더레이션 조합 라이브러리의 디콘볼루션
펩타이드가 고체 지지대에서 분리되지 않은 경우, 우리는 비즈의 혼합물을 다루며, 각 비즈는 단일 펩타이드를 포함합니다.스미스와 그의 동료들은[34] 앞서 펩타이드가 사슬 형태로도 시험될 수 있다는 것을 보여주었다.이 접근법은 또한 펩타이드 라이브러리 선별에도 사용되었다.테더링된 펩타이드 라이브러리는 용해된 표적 단백질로 테스트되었습니다.단백질이 부착된 구슬을 추출하여 구슬에서 단백질을 제거한 후 염기서열 분석을 통해 결합 펩타이드를 확인하였습니다.Taylor와 [35]Morken은 다소 다른 접근방식을 따랐다.그들은 적외선 서모그래피를 사용하여 비펩타이드 사슬 라이브러리에서 촉매를 식별했다.이 방법은 테더링 라이브러리가 기판 용액에 잠길 때 촉매가 포함된 비즈에서 발생하는 열을 기반으로 합니다.비드를 적외선 현미경으로 검사하면 비드를 포함한 촉매가 밝은 점으로 나타나며 이를 골라낼 수 있습니다.
부호화 조합 라이브러리
우리가 비펩타이드 유기 라이브러리를 다룰 경우, 펩타이드 비드의 경우처럼 비드의 함유량을 확인하는 것은 쉽지 않습니다.이 난이도를 피하기 위해 라이브러리의 합성과 병행하여 비즈에 부착하는 방법이 개발되었습니다.이 방법은 화합물의 구조를 코드하는 분자가 비즈에 형성되었습니다.Ohlmeyer와 그의 동료들은 18개의 태그 부착 분자의 혼합물을[36] 사용하여 그것들을 구슬에서 분리한 후 전자 포획 가스 크로마토그래피로 식별할 수 있었다.Sarkar 등은 대량 부호화 OBOC [37]라이브러리를 구축하는 데 사용될 수 있는 펜테노아미드(COPA)의 키랄 올리고머를 설명했다.Kerr 등은 혁신적인 부호화[38] 방법을 도입했다.직교적으로 보호되는 분리 가능한 2관능 링커가 비즈에 부착되었다.링커의 한쪽 끝은 라이브러리의 비자연 구성 요소를 부착하는 데 사용되었고, 다른 한쪽 끝은 아미노산 세쌍둥이를 연결하였다.구성 요소는 비천연 아미노산이었으며, 아미노산 세쌍둥이를 코드하는 일련의 요소는 에드만 분해에 의해 결정될 수 있었다.이러한 종류의 부호화의 중요한 측면은 라이브러리 구성원들이 수용성 라이브러리를 형성하는 부호화 태그와 함께 구슬에서 분리할 수 있는 가능성입니다.Nikolajev 등은 펩타이드를 [39]사용한 부호화에 동일한 접근방식을 사용했다.1992년 Brenner와 Lerner는 가장 성공적인 부호화 [40]방법임이 증명된 고체 지지대의 구슬을 부호화하기 위해 DNA 염기서열을 도입했다.닐슨, 브레너, 얀다는 또한 DNA[41] 인코딩을 구현하기 위해 커 접근법을 사용했다. 최근 시간에는 DNA 염기서열 분석에서 중요한 발전이 있었다.차세대 기술은 DNA 부호화 라이브러리의 스크리닝에 매우 중요한 다수의 샘플을 병렬로 배열하는 것을 가능하게 한다.DNA 인코딩의 성공에 기여한 또 다른 혁신이 있었다.2000년에 Halpin과 Harbury는 DNA 부호화 조합 라이브러리의 분할 혼합 합성의 고체 지원을 생략하고 이를 부호화 DNA 올리고머로 대체했다.고체상 분할 및 풀 합성에서는 라이브러리의 컴포넌트 수가 서포트 비즈 수를 초과할 수 없습니다.저자들의 참신한 접근법에 의해, 이러한 제약은 완전히 제거되었고 실질적으로 무제한의 [42]새로운 화합물을 조제할 수 있게 되었다.예를 들어 덴마크 회사 Nuevolution은 40조!의[43] 성분을 포함하는 DNA 인코딩 라이브러리를 합성했습니다. DNA 인코딩 라이브러리는 스크리닝에서 효율적인 친화성 결합을 적용할 수 있는 용해성이 있습니다.일부 저자는 DEL을 DNA 부호화 조합 라이브러리의 단위에 적용하며 다른 저자는 DEL을 사용한다.이러한 라이브러리의 조합적 특성이 명확하게 표현되어 있기 때문에 후자가 더 나은 것 같습니다.현재 천년의 첫 10년 동안 여러 종류의 DNA 부호화 조합 라이브러리가 도입되고 설명되었다.이 도서관들은 약물 연구에 매우 성공적으로 적용되었다.
- 2001년 Gartner [44]등에 의해 기술된 조합 라이브러리의 DNA 템플릿 합성.
- Mlecco [45]등에 의해 2004년에 발명된 조합 라이브러리를 코드화한 이중 약초 DNA.
- 2004년에 [46]Harbury Halpin 및 Harbury에 의해 발행된 시퀀스 부호화 라우팅.
- 2008년 Manocci 등에 [47]의해 도입된 단일 약초 DNA 부호화 조합 라이브러리.
- DNA 부호화[48] 조합 라이브러리 2009년 Hansen 등에 의해 발행된 헥토리터급 원자로를 사용하여 형성되었다.
합성 및 응용에 대한 자세한 내용은 DNA 인코딩 화학 라이브러리에서 확인할 수 있습니다.수용성 조합 라이브러리로 암호화된 DNA에도 단점이 있습니다.우선, 견고한 서포트를 사용하는 것으로부터 얻을 수 있는 메리트가 완전히 없어집니다.또한 사슬을 코드하는 DNA의 폴리이온 특성은 합성에서의 비수성 용제의 효용을 제한한다.이러한 이유로 많은 실험실에서 DECL 합성에 사용하기 위해 DNA 호환 반응을 개발합니다.이용 가능한 것 중 상당수는 이미[49][50][51] 기술되어 있습니다.
재료과학
재료 과학은 새로운 물질의 발견에 조합 화학 기술을 적용했다.이 작품은 P.G.에 의해 개척되었다. 실리콘 기판상에 소자를 공착시켜 얻은 발광 재료의 맥락에서 슐츠 등.1970년 J[53]. J. Hanak에 의해 그의 연구가 선행되었지만, 그 당시에는 컴퓨터와 로봇 공구가 보급될 수 없었다.여러 학회[54][55][56][57] 및 대규모 연구개발 프로그램을 보유한 기업(Symyx Technologies, GE, Dow Chemical 등)에 의해 작업이 지속되고 있습니다.이 기술은 촉매 작용,[58] 코팅,[59] 전자 [60]및 기타 많은 [61]분야에서 광범위하게 사용되어 왔습니다.생성된 [62]방대한 양의 데이터를 처리, 관리 및 저장하기 위해서는 적절한 정보 분석 도구를 사용하는 것이 중요합니다.조합 방법을 사용하여 처리할 수 있는 큰 [63]실험 공간을 효율적으로 다루기 위해 새로운 유형의 실험 방법 설계도 개발되었습니다.
다양성 지향 라이브러리
조합 화학은 20년 이상 초기 약물 발견에 필수적인 부분이었지만, 지금까지 오직 한 가지 새로운 조합 화학 합성 화학 물질만이 [64]FDA에 의해 임상 사용을 위해 승인되었다.접근법의 낮은 성공률 분석은 조합 [65]화학의 산물에 의해 다루어지는 다소 제한된 화학 공간과 연결된다고 제안되었다.조합 화학 라이브러리의 화합물 특성을 승인된 약물과 천연물의 특성과 비교할 때, 페허와[65] 슈미트는 조합 화학 라이브러리가 특히 키라리티의 부족과 구조 강성으로 인해 어려움을 겪고 있으며, 두 가지 모두 약물과 유사한 특성으로 널리 간주되고 있다.제약 업계에서 최근 times,[표창 필요한]더라도 천연물 신약 개발을 아니다 아마도 가장 유행하는 추세 새로운 화학물의 큰 비율 여전히 compounds,[66][67][68][69][70][71] 것이며, 따라서 그것은 조합 화학의 효율성이 될 수도 있고 나는 제안되어 왔다 nature-derived 있다.화학 diversi을 향상시킴으로써 Proved.도서관 [72]상영의 ty.키랄리티와 강성이 조합 화학 라이브러리에서 승인된 약물과 천연물을 화합물로부터 구별하는 두 가지 가장 중요한 특징이기 때문에, 이것들은 소위 다양성 지향 라이브러리, 즉 화학 공간의 커버리지를 목표로 하는 화합물 컬렉션에서 강조된 두 가지 문제이다.마운드[73][74][75][76][77][78]
특허분류서브클래스
2006년 1월 1일부터 시행된 국제특허분류(IPC) 제8판에서는 조합화학 분야의 발명과 관련된 특허출원 및 특허에 대해 특별한 서브클래스인 'C40B'가 신설되었다.
「 」를 참조해 주세요.
레퍼런스
- ^ Pottel, J.; Moitessier, N. (2017). "Customizable Generation of Synthetically Accessible, Local Chemical Subspaces". J. Chem. Inf. Model. 57 (3): 454–467. doi:10.1021/acs.jcim.6b00648. PMID 28234470.
- ^ a b c 푸르카 A.Tanulmanny, Gyögyaszatilag hasznosihthato 펩타이드 szisztematikus felkutatasannak lehetségérll (및 약학적으로 유용한 펩타이드 체계적 검색 가능성에 관한 연구 https://mersz.hu/mod/object.php?objazonosito=matud202006_f42772_i2
- ^ Furka AH (2002년)조합화학 20년 전...Drug Discov오늘 7시 1-4시 https://doi.org/10.1016/S1359-6446(02)00001-6
- ^ "COMBINATORIAL CHEMISTRY: A REVIEW". International Journal of Pharmaceutical Sciences and Research. 4 (7). July 2013. doi:10.13040/IJPSR.0975-8232.4(7).2502-16. Retrieved June 21, 2020.
- ^ Lesney, Mark S. (2002). "Concocting combinatorials: Chemistry in drug development". Retrieved October 19, 2018.
- ^ Dolle, Roland (2011). Historical overview of chemical library design. in Zhou, J.Z. (ed.), Chemical Library Design, Methods in Molecular Biology, Springer, 2011, Chapter 1, pp. 3-25.
- ^ Podlewska, S.; Czarnecki, W.M.; Kafel, R.; Bojarski, A.J. (2017). "Creating the New from the Old: Combinatorial Libraries Generation with Machine-Learning-Based Compound Structure Optimization". J. Chem. Inf. Modeling. 57 (2): 133–147.
- ^ 제프리 W. 누난 외"효율적인 정제, 정량화 및 특성화 기법을 통한 병렬 솔루션 위상 라이브러리 합성 촉진" 실험실 자동화 저널, 48 (1992) 3789.
- ^ E. V. Gordeeva 등"컴패스 프로그램 - 컴퓨터 지원 합성에 대한 독창적인 반경험적 접근법" 4면체, 48(1992) 3789.
- ^ 합성에 의한 펩타이드의 푸르카 AH, 세베스티엔 F, 아스게돔 M, 디보 G. 코르누코피아.현대 생화학 하이라이트, 제14회 국제생화학회의 속행.VSP.Utrecht.1988; 5; 페이지 47
- ^ A. Furka, F. Sebesten, M. Asgedom, G. Dibo, 다성분 펩타이드 혼합물의 신속한 합성을 위한 일반 방법.Int. J. 펩타이드 단백질 내성, 1991년, 37, 487-493.
- ^ 메리필드 RB, 1963 J. Am화학부, 85번지, 2149번지
- ^ Scott, J.; Smith, G. (1990-07-27). "Searching for peptide ligands with an epitope library". Science. American Association for the Advancement of Science (AAAS). 249 (4967): 386–390. Bibcode:1990Sci...249..386S. doi:10.1126/science.1696028. ISSN 0036-8075. PMID 1696028.
- ^ Cwirla, S. E.; Peters, E. A.; Barrett, R. W.; Dower, W. J. (1990-08-01). "Peptides on phage: a vast library of peptides for identifying ligands". Proceedings of the National Academy of Sciences. 87 (16): 6378–6382. Bibcode:1990PNAS...87.6378C. doi:10.1073/pnas.87.16.6378. ISSN 0027-8424. PMC 54537. PMID 2201029.
- ^ J. J. Devlin, L. C. Panganiban 및 P. E. Devlin Science 1990, 249, 404.
- ^ Fodor SP, Read JL, Pirrung MC, Stryer L, Lu AT, Solas D, 1991.빛 방향, 공간적으로 주소 지정 가능한 병렬 화학 합성.과학 251, 767-73
- ^ H.M.가이슨, R.H.멜로엔, S.J. 바틀링 프로.Natl. Acad.미국 1984년, 81, 3998년
- ^ E. J. Moran, S. Sarshar, J. F. Cargill, M.샤바즈, A 리오, A. M. M. M. M. Mjali, R. W. 암스트롱 J. Am.화학부, 1995년, 117, 10787
- ^ K. C. 니콜라우, X–Y. 샤오, Z.파룬도쉬, A.센에이, M. P. 노바 앵규화학 회사Ed. Engl. 1995, 36, 2289
- ^ A. 퍼카, J. W. 크리스텐슨, E. 힐리, H. R. 태너, H. 사네이 J. 콤2000년, 2, 220년
- ^ Booth, R. John; Hodges, John C. (1999–2001). "Solid-Supported Reagent Strategies for Rapid Purification of Combinatorial Synthesis Products". Accounts of Chemical Research. 32 (1): 18–26. doi:10.1021/ar970311n. ISSN 0001-4842.
- ^ Armstrong, Robert W.; Combs, Andrew P.; Tempest, Paul A.; Brown, S. David; Keating, Thomas A. (1996–2001). "Multiple-Component Condensation Strategies for Combinatorial Library Synthesis". Accounts of Chemical Research. 29 (3): 123–131. doi:10.1021/ar9502083. ISSN 0001-4842. S2CID 95815562.
- ^ Still, W. Clark (1996–2001). "Discovery of Sequence-Selective Peptide Binding by Synthetic Receptors Using Encoded Combinatorial Libraries". Accounts of Chemical Research. 29 (3): 155–163. doi:10.1021/ar950166i. ISSN 0001-4842.
- ^ DeWitt, Sheila Hobbs; Czarnik, Anthony W. (1996–2001). "Combinatorial Organic Synthesis Using Parke-Davis's DIVERSOMER Method". Accounts of Chemical Research. 29 (3): 114–122. doi:10.1021/ar950209v. ISSN 0001-4842.
- ^ Schwabacher, Alan W.; Shen, Yixing; Johnson, Christopher W. (1999–2009). "Fourier Transform Combinatorial Chemistry". Journal of the American Chemical Society. 121 (37): 8669–8670. doi:10.1021/ja991452i. ISSN 0002-7863.
- ^ Ellman, Jonathan A. (1996–2001). "Design, Synthesis, and Evaluation of Small-Molecule Libraries". Accounts of Chemical Research. 29 (3): 132–143. doi:10.1021/ar950190w. ISSN 0001-4842.
- ^ a b Gordon, E. M.; Gallop, M. A.; Patel, D. V. (1996–2001). "Strategy and Tactics in Combinatorial Organic Synthesis. Applications to Drug Discovery". Accounts of Chemical Research. 29 (3): 144–154. doi:10.1021/ar950170u. ISSN 0001-4842.
- ^ A. 펩타이드 라이브러리의 Furka 서브 라이브러리 조성.스크리닝에서의 응용 가능성.약물개발연구 33, 90-97(1994)
- ^ Erb E, Janda KD, Brenner S(1994) 조합 화학 라이브러리 Proc의 재귀 디콘볼루션.Natl Acad Sci.USA 91; 11422-11426.
- ^ Furka AH, 세베스티엔 F, WC 93/24517, 1993.
- ^ Pinilla C, Appel JR, Blanc P, Houten RA(1993) 위치 주사 합성 펩타이드 조합 라이브러리를 사용하여 고친화성 펩타이드 배위자의 신속한 식별.바이오테크놀로지 13(6), 901-5.
- ^ Carell TE, Winter A, Rebek J Jr.(1994) 작은 유기 분자를 포함하는 라이브러리 합성을 위한 새로운 절차, Angew Chem Int Ed Engl 33; 2059-2061.
- ^ Campian E, Peterson M, Sanii HH, Furka AH, (1998) 누락 라이브러리에 의한 디콘볼루션, 바이오리그 & [ Med Chem Letters 8; 2357-2362.
- ^ J. A. Smith J. G. R. Hurrel, S. J. Leach 항원 결정 인자를 기술하는 새로운 방법: 동일한 고체 지지대를 사용하는 펩타이드 합성과 방사성 면역 분석.1977년, 14년, 565년
- ^ S. J. Taylor, J. P. Morken이 1998, 280, 267 부호화 폴리머 결합 라이브러리 과학에서 유효 촉매의 서모그래피 선택.
- ^ Ohlmeyer MHJ, Swanson RN, Dillard LW, Reader JC, Asouline G, Kobayashi R, Wigler M, Still WC(1993) 분자 태그로 색인화된 복합 합성 화학 라이브러리, Proc Natl Acad Sci USA 90; 10922-1026.
- ^ Sarkar M, Pascal BD, Steckler C, Aquino C., Micalizio GC, Kodadek T, Chalmers MJ(1993) 디코딩 분할 및 전자 전달 해리 탠덤 질량 분석기, Jam Soc 질량 분석기, 24-367:
- ^ Kerr JM, Banville SC, Zuckermann RN(1993) 비자연 아미노산을 함유한 인코딩 조합 펩타이드 라이브러리, J Am Chem.Soc 115; 2529-2531
- ^ Nikolaev V, Stierandova A, Krchnak V, Seligmann B, Lam KS, Salmon SE, Lebl M, (1993) 고체상 지지대에서 합성 및 테스트된 라이브러리 내 비배열성 고분자의 구조 결정을 위한 펩타이드 인코딩.
- ^ Brenner S, Lerner RA. (1992) 코드 조합 화학.Natl Acad Sci USA 89; 5381-5383.
- ^ Nielsen J, Brenner S, Janda KD.(1993) 부호화 조합 화학의 구현을 위한 합성 방법.미국화학회지, 115 (21); 9812–9813.
- ^ Harbury DR, Halpin DR(2000) WO 00/23458.
- ^ B. Halford DNA로 인코딩된 도서관이 어떻게 약물 발견에 혁명을 일으키고 있는지.C&EN 2017, 95, 제25호
- ^ Gartner ZJ, Tse BN, Grubina RB, Doyon JB, Snyder TM, Liu DR(2004) DNA-Templated Organic Synthes and Library of Macrocycle, Science 305; 1601-1605.
- ^ Melkko S, Scheuermann J, Dumelin CE, Neri D(2004) 자체 조립 화학 라이브러리 Nat Biotechnol 22; 568-574.
- ^ Halpin DR, Harbury PB (2004) DNA Display I.DNA 집단의 시퀀스 부호화 라우팅, PLoS Biology 2; 1015-102.
- ^ Mannoci L, Zhang Y, Scheuerman J, Leimbacher M, De Bellis G, Rizi E, Dumelin C, Melko S 및 Neri N(2008) DNA 인코딩 화학 라이브러리에서 분리된 결합 분자의 식별을 가능하게 한다.
- ^ Hansen MH, Blakskjér P, Petersen LK, Hansen TH, Höjfelt JW, Gothelf KV, HansenNJV(2009) 소형 몰레큘 진화를 위한 Yoctoliter-Scale DNA Reactor for Small-Moleculer Evolution (2009) Jam Chem-13-27.1327;
- ^ Luk KC, Satz AL (2014) DNAcompat호환 화학 : Goodnow Jr.RA Editor DNA 인코딩 화학 핸드북:화학적 공간과 약물 발견을 위한 이론과 응용, 와일리, 페이지 67-98.
- ^ Satz AL, Cai J, Chen Y, ,, Goodnow R, Felix Gruber F, Kowalczyk A, Petersen A, Naderi-Oboodi G, Orchuski L, Strebel Q (2015) DNA 호환 다단계 합성 및 DNA 부호화 라이브러리에 적용
- ^ Li Y, Gabrile E, Samain F, Favalli N, Sladojevich F, Scheuermann J, Neri D (2016) DNA 인코딩 조합 라이브러리, ACS Comb Sci 18 (8); 438–443.
- ^ X - D. 샹 외"소재 발견을 위한 조합적 접근" 사이언스 268 (1995) 1738
- ^ J.J. Hanak, J. MaterSci, 1970, 5, 964-971
- ^ 센싱 재료 개발을 위한 조합 방법, Springer, 2009.ISBN 978-0-387-73712-6
- ^ V. M. 미르스키, V. 쿨리코프, Q하오, O.S. 울프바이스.화학감응성 고분자 조합 화학 마이크로어레이의 다파라미터 높은 스루풋 특성 평가마크로몰렉랩, 통신, 2004, 25, 253-258
- ^ 코이누마 외"공동 솔리드 스테이트 재료 과학과 기술" Sci.테크놀어드밴스 자료 1 (2000) 1 무료 다운로드
- ^ 안드레이 이오누트 마르데레 외"공동 솔리드 스테이트 재료 과학과 기술" Sci.테크놀Adv. Mater. 9 (2008) 035009 무료 다운로드
- ^ 적용 촉매 분석 A, 제254권, 제1호, 1-170페이지 (2003년 11월 10일)
- ^ J. N. Cawse 등, 유기 코팅의 진전, 제47권, 제2호, 2003년 8월, 페이지 128-135
- ^ High-Throughput Materials Science를 위한 조합 방법, MRS Proceedings Volume 1024E, 2007년 가을
- ^ 재료 과학 II의 조합 및 인공지능 방법, MRS Proceedings Volume 804, 2004년 가을
- ^ QSAR and Combinatory Science, 24, 넘버원(2005년 2월)
- ^ J. N. Cawse, Ed., Experimental Design for Combinatory and High Throughput Materials Development, John Wiley and Sons, 2002.
- ^ D. Newman과 G. Cragg "지난 25년간 신약의 원천으로서의 천연 제품" J Nat Prod 70 (2007) 461
- ^ a b M. Feher와 J. M. Schmidt "성질 분포: 약물, 천연물 및 조합 화학 분자의 차이" J. Chem. Inf. 컴퓨터 Sci., 43 (2003) 218
- ^ Cordier, C.; Morton, D.; Murrison, S.; Nelson, A.; O'Leary-Steele, C. (2008). "Natural products as an inspiration in the diversity-oriented synthesis of bioactive compound libraries". Nat. Prod. Rep. 25: 719–737. doi:10.1039/B706296F.
- ^ de Sousa Luis, J.A.; Costa Barros, R.P.; de Sousa, N.F.; Muratov, E.; Scotti, L.; Scotti, M.T. (2021). "Virtual screening of natural products database". Mini-Rev. Med. Chem. 21: 2657–2730. doi:10.2174/1389557520666200730161549.
- ^ Harvey, A.L. (2008). "Natural products in drug discovery". Drug Discov. Today. 13: 894–901. doi:10.1016/j.drudis.2008.07.004.
- ^ Kohli, S. (2018). Integrated approach to nature as source of new drug lead, in Molecular Insight of Drug Design, Ed. Aditya, A. IntechOpen. pp. 29–44. doi:10.5772/intechopen.74961.
- ^ Kaiser, M.; Wetzel, S.; Kumar, K.; Waldmann, H. (2008). "Biology-inspired synthesis of compound libraries". Cell. Mol. Life Sci. 65: 1186–1201. doi:10.1007/s00018-007-7492-1.
- ^ Teague, S.J.; Davis, A.M.; Leeson, P.D.; Oprea, T. (1999). "The design of leadlike combinatorial libraries". Angew. Chem. Int. Ed. 38: 3743–3748. doi:10.1002/(SICI)1521-3773(19991216)38:24<3743::AID-ANIE3743>3.0.CO;2-U.
- ^ Su QB, Beeler AB, Lobkovsky E, Porco JA, Panelk JS "사이클로다이머라이즈를 통한 입체 화학적 다양성:폴리케티드 유사 마크로디올라이드의 합성.Org Lett 2003, 5:2149-2152.
- ^ Medina-Franco, J.L.; Martínez-Mayorga, K.; Giulianotti, M.A.; Houghten, R.A.; Pinilla, C. (2008). "Visualization of the chemical space in drug discovery". Curr Comput-Aided Drug Des. 4: 322–333.
- ^ Rosén, J.; Gottfries, J.; Muresan, S.; Backlund, A.; Oprea, T.I. (2009). "Novel Chemical Space Exploration via Natural Products". J. Med. Chem. 52: 1953–1962. doi:10.1021/jm801514w.
- ^ Lachance, H.; Wetzel, S.; Kumar, K.; Waldmann, H. (2012). "Charting, Navigating, and Populating Natural Product Chemical Space for Drug Discovery". J. Med. Chem. 55: 5989–6001. doi:10.1021/jm300288g.
- ^ Reymond, J.-L.; Awale, M. (2012). "Exploring Chemical Space for Drug Discovery Using the Chemical Universe Database". ACS Chem. Neurosci. 3: 649–657. doi:10.1021/cn3000422.
- ^ Medina-Franco, J.L. (2013). Chemoinformatic characterization of the chemical space and molecular diversity of compound libraries, in Diversity-Oriented Synthesis: Basics and Applications in Organic Synthesis, Drug Discovery, and Chemical Biology, Trabocchi, A.; Ed., Chapter 10, 2013, 325-352. John Wiley & Sons, Inc.
- ^ Klein, R.; Lindell, S.D. (2014). Combinatorial Chemistry Library Design, in, Plant Chemical Biology, Audenaert, D.; Overvoorde, P.; Eds. New Jersey: John Wiley & Sons, Inc. pp. 40–63.
 사용되는
사용되는