인산나트륨
Sodium phosphide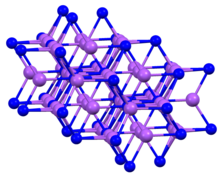 | |
| 이름 | |
|---|---|
| 기타 이름 인산나트륨, 공통 트리소다이오인산염 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.031.834 |
| EC 번호 |
|
펍켐 CID | |
| |
| |
| 특성. | |
| NAP3 | |
| 어금질량 | 99.943 g/190 |
| 외관 | 적색 결정체 |
| 밀도 | 1.74 g/cm3 |
| 녹는점 | 650°C(1,202°F, 923K) |
| 가수 분해 | |
| 용해성 | 액체2 CO에서 불용성인 |
| 구조 | |
| 육각형의 a = 4.9512 å c = 8.7874 å | |
| 약 P 5 부근, 삼각 bipyramid | |
| 관련 화합물 | |
기타 음이온 | 염화나트륨 질화 나트륨 |
기타 양이온 | 알루미늄 인산염 인산 리튬 인산칼륨 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
인산나트륨은 NaP라는3 공식을 가진 무기 화합물이다. 그것은 검은 고체다. 흔히3− P 음이온의 나염으로+ 묘사된다.[2] NaP는3 고반응성 인산염 음이온의 근원이다. 인산나트륨, NaPO와34안 된다 혼동해서는.
NaP3 외에도 나트륨과 인의 5가지 다른 이항 성분인 NaP, NaP37, NaP3117, NaP, NaP가15 알려져 있다.[3]
구조 및 특성
이 화합물은 육각형 모티브로 결정되는데, 흔히 비소화 나트륨 구조라고 불린다.[4] KP와3 마찬가지로 솔리드 NaP는3 펜타코르데인 P 센터를 특징으로 한다.[1]
준비
NaP의3 첫 준비는 19세기 중반에 처음 보고되었다. 프랑스 연구원인 알렉상드르 보드리몽은 녹은 나트륨을 인 펜타클로라이드로 처리하여 인산나트륨을 준비했다.[5]
NaP로3 가는 많은 다른 경로들이 설명되어 왔다. 가연성과 독성 때문에 NaP3(및 관련 염류)를 현장에서 준비하여 사용하는 경우가 많다. 백인은 나트륨-칼륨 합금에 의해 감소한다.[6]
- P4 + 12 Na → 4 NaP3
인은 150 °C에서 5시간 동안 오토클레이브 내 나트륨과 반응하여 NaP를3 생성한다.[7]
또는 정상 압력에서 반응하되 온도 구배를 사용하여 비휘발성 NaPx 단계(x < 3)를 생성한 다음 나트륨과 추가로 반응할 수 있다.[8] 나프탈렌과 같은 전자전달제를 사용하는 경우도 있다. 그런 응용에서 나프탈렌은 수용성 나프탈레네이드 나트륨을 형성하여 인을 감소시킨다.[9]
사용하다
인산나트륨은 고반응성 인산염 음이온의 근원이다. 이 물질은 모든 용매에서 용해되지 않지만, 산과 관련된 전기생성 물질로 슬러리(slurry)로 반응하여 PM형식의3 파생상품을 제공한다.[6]
- NaP3 + 3 E+ → EP3 (E = H, MeSi3)
트리메틸실릴 유도체는 휘발성(b.p. 30-35C @ 0.001 mm Hg)이며 용해성이 있다. 그것은 "P3−"에 상당하는 수용성 역할을 한다.
인듐인산화물인 인듐은 인듐(III) 염화물이 함유된 '소듐인산화물'을 뜨거운 N,N'-디메틸포름아미드에 용매로 처리해 반도체에서 인듐인산염은 인듐인산염이다. 이 과정에서 인산염 시약은 나트륨 금속과 백색 인에서 생성되며, 인듐 소금과 즉시 반응한다.[10]
- Na3P + InCl3 → InP + 3NaCl
인산나트륨은 폴리머 생산을 위해 아연 인산염과 알루미늄 인산염과 함께 촉매로 상업적으로 이용되기도 한다. 프로필렌의3 3차 촉매 중합에서 NaP를 제거하면 4-메틸-1-펜틴은 효과가 없다.[11][citation needed]
주의사항
인산나트륨은 가수분해 시 독성인산을 방출하는 매우 위험한데, 이 과정은 발열성이 매우 강해서 발화가 일어난다. USDOT는 잠재적인 화재와 독성 위험 때문에 여객기, 화물 전용 항공기, 열차에서의 NaP3 운송을 금지했다.[12]
참조
- ^ a b Dong, Y; Disalvo, F.J (2005). "Reinvestigation of Na3P based on single-crystal data". Acta Crystallographica Section E. 61 (11): i223–i224. doi:10.1107/S1600536805031168.
- ^ Yunle, G; Fan, G; Yiate, Q; Huagui, Z; Ziping, Y (2002). "A solvothermal synthesis of ultra-fine iron phosphide". Materials Research Bulletin. 37 (6): 1101–1106. doi:10.1016/S0025-5408(02)00749-3.
- ^ 무기화학, 에곤 위버그, 아놀드 프레데릭 홀러맨 엘스비에 2001 ISBN 0-12-352651-5
- ^ 비스터, H.J.; 샤센, K.; 클라인, J."압력을 받는3 NaA의 위상 전환" Zeitschrift für Naturforschung B: 화학 과학 1990, 제45권, p1388-p1392. doi:10.1515/znb- 1990-1007
- ^ Baudrimont (1864). Annales de chimie et de physique. 2: 13.
{{cite journal}}: 누락 또는 비어 있음title=(도움말) - ^ a b Becker, Gerd; Schmidt, Helmut; Uhl, Gudrun (1990). Tris(trimethylsilyl)phosphine and Lithium Bis(Trimethylsilyl)Phosphide.Bis-(Tetrahydrofuran). Inorganic Syntheses. Vol. 27. pp. 243–249. doi:10.1002/9780470132586.ch48. ISBN 9780470132586.
- ^ Xie, Y; Su, H; Li, B; Qian, Y (2000). "Solvothermal preparation of tin phosphide nanorods". Materials Research Bulletin. 35 (5): 675–680. doi:10.1016/S0025-5408(00)00263-4.
- ^ Jarvis, R. F.; Jacubinas, R. M.; Kaner, R. B. (2000). "Self-Propagating Metathesis Routes to Metastable Group 4 Phosphides". Inorganic Chemistry. 39 (15): 3243–3246. doi:10.1021/ic000057m. PMID 11196860.
- ^ 피터슨, D. J. 1967. 미국 특허 3,397,039호.
- ^ Khanna, P.K; Eum, M.-S; Jun, K.-W; Baeg, J.-O; Seok, S. I (2003). "A novel synthesis of indium phosphide nanoparticles". Materials Letters. 57 (30): 4617–4621. doi:10.1016/S0167-577X(03)00371-9.
- ^ Y. 아타라시; 후쿠모토, O. 일본 특허 번호 JP 42006,269.
- ^ Kenneth L Barbalace. "Sodium phosphide". Chemical Database.



