트리코빌하르지아 리젠티
Trichobilharzia regenti| 트리코빌하르지아 리젠티 | |
|---|---|
 | |
| 트리코빌하르지아 리젠티, 세카리아 | |
| 과학적 분류 | |
| 왕국: | 애니멀리아 |
| 문: | 평탄한 문양 |
| 주문: | 디플로스토미다 |
| 패밀리: | 히스토소마과 |
| 속: | 트리코빌하지아 |
| 종류: | T. 리젠티 |
| 이항명 | |
| 트리코빌하르지아 리젠티 호라크, 콜라쇼바 & 드보르크, 1998 | |
Trichobilharzia regenti는 사람에게도 체르카리아성 피부염을 일으키는 [2]조류의 신경병성 기생 편형충이다.이 종은 1998년 체코[1] 공화국에서 처음 기술되었고 이후 덴마크,[3] 독일,[4] 프랑스,[5] 아이슬란드,[6] 폴란드,[7][8] 스위스,[9] 러시아 [10]등 다른 유럽 국가에서도 발견되었고 심지어 [11][12]이란에서도 검출되었다.척추동물 숙주에서의 독특한 신경로피적 행동을 위해 숙주와 기생충의 상호작용은 분자생물학,[13][14] 생화학 및 면역학의 관점에서 광범위하게 연구된다.
라이프 사이클
T. regenti의 라이프 사이클은 인간혈흡충의 라이프 사이클과 유사합니다.성충은 반신반의 코 점막(예: 아나스 플라티린코스, 주걱 또는 카이리나 모스카타)에서 짝짓기를 하고, 기적을 가진 알을 생산하며, 이 알은 숙주 조직에서 직접 부화해 새가 술을 마시거나 먹이를 [1]먹을 때 밖으로 새어 나옵니다.일단 물에 들어가면, 미라키디아는 섬모를 사용하여 헤엄치고 적절한 연체동물 중간 숙주(Radix lagotis, Radix labiaata, Radix peregra.[15]달팽이에서 기적은 2차 포자낭이 형성되는 1차 포자낭으로 발달하여 나중에 [16]서카리아를 발생시킨다.
전염성 유충인 Cercariae는 달팽이에서 나와 조류 숙주의 피부를 뚫고 들어간다.숙주의 피부에 침투한 후 면역원성 표면[17] 글리코칼릭스를 제거하고 주혈흡충(하성체기, sg. chistosomulum)으로 변한다.그리고 나서 주혈흡충은 척수에 도달하는 데 사용할 말초신경을 찾습니다.그것을 통해 그들은 뇌로[18][19] 이동을 계속하고, 마지막으로 코 조직으로 이동한다.여기서, 그들은 병리(염증 침투, 출혈)[20]를 일으키면서 성숙하고, 교미하고, 알을 낳는다.
만약 포유류가 새 대신 서카리아에 감염되면, 기생충은 면역 [21]반응에 의해 피부에 갇히게 된다.그러한 감염의 임상적 징후는 체르카리아 [2][22]피부염이라고 불리는 방치된 알레르기 질환으로 알려져 있다.생쥐, 특히 면역 결핍 생쥐에서 기생충이 척수로 이동하는 것이 [23][24]관찰되었다.
T. regenti의 전체 라이프 사이클은 Radix lagotis와 국내산 오리(Anas platyrynchos f. domesta)를 각각 [1]중간 숙주 및 최종 숙주로 사용하여 실험실 조건에서 유지될 수 있습니다.흥미롭게도, 국내산 오리는 [12]논과 같은 양식장에서도 저수지의 숙주 역할을 할 수 있다.포유류의 T. regenti 생물학을 연구하기 위해 C57BL/6, BALB/c SCID 마우스 균주를 우발 [24][25][26]숙주로 사용한다.
척추동물 숙주의 이동
T. regenti의 cercariae가 조류나 포유동물의 숙주를 발견하면, 그들은 그것의 피부를 뚫고 들어간다.이를 위해 각질 및 콜라겐 [27][28]분해가 가능한 시스테인 펩티드가 배설/분비 생성물에 포함되어 있다.T. regenti(TrCB2)의 시스테인 펩티드가수분해효소 카테프신 B2의 실험실에서 준비한 재조합 형태에 대한 실험에서 피부 단백질(콜라겐, 케라틴 및 엘라스틴)[29]을 절단하는 능력이 확인되었다.
피부에 침투한 후, 체르카리아는 주혈흡충으로 변형되어 숙주의 몸을 통해 이동을 시작합니다.그들은 혈관에 침투하는 것을 피하고 오히려 숙주의 사지에 있는 말초 신경에 들어가는 것을 선호한다.주혈흡충은 오리와 생쥐의 말초신경에서 각각 [19]감염 후 1.5일, 1일 이내(DPI)에 나타난다.두 종류의 숙주에서, 주혈흡충은 척추 뿌리를 [25]통해 들어가는 중추신경계에 높은 친화력을 보인다.최근 3D 영상 기술(초현미경 및 마이크로CT)에 의한 관찰에 따르면, 주혈흡충은 조류와 [26]포유류 모두에서 척수의 백질을 통해 이동하는 것이 바람직하다.
감염의 다음 과정은 최종 숙주와 우발 숙주가 다르다.오리에서, 주혈흡충은 척수 3 DPI의 신낭 부분에서 관찰되고 7-8일 후(10-11 DPI) 뇌까지 도달한다.최종 국소화(비강 조직)에서 13~14DPI가 발생하며 알을 낳는 [19][20]것은 15DPI부터 시작된다.쥐에서 첫 번째 주혈흡충은 이르면 2DPI의 요추 척수에서 발견되고 다음 날 수질이 침범되지만 일부 개체에서만 발견됩니다.대부분의 주혈흡충은 흉추와 경추 척수에 국소적으로 유지되며 예외적으로 [18][19]뇌로 이동한다.벌레의 존재는 비강에서 발견되지 않았고 신경 조직에서도 그들의 성숙이 감지되지 않았다.생쥐의 주혈흡충 발육은 숙주 면역반응 및/또는 일부 필수(영양, 자극) 숙주 [24]인자의 존재/부재로 인해 억제될 수 있다.
척추동물 숙주의 병리
T. regenti에 감염된 척추동물 숙주에서 병리학적 상태는 다음과 같이 발생할 수 있다.
- 침투성 세카리아가 피부에서 주혈흡충으로 변질되어
- 중앙신경계(CNS)를 통해 이동하는 주혈흡충증,
- 코 점막에 알을 낳는 성체(조류 숙주에만 해당)
쥐는 우발적인 숙주이지만, T. regenti의 병리학적 영향을 다루는 대부분의 연구는 이 모델에 대해 수행되었다.
피부병리
감염의 초기 단계에서는 초기 변형된 주혈흡충이 피부에서 국소화된다.새의 피부에 있는 병리학에 대한 정보는 아직 완성되지 않았다.생쥐에서, 즉각적인 부종과 부위의 비후화는 Cercariae 침투 후 30분 이내에 나타난다. 홍반 또한 뚜렷하다.48시간 이내에 호중구, 호산구, 대식세포, CD4+ 림프구 및 탈과립성 비만세포를 포함한 염증성 균이 [21][23]기생충 주위에 생긴다.
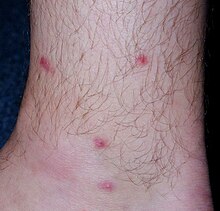
반복 감염의 경우 세포 침윤이 상당히 증가하며 광범위한 염증이 큰 농양의 형성 또는 표피 및/또는 피부 [21]괴사를 초래할 수 있다.사람의 경우, 체르카리 침투의 임상 증상은 심한 가려움증을 동반한 기생충이 피부로 들어간 부위의 황반/포자 형성으로 구성된다.그 증상은 이전에 예민했던 사람들에게서 더 심각하다.T. regenti뿐만 아니라 다른 새의 주혈흡충 종들의 Cercariae에 의해 야기되는 이 질병은 Cercaria 피부염이라고 불립니다.그것은 방치된 알레르기 [2][22]질환으로 여겨진다.
CNS병리학
T. regenti 감염의 다음 단계는 중추신경계의 주혈흡충 이동으로 나타난다.이것은 다리 마비나 균형 [18]장애를 겪는 새들의 심각한 신경학적 이상을 동반한다.오리에서는 호산구 및 이종구에 둘러싸인 기생충이 있는 호산구성 수막염이 관찰되었다.또한 백혈구는 중심관 [30]부근의 혈관 주변 공간과 조직에 침투했다.
이 단계에서 주혈흡충은 기생충 [25]장강 내 올리고덴드로사이트와 뉴런 검출로 증명된 신경조직을 먹고 산다.이동성 주혈흡충의 장에 국재하는 T.regenti(TrCB1)의 시스테인펩티다아제 카테프신 B1은 미엘린 염기성 단백질 분해가 가능하므로 신경조직 소화에 [31]도움이 될 수 있다.그럼에도 불구하고 신경조직 섭취는 숙주 중추신경조직에 경미한 병원성 [25]영향만 미칠 수 있다.이는 면역력이 떨어진 [23][25]숙주에서만 다리 마비가 관찰된 것에 의해 뒷받침되는 반면, 면역적합 마우스 변종 실험에서는 감염된 동물이 신경학적 [19][23][25]장애를 드러내지 않았다.신경학적 증상은 아마도 신경 조직의 기계적 손상에서 비롯되어 신경 세포의 수축 또는 괴사적 변화와 축삭 손상으로 이어질 수 있습니다.그 원인은 적절한 면역 [23][25][30]반응에 의해 파괴되지 않는 큰 이동성 주혈흡충(약 340×80μm)이다.
비강병리학
조류 숙주에서 T. regenti는 코 조직에 도달하여 짝짓기를 하고 알을 낳습니다.이 부위의 총 병리학은 점막 전체에 분산된 국소 출혈로 구성된다.림프구의 침윤은 난자 주위에 존재하며 림프구, 호산구 및 헤테로필을 포함한 육아종도 후기에 형성된다.유리 기적을 중심으로 유사한 침윤이 존재하지만 육아종의 형성은 기록되지 않았다.성충 [20]근처에서는 세포 반응이 관찰되지 않았다.
척추동물 숙주의 면역 반응
오리
오리의 T. 리젠티에 대한 세포 면역 반응에 대한 기록은 다소 부족하다.그러나 반복적으로 감염된 오리의 해당 피부 부위의 세포 침투는 더 [32]이상 침투 세포의 특성이 결여되어 있을 뿐이다.CNS에서는 호산구 및 헤테로필이 기생충을 둘러싸고 있지만 비강 [18]점막의 최종 국부적 위치로의 이동을 막지는 않는다.
항체 반응을 고려할 때 항체 IgM은 15DPI에 도달하고 항체 IgY는 30DPI에 도달한다.높은 나이에 감염된 오리는 낮은 나이에 감염된 오리에 비해 항체르카리아 IgY 수치가 높다.그러나 항세르카리아 IgY 수준은 감염 선량에 크게 의존하지 않는다.숙주 IgY에 의해 특이적으로 인식된 몇몇 기생충 항원은 면역진단제의 [33]후보로 간주된다.
마우스
감염은 초기 1형 과민반응과 후기 피부염으로 나타난다.
세포면역반응은 처음으로 [21]감염된 생쥐의 피부에서 소염증(IL-1β, IL-6 및 IL-12p40)과 항염증(IL-10) 사이토카인의 생성으로 나타난다.림프절을 배출하는 피부 림프구는 기생충 [21][34]항원에 노출된 후 혼합 Th1/Th2 분극을 보인다.반대로 항염증 IL-4와 IL-10은 반복적으로 감염된 생쥐에서 우세하며, 이는 또한 비만 세포에서 다량의 히스타민을 분비한다.림프절을 배출하는 피부의 림프구는 기생충 항원을 자극한 후 IL-4와 IL-5를 생성하며, 이는 숙주 면역반응의 [21]Th2 분극화를 나타낸다.
척수에서 과립구, 혈장세포, 대식세포 및 T세포로 이루어진 강한 세포면역반응은 특히 손상된 주혈흡충 주변에 면역적합 생쥐에서 발생한다.CD3 결핍 쥐는 신경 조직에 [23][25][30]가해진 기계적 손상으로 인해 신경학적 증상을 동반하는 가벼운 염증이 전혀 또는 단지 발생한다.활성화된 미세글리아는 주혈흡충의 이동 경로와 기생충 잔류물을 포함한 염증 병변에서 국부화된다.따라서, 그들은 단독으로 또는 대식세포와 T세포와의 협력으로 주혈흡충 파괴에 참여하도록 제안되었다.비대화된 성상세포는 이동 경로와 주혈흡충 근처에 위치해 면역 반응과 조직 [25]수복에서 그들의 역할을 암시한다.쥐 성세포와 미세글리아는 기생충 항원에 시험관내 피폭 후 항염증성 사이토카인(IL-6, TNF-α)과 일산화질소를 생성하는 것으로 나타났으며, 이는 숙주 면역 [35]반응에 있어 이들의 역할을 뒷받침한다.
IgM 항체 반응 대상은 주로 기생충 [36]분자의 탄수화물 에피토프이다.기생충 특이 IgG1과 IgG2a는 [34]7DPI에 바로 존재한다.IgG1과 IgG2b의 고농도는 반복적으로 감염된 생쥐에서 150DPI까지 검출되지만, 대부분 Cercarical Homogenate의 단백질 에피토프에 특이적인 IgG2a는 검출되지 않는다.총 IgE 수치는 10DPI와 동시에 증가하며 재감염된 [36]생쥐에서 최대 150DPI까지 높은 수준을 유지한다.항원 특이 IgG1 및 총 IgE의 생산 증가, 그러나 항원 특이 IgG2b의 경미한 감소는 반복적으로 감염된 [21][36]개인에서 Th2 면역 분극화를 확증한다.
인간
T. 리젠티 감염에 대한 인간 면역 반응의 임상적 징후는 체르카리아 피부염(수영자의 [2][22]가려움증)으로 알려져 있다.체르카리아 피부염(미정 조류혈흡충 종에 의해 발생)을 경험한 대부분의 인간(성인의 82%, 어린이의 57%)은 T. regenti 항원 특이 IgG의 수치를 증가시켰지만 IgE는 증가시키지 않았다.T. regenti의 Cercaria 균질화 및 배설 분비물은 Cercaria 피부염 병력이 없는 사람에게서 IL-4를 [36]탈과 방출하도록 유도한다.
레퍼런스
- ^ a b c d Horák P, Kolárová L, Dvorák J (December 1998). "Trichobilharzia regenti n. sp. (Schistosomatidae, Bilharziellinae), a new nasal schistosome from Europe". Parasite. 5 (4): 349–57. doi:10.1051/parasite/1998054349. PMID 9879557.

- ^ a b c d Horák P, Mikeš L, Lichtenbergová L, Skála V, Soldánová M, Brant SV (January 2015). "Avian schistosomes and outbreaks of cercarial dermatitis". Clinical Microbiology Reviews. 28 (1): 165–90. doi:10.1128/CMR.00043-14. PMC 4284296. PMID 25567226.
- ^ Christiansen AØ, Olsen A, Buchmann K, Kania PW, Nejsum P, Vennervald BJ (March 2016). "Molecular diversity of avian schistosomes in Danish freshwater snails". Parasitology Research. 115 (3): 1027–37. doi:10.1007/s00436-015-4830-3. PMID 26573519. S2CID 18519058.
- ^ Prüter H, Sitko J, Krone O (March 2017). "Having bird schistosomes in mind-the first detection of Bilharziella polonica (Kowalewski 1895) in the bird neural system". Parasitology Research. 116 (3): 865–870. doi:10.1007/s00436-016-5359-9. PMID 28012027. S2CID 22625424.
- ^ Jouet D, Skírnisson K, Kolárová L, Ferté H (September 2010). "Final hosts and variability of Trichobilharzia regenti under natural conditions". Parasitology Research. 107 (4): 923–30. doi:10.1007/s00436-010-1953-4. PMID 20556426. S2CID 10383377.
- ^ Skírnisson K, Kolářová L, Horák P, Ferté H, Jouet D (May 2012). "Morphological features of the nasal blood fluke Trichobilharzia regenti (Schistosomatidae, Digenea) from naturally infected hosts". Parasitology Research. 110 (5): 1881–92. doi:10.1007/s00436-011-2713-9. PMID 22146993. S2CID 18351593.
- ^ Rudolfová J, Littlewood DT, Sitko J, Horák P (June 2007). "Bird schistosomes of wildfowl in the Czech Republic and Poland". Folia Parasitologica. 54 (2): 88–93. doi:10.14411/fp.2007.011. PMID 17886736.
- ^ Marszewska, Anna; Strzała, Tomasz; Cichy, Anna; Dąbrowska, Grażyna B.; Żbikowska, Elżbieta (2018-09-13). "Agents of swimmer's itch—dangerous minority in the Digenea invasion of Lymnaeidae in water bodies and the first report of Trichobilharzia regenti in Poland". Parasitology Research. 117 (12): 3695–3704. doi:10.1007/s00436-018-6068-3. ISSN 0932-0113. PMC 6224017. PMID 30215139.
- ^ Picard, D.; Jousson, O. (September 2001). "Genetic variability among cercariae of the Schistosomatidae (Trematoda: Digenea) causing swimmer's itch in Europe". Parasite (Paris, France). 8 (3): 237–242. doi:10.1051/parasite/2001083237. ISSN 1252-607X. PMID 11584754.
- ^ Korsunenko AV, Chrisanfova GG, Ryskov AP, Movsessian SO, Vasilyev VA, Semyenova SK (August 2010). "Detection of European Trichobilharzia schistosomes ( T. franki, T. szidati, and T. regenti ) based on novel genome sequences". The Journal of Parasitology. 96 (4): 802–6. doi:10.1645/GE-2297.1. PMID 20677938. S2CID 20445108.
- ^ Fakhar M, Ghobaditara M, Brant SV, Karamian M, Gohardehi S, Bastani R (April 2016). "Phylogenetic analysis of nasal avian schistosomes (Trichobilharzia) from aquatic birds in Mazandaran Province, northern Iran". Parasitology International. 65 (2): 151–8. doi:10.1016/j.parint.2015.11.009. PMID 26631753.
- ^ a b Ashrafi, Keyhan; Nouroosta, Alireza; Sharifdini, Meysam; Mahmoudi, Mohammad Reza; Rahmati, Behnaz; Brant, Sara V. (2018-10-20). "Genetic diversity of an avian nasal schistosome causing cercarial dermatitis in the Black Sea-Mediterranean migratory route". Parasitology Research. 117 (12): 3821–3833. doi:10.1007/s00436-018-6087-0. ISSN 1432-1955. PMID 30343420. S2CID 53043270.
- ^ "Laboratory of Helminthology, Charles University in Prague, Czech Republic". Retrieved 2016-03-20.
- ^ Leontovyč R, Young ND, Korhonen PK, Hall RS, Tan P, Mikeš L, Kašný M, Horák P, Gasser RB (February 2016). "Comparative Transcriptomic Exploration Reveals Unique Molecular Adaptations of Neuropathogenic Trichobilharzia to Invade and Parasitize Its Avian Definitive Host". PLOS Neglected Tropical Diseases. 10 (2): e0004406. doi:10.1371/journal.pntd.0004406. PMC 4749378. PMID 26863542.
- ^ Huňová K, Kašný M, Hampl V, Leontovyč R, Kuběna A, Mikeš L, Horák P (September 2012). "Radix spp.: Identification of trematode intermediate hosts in the Czech Republic". Acta Parasitologica. 57 (3): 273–84. doi:10.2478/s11686-012-0040-7. PMID 22875675. S2CID 235463.
- ^ Peštová, Jitka (2015). Differentiation of totipotent germinal cells in larvae of bird schistosomes [in Czech]. Master's thesis. Charles University in Prague, Czech Republic.
- ^ Řimnáčová J, Mikeš L, Turjanicová L, Bulantová J, Horák P (2017-03-15). "Changes in surface glycosylation and glycocalyx shedding in Trichobilharzia regenti (Schistosomatidae) during the transformation of cercaria to schistosomulum". PLOS ONE. 12 (3): e0173217. Bibcode:2017PLoSO..1273217R. doi:10.1371/journal.pone.0173217. PMC 5351870. PMID 28296924.
- ^ a b c d Horák P, Dvorák J, Kolárová L, Trefil L (December 1999). "Trichobilharzia regenti, a pathogen of the avian and mammalian central nervous systems". Parasitology. 119 ( Pt 6) (6): 577–81. doi:10.1017/s0031182099005132. PMID 10633919.
- ^ a b c d e Hrádková K, Horák P (June 2002). "Neurotropic behaviour of Trichobilharzia regenti in ducks and mice". Journal of Helminthology. 76 (2): 137–41. doi:10.1079/JOH2002113. PMID 12015826. S2CID 6387025.
- ^ a b c Chanová M, Horák P (June 2007). "Terminal phase of bird schistosomiasis caused by Trichobilharzia regenti (Schistosomatidae) in ducks (Anas platyrhynchos f. domestica)". Folia Parasitologica. 54 (2): 105–7. doi:10.14411/fp.2007.014. PMID 17886739.
- ^ a b c d e f g Kourilová P, Hogg KG, Kolárová L, Mountford AP (March 2004). "Cercarial dermatitis caused by bird schistosomes comprises both immediate and late phase cutaneous hypersensitivity reactions". Journal of Immunology. 172 (6): 3766–74. doi:10.4049/jimmunol.172.6.3766. PMID 15004181.
- ^ a b c Kolářová L, Horák P, Skírnisson K, Marečková H, Doenhoff M (August 2013). "Cercarial dermatitis, a neglected allergic disease". Clinical Reviews in Allergy & Immunology. 45 (1): 63–74. doi:10.1007/s12016-012-8334-y. PMID 22915284. S2CID 32704545.
- ^ a b c d e f Kourilová P, Syrůcek M, Kolárová L (May 2004). "The severity of mouse pathologies caused by the bird schistosome Trichobilharzia regenti in relation to host immune status". Parasitology Research. 93 (1): 8–16. doi:10.1007/s00436-004-1079-7. PMID 15034785. S2CID 19462770.
- ^ a b c Blazová K, Horák P (September 2005). "Trichobilharzia regenti: the developmental differences in natural and abnormal hosts". Parasitology International. 54 (3): 167–72. doi:10.1016/j.parint.2005.03.003. PMID 15908263.
- ^ a b c d e f g h i Lichtenbergová L, Lassmann H, Jones MK, Kolářová L, Horák P (August 2011). "Trichobilharzia regenti: host immune response in the pathogenesis of neuroinfection in mice". Experimental Parasitology. 128 (4): 328–35. doi:10.1016/j.exppara.2011.04.006. PMID 21554878.
- ^ a b Bulantová J, Macháček T, Panská L, Krejčí F, Karch J, Jährling N, Saghafi S, Dodt HU, Horák P (April 2016). "Trichobilharzia regenti (Schistosomatidae): 3D imaging techniques in characterization of larval migration through the CNS of vertebrates". Micron. 83: 62–71. doi:10.1016/j.micron.2016.01.009. PMID 26897588.
- ^ Mikes L, Zìdková L, Kasný M, Dvorák J, Horák P (June 2005). "In vitro stimulation of penetration gland emptying by Trichobilharzia szidati and T. regenti (Schistosomatidae) cercariae. Quantitative collection and partial characterization of the products". Parasitology Research. 96 (4): 230–41. doi:10.1007/s00436-005-1347-1. PMID 15868186. S2CID 765928.
- ^ Kasný M, Mikes L, Dalton JP, Mountford AP, Horák P (October 2007). "Comparison of cysteine peptidase activities in Trichobilharzia regenti and Schistosoma mansoni cercariae" (PDF). Parasitology. 134 (Pt 11): 1599–609. doi:10.1017/S0031182007002910. hdl:10453/5909. PMID 17517170. S2CID 14440074.
- ^ Dolecková K, Kasný M, Mikes L, Cartwright J, Jedelský P, Schneider EL, Dvorák J, Mountford AP, Craik CS, Horák P (January 2009). "The functional expression and characterisation of a cysteine peptidase from the invasive stage of the neuropathogenic schistosome Trichobilharzia regenti". International Journal for Parasitology. 39 (2): 201–11. doi:10.1016/j.ijpara.2008.06.010. PMC 2625449. PMID 18708063.
- ^ a b c Kolárová L, Horák P, Cada F (August 2001). "Histopathology of CNS and nasal infections caused by Trichobilharzia regenti in vertebrates". Parasitology Research. 87 (8): 644–50. doi:10.1007/s004360100431. PMID 11511002. S2CID 2895174.
- ^ Dvorák J, Delcroix M, Rossi A, Vopálenský V, Pospísek M, Sedinová M, Mikes L, Sajid M, Sali A, McKerrow JH, Horák P, Caffrey CR (July 2005). McKerrow John; Horák Petr; Caffrey Conor. "Multiple cathepsin B isoforms in schistosomula of Trichobilharzia regenti: identification, characterisation and putative role in migration and nutrition". International Journal for Parasitology. 35 (8): 895–910. doi:10.1016/j.ijpara.2005.02.018. PMID 15950230.
- ^ Pech, Václav (2013). Peroral infections of birds and mammals with the neuropathogenic fluke Trichobilharzia regenti. Master's thesis. Charles University in Prague, Czech Republic.
- ^ Turjanicová L, Mikeš L, Pecková M, Horák P (July 2015). "Antibody response of definitive hosts against antigens of two life stages of the neuropathogenic schistosome Trichobilharzia regenti". Parasites & Vectors. 8 (1): 400. doi:10.1186/s13071-015-1007-y. PMC 4517386. PMID 26216102.
- ^ a b Majer, Martin; Macháček, Tomáš; Súkeníková, Lenka; Hrdý, Jiří; Horák, Petr (2020-03-07). "The peripheral immune response of mice infected with a neuropathogenic schistosome". Parasite Immunology. 42 (6): e12710. doi:10.1111/pim.12710. ISSN 0141-9838. PMID 32145079. S2CID 212629117.
- ^ Macháček T, Panská L, Dvořáková H, Horák P (November 2016). "Nitric oxide and cytokine production by glial cells exposed in vitro to neuropathogenic schistosome Trichobilharzia regenti". Parasites & Vectors. 9 (1): 579. doi:10.1186/s13071-016-1869-7. PMC 5109812. PMID 27842570.
- ^ a b c d Lichtenbergová L, Kolbeková P, Kourilová P, Kasný M, Mikes L, Haas H, Schramm G, Horák P, Kolárová L, Mountford AP (2008-11-01). "Antibody responses induced by Trichobilharzia regenti antigens in murine and human hosts exhibiting cercarial dermatitis". Parasite Immunology. 30 (11–12): 585–95. doi:10.1111/j.1365-3024.2008.01059.x. PMC 2680328. PMID 19067839.