장상피
Intestinal epithelium| 장상피 | |
|---|---|
 단순주상피세포 | |
| 식별자 | |
| FMA | 17229 |
| 해부학 용어 | |
| 이 기사는 에 관한 시리즈의 일부입니다. |
| 에피틸리아 |
|---|
| 편평상피세포 |
| 주상피세포 |
| 입방체상피세포 |
| 특수 상피 |
| 다른. |
 |
| 이 기사는 에 게재된 시리즈 중 하나입니다. |
| 위장벽 |
|---|
장상피는 위장관의 소장(대장)과 대장(대장)의 내강 표면(라이닝)을 형성하는 단일 세포층이다.단순한 원기둥 모양의 상피 세포로 구성되며, 두 가지 주요 기능을 합니다: 유용한 물질을 체내에 흡수하고 유해 물질의 진입을 제한하는 것입니다.보호 역할의 일부로서, 장 상피는 장 점막 장벽의 중요한 구성 요소를 형성합니다.어떤 질병과 질환은 장 상피의 기능적 결함으로 인해 발생한다.반면에, 다양한 질병과 상태는 그것의 기능 장애를 초래할 수 있고, 다시, 더 많은 합병증으로 이어질 수 있다.
구조.
장 상피는 장 점막의 일부입니다.상피는 단일 세포층으로 구성되며, 점막의 다른 두 층인 라미나 프로프리아와 근막은 상피층을 지지하고 표현합니다.장내강 함유량을 확실히 억제하기 위해 상피층의 세포를 밀접합에 의해 결합함으로써 비교적 투과성이 높은 연속막을 형성한다.
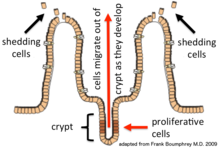
상피 세포는 세포 분열, 성숙 및 이동 과정을 통해 4-5일마다 지속적으로 갱신된다.갱신은 장샘의 지하(기저)에 있는 증식 세포(줄기 세포)에 의존합니다(기저 결합 [1]조직으로의 상피 침윤).기부에 형성된 후, 새로운 세포는 위쪽으로 이동하며 지하실에서 나와 길을 따라 성숙합니다.결국, 그들은 아포토시스를 거쳐 장내강으로 [2]흘러 들어간다.이와 같이 상피층을 구성하는 세포의 수가 [3]일정하게 유지되면서 장의 내막이 항상 갱신된다.
소장에서 점막층은 특히 영양소의 흡수를 최대화하기 위해 넓은 표면적을 제공하도록 적응되어 있다.흡수 표면의 팽창은 단순한 원통형 튜브의 600배 이상으로, 다음의 세 가지 해부학적 특징을 통해 [4]달성됩니다.
- 원형 접힘은 내강 내용물의 통과를 느리게 하는 가로 접힘으로 전체 표면적을 3배 확대하는 역할을 합니다.
- 융모와 장샘은 점막 표면적을 10배로 늘리는 역할을 한다.
- 장구 첨단을 덮는 마이크로빌리가 흡수면을 20배 증가시킨다.이 수많은 현미경(지름 100나노미터)의 손가락 모양의 돌기는 물결 모양의 브러시 테두리를 형성합니다.
상피 세포의 꼭대기 표면의 브러시 테두리는 막 당단백질과 당지질에 [5]부착된 올리고당으로 구성된 글리코칼릭스로 덮여 있습니다.
셀 타입
일곱 가지 다른 종류의 세포들이 [6]크립트의 밑부분에 있는 줄기세포에 의해 생산된다.각 타입은 특정 차별화 프로그램에 따라 크립토 위/밖으로 이행할 때 성숙합니다.다른 상피 세포 유형으로 분화하는 데 필요한 많은 유전자가 확인되고 특성화되었습니다(이 표 참조).생성된 세포 유형은 장세포, 고블렛 세포, 장내분비 세포, 파네스 세포, 미세 접이식 세포, 컵 세포, 태프트 세포입니다.그 기능은 다음과 같습니다.[7]
- 장구들은 가장 많고 주로 영양소 흡수를 위해 기능한다.장세포는 외부 내강 표면에 많은 이화효소를 발현하여 분자를 세포에 흡수하기에 적합한 크기로 분해한다.장구에 의해 흡수되는 분자의 예로는 이온, 물, 단당, 비타민, 지질, 펩타이드, 아미노산 등이 있다.
- 고블렛 세포는 내강 내용물로부터 상피를 보호하는 점액층을 분비한다.
- 장내분비세포는 세크레틴, 판크레자민, 장루카곤 등 다양한 위장호르몬을 분비한다.감각 장상피세포의 서브셋은 [8]신경과 시냅스하며 신경세포로 알려져 [9]있다.
- 패네스 세포는 인간 알파-데펜신과 [10][11]같은 항균성 펩타이드를 생성한다.
- 마이크로폴드 세포(일반적으로 M 세포라고 함)는 내강에서 항원을 추출하여 점막(MALT)과 관련된 림프 조직으로 전달합니다.소장에서 M세포는 Peyer의 패치와 연관되어 있다.
- 컵셀은 개별 셀 타입이지만 기능은 알려져 있지 않습니다.
- 태프트 세포는 면역 [12]반응의 한 부분을 담당한다.
소화관 전체에 걸쳐, 상피 세포의 다른 종류의 분포는 그 [3]영역의 기능에 따라 달라집니다.
세포 접합부의 구조 구성 요소
장상피의 장벽 기능에 중요한 역할을 하는 세포는 초미세 구조 [14]수준에서 식별될 수 있는 네 가지 유형의 접합부(세포 접합부)[13]에 의해 안전하게 결합됩니다.
갭 접합
갭 접합은 인접한 셀을 서로 2나노미터 이내로 가져옵니다.그들은 다단백질 복합체를 형성하기 위해 함께 모인 코넥신 유전자 패밀리에 의해 코드된 여러 개의 상동 단백질에 의해 형성된다.이 복합체의 분자 구조는 육각형이다.결합된 두 세포의 세포막에 포함된 복합체는 6개의 단백질 가운데 틈새 또는 채널을 형성한다.이 채널은 다양한 분자, 이온, 전기 충격을 두 [15]세포 사이를 통과하게 합니다.
데스모솜
카데린 계열의 막간 접착 단백질로 구성된 이러한 복합체는 세포 골격을 [16]통해 인접한 세포를 연결한다.데스모솜은 [15]세포 사이에 30나노미터의 간격을 둔다.
아데렌스 교차로
조눌라 아데렌이라고도 불리는 아데렌 결합은 카테닌과 카드헤린 계열의 단백질에 의해 형성되는 다단백질 복합체이다.세포들은 세포들 사이의 접점에서 막에 위치합니다.그것들은 세포내 어댑터 단백질, 트랜스막 단백질 및 세포의 액틴 세포골격 간의 상호작용에 의해 형성된다.이러한 복합체들은 인접한 세포를 연결하는 역할 외에도 상피 이동, 세포 극성 및 다른 세포 [14]접합 복합체의 형성을 조절하는데 중요하다.
촘촘한 접합부
Zonula occludens라고도 불리는 단단한 접합부는 장벽 [17]기능 때문에 장 상피의 가장 중요한 구성요소이다.클라우딘과 오크루딘 계열의 구성원으로 주로 형성되는 이러한 복합체는 약 35개의 다른 [13]단백질로 구성되며, 세포 주위에 고리 모양의 연속 리본을 형성하고, 측면 및 꼭대기 [14]막의 경계 근처에 위치한다.
인접한 세포에서 막외 단백질의 세포외 도메인이 교차하여 단단히 밀폐되어 있습니다.이러한 상호작용은 동일한 막의 단백질과 인접한 세포의 단백질 사이의 상호작용을 포함한다.또한, 상호작용은 호모성(동일한 단백질 간) 또는 이종호성(다른 단백질 [14]간)일 수 있다.
아데렌 접합과 유사하게, 단단한 접합의 세포 내 도메인은 세포 골격 연결, 세포 극성, 세포 신호 전달 [14]및 방광 전달을 조절하기 위해 서로 다른 골격 단백질, 어댑터 단백질 및 신호 복합체와 상호작용합니다.
타이트 접합은 상피층의 인접 세포 사이에 좁지만 변형 가능한 씰을 제공하여 [14]용질의 선택적 세포수송을 제공한다.이전에는 정적 구조라고 생각되었지만, 타이트 접합은 이제 동적인 것으로 알려져 세포 사이의 개구부 크기를 변경할 수 있으며, 따라서 발달, 생리학 및 [17]병리학의 다른 상태에 적응할 수 있다.그들은 상피층의 첨단과 기저외측 구획 사이에서 선별적이고 반투과성 파세포 장벽으로 기능한다.이들은 작은 이온과 수용성 용질이 세포 내 공간을 통과하도록 촉진하는 동시에 내강 항원, 미생물 및 그 [14]독소의 통과를 막는 기능을 한다.
생리학
장 상피는 운동을 촉진하고 소화,[18] 흡수, 면역 및 신경 내분비 기능을 조정하는 복잡한 해부학적 구조를 가지고 있습니다.
고블렛 세포에서 분비되는 점액은 윤활유 역할을 하며 점막 내용물에 [19]의한 자극으로부터 상피 세포층을 보호합니다.
전통적으로 비밀세포는 주로 분비세포로 간주되었고, 장세포는 주로 흡수세포로 간주되었다.그러나 최근의 연구는 이러한 고전적인 기능 분할에 도전하여 표면 세포와 암호 세포 모두 분비 기능과 흡수 기능을 모두 수행할 수 있으며 실제로 이러한 기능이 [20][21]동시에 발생할 수 있다는 것을 보여주었다.
영양소 섭취
장구 꼭대기 표면의 브러시 테두리를 덮는 것은 글리코칼릭스이며, 글리코칼릭스는 일체막 가수분해효소의 올리고당 측쇄와 단백질 및 탄수화물의 소화에 필수적인 기타 효소로 이루어진 느슨한 네트워크이다.이러한 당단백질, 당지질, 그리고 효소는 내장 탄수화물과 단백질의 마지막 소화 단계를 촉매합니다.이렇게 생성된 단당류와 아미노산은 장 상피를 거쳐 최종적으로 [5]혈류로 운반된다.
전해질과 물의 흡수는 소화관의 가장 중요한 기능 중 하나이다.수분 흡수는 용질 흐름의 속도와 방향에 따라 수동적이고 등각적입니다.액체 흡수에 영향을 미치는 다른 요인으로는 삼투압과 특정 장 [18]영역이 있습니다.조절된 선택적 투과성은 경세포(트랜세피탈) 경로와 파세포 [14]경로의 두 가지 주요 경로를 통해 수행됩니다.
세포 투과율
이것은 상피세포를 가로지르는 용질의 특정 수송으로 구성됩니다.이는 주로 특정 전해질, 아미노산, 설탕, 짧은 사슬 지방산 및 기타 분자를 세포 [14]내부 또는 세포 밖으로 이동시키는 전문 전달체의 활동에 의해 조절된다.
세포 투과성
세포 투과성은 상피 세포 사이에 존재하는 공간을 통한 운송에 달려있다.세포막에서 [14]국소화된 세포 접합부에 의해 조절됩니다.이것은 장 상피를 가로지르는 물과 용질의 수동적인 흐름의 주요 경로이다.조절은 세포내 [22]수송에 가장 큰 영향을 미치는 세포간 밀착에 따라 달라진다.전자현미경을 사용한 연구에 따르면 상피층의 전기저항은 긴밀접합막경막단백질복합체 내의 복잡성과 필라멘트의 수에 따라 달라지는 것으로 나타났다.[18]또한 상피세포의 플라즈마막 저항 및 가변막 통과 전도율도 파세포 경로 [18]기능을 변조할 수 있다.
기능들
장상피로 형성되는 장벽은 외부 환경(장내강 내용물)을 신체에서[14] 분리하는 가장 광범위하고 중요한 [17]점막 표면이다.
장 상피는 선천적 면역 특성과 적응적 면역 기능을 모두 나타내며 몇 가지 중요한 기능을 한다.세포내 및 세포외 환경을 면밀히 모니터링하고, 주변 세포에 메시지를 전달하며, [23]필요에 따라 능동적인 방어 및 복구 조치를 신속하게 시작합니다.한편으로 이물질, 독소, 미생물 [13][14]등 유해물질의 침입을 막는 장벽 역할을 한다.반면에, 그것은 장내강으로부터 식이 영양소,[14] 전해질, 물 그리고 다양한 다른 유익한 물질들의 흡수를 용이하게 하는 선택적 필터 역할을 한다.
장벽 건전성이 상실되면 장내 투과성이 증가하여 유해물질의 통제가 원활히 이루어지지 않을 수 있습니다.이는 개인의 유전적 성향에 따라 염증, 감염, 알레르기, 자가면역질환 또는 암이 창자 자체 또는 다른 [18]장기 내에서 발병하게 할 수 있습니다.
비록 그들이 주로 소화 시스템의 일부로 기능하지만, 장상피의 장세포는 또한 다양한 종류의 미생물을 인식하고 면역 체계 [24][25]기능에 기여하는 톨 유사 수용체와 뉴클레오티드 올리고머화 도메인 단백질을 표현한다.따라서 장상피는 장내강과 체내를 분리하는 물리적 장벽 역할을 할 뿐만 아니라 내재면역계의 일부로서 병원체 인식 기능을 수행한다.
인간의 건강에 대한 중요성
장상피의 무결성 상실은 염증성 장질환(IBD)[26]에 중요한 병원성 역할을 한다.장내 미생물의 구성 변화는 IBD 발달에 중요한 환경 요인이다.장내 미생물의 해로운 변화는 장상피 손상을 초래하는 부적절한 (제어되지 않은) 면역 반응을 유도한다.이 중요한 장벽(장내 상피)의 파괴는 마이크로바이오타의 추가 침투를 허용하고, 이는 다시 추가적인 면역 반응을 이끌어냅니다.그럼에도 불구하고 IBD는 부분적으로 상피 장벽 [27]기능의 결함을 야기하는 내장 미생물군에 대한 과도한 면역 반응에 의해 유발되는 다인자 질환이다.
「 」를 참조해 주세요.
레퍼런스
- ^ Clevers H (2013). "The intestinal crypt, a prototype stem cell compartment". Cell. 154 (2): 274–84. doi:10.1016/j.cell.2013.07.004. PMID 23870119.
- ^ van der Flier, Laurens G.; Clevers, Hans (1 January 2009). "Stem cells, self-renewal, and differentiation in the intestinal epithelium". Annual Review of Physiology. 71: 241–260. doi:10.1146/annurev.physiol.010908.163145. ISSN 1545-1585. PMID 18808327.
- ^ a b Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James (1 January 2000). "Intestinal Architecture and Development". Molecular Cell Biology (4th ed.). W. H. Freeman. ISBN 978-0716731368.
- ^ Khurana (1 January 2005). Textbook Of Medical Physiology. Elsevier India. p. 641. ISBN 9788181478504.
- ^ a b Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James (1 January 2000). "Transport across Epithelia".
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ Laurens G. van der Flier; Hans Clevers (2009). "Stem Cells, Self-Renewal, and Differentiation in the Intestinal Epithelium". Annual Review of Physiology. 71 (1): 241–260. doi:10.1146/annurev.physiol.010908.163145. PMID 18808327.
- ^ Sarmento, Bruno (30 September 2015). Concepts and Models for Drug Permeability Studies: Cell and Tissue based In Vitro Culture Models. Woodhead Publishing. pp. 57–58. ISBN 9780081001141.
- ^ Bohórquez, Diego; Liddle, Rodger (2015). "Neuroepithelial circuit formed by innervation of sensory enteroendocrine cells". Journal of Clinical Investigation. 125 (2): 782–786. doi:10.1172/JCI78361. PMC 4319442. PMID 25555217.
- ^ Kaelberer, M. Maya; Bohórquez, Diego (2018). "A gut-brain neural circuit for nutrient sensory transduction". Science. 361 (6408): eaat5236. doi:10.1126/science.aat5236. PMC 6417812. PMID 30237325.
- ^ van Es, Johan H.; Clevers, Hans (16 June 2014). "Paneth cells". Current Biology. 24 (12): R547–548. doi:10.1016/j.cub.2014.04.049. ISSN 1879-0445. PMID 24937274.
- ^ Santaolalla R, Abreu MT (2012). "Innate immunity in the small intestine". Curr Opin Gastroenterol. 28 (2): 124–9. doi:10.1097/MOG.0b013e3283506559. PMC 3502878. PMID 22241076.
- ^ Gerbe, F; Legraverend, C; Jay, P (September 2012). "The intestinal epithelium tuft cells: specification and function". Cellular and Molecular Life Sciences. 69 (17): 2907–17. doi:10.1007/s00018-012-0984-7. PMC 3417095. PMID 22527717.
- ^ a b c Khan, Niamat; Asif, Abdul R. (1 January 2015). "Transcriptional Regulators of Claudins in Epithelial Tight Junctions". Mediators of Inflammation. 2015: 219843. doi:10.1155/2015/219843. ISSN 0962-9351. PMC 4407569. PMID 25948882.
- ^ a b c d e f g h i j k l m Groschwitz, Katherine R.; Hogan, Simon P. (1 July 2009). "Intestinal Barrier Function: Molecular Regulation and Disease Pathogenesis". The Journal of Allergy and Clinical Immunology. 124 (1): 3–22. doi:10.1016/j.jaci.2009.05.038. ISSN 0091-6749. PMC 4266989. PMID 19560575.
- ^ a b Bennett, M. V.; Barrio, L. C.; Bargiello, T. A.; Spray, D. C.; Hertzberg, E.; Sáez, J. C. (1 March 1991). "Gap junctions: new tools, new answers, new questions". Neuron. 6 (3): 305–320. doi:10.1016/0896-6273(91)90241-q. ISSN 0896-6273. PMID 1848077. S2CID 33441056.
- ^ Nekrasova, Oxana; Green, Kathleen J. (1 November 2013). "Desmosome assembly and dynamics". Trends in Cell Biology. 23 (11): 537–546. doi:10.1016/j.tcb.2013.06.004. ISSN 0962-8924. PMC 3913269. PMID 23891292.
- ^ a b c Rao, Jaladanki N.; Wang, Jian-Ying (1 January 2010). "Intestinal Architecture and Development". Morgan & Claypool Life Sciences.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ a b c d e Fasano, Alessio (1 January 2011). "Zonulin and Its Regulation of Intestinal Barrier Function: The Biological Door to Inflammation, Autoimmunity, and Cancer". Physiological Reviews. 91 (1): 151–175. doi:10.1152/physrev.00003.2008. ISSN 0031-9333. PMID 21248165. S2CID 1375779.
- ^ Allen, Adrian; Flemström, Gunnar (1 January 2005). "Gastroduodenal mucus bicarbonate barrier: protection against acid and pepsin". American Journal of Physiology. Cell Physiology. 288 (1): C1–19. doi:10.1152/ajpcell.00102.2004. ISSN 0363-6143. PMID 15591243. S2CID 6668280.
- ^ Geibel, John P. (1 January 2005). "Secretion and absorption by colonic crypts". Annual Review of Physiology. 67: 471–490. doi:10.1146/annurev.physiol.67.031103.153530. ISSN 0066-4278. PMID 15709966.
- ^ Binder, Henry J.; Rajendran, Vazhaikkurichi; Sadasivan, Vidyasagar; Geibel, John P. (1 April 2005). "Bicarbonate secretion: a neglected aspect of colonic ion transport". Journal of Clinical Gastroenterology. 39 (4 Suppl 2): S53–58. doi:10.1097/01.mcg.0000155521.81382.3a. ISSN 0192-0790. PMID 15758660.
- ^ Näslund, Erik; Hellström, Per M. (10 September 2007). "Appetite signaling: from gut peptides and enteric nerves to brain". Physiology & Behavior. 92 (1–2): 256–262. doi:10.1016/j.physbeh.2007.05.017. ISSN 0031-9384. PMID 17582445. S2CID 230872.
- ^ Cario, E (2010). "Heads up! How the intestinal epithelium safeguards mucosal barrier immunity through the inflammasome and beyond". Current Opinion in Gastroenterology. 26 (6): 583–590. doi:10.1097/MOG.0b013e32833d4b88. PMID 20664345. S2CID 12976253.
- ^ Cario, E (2005). "Bacterial interactions with cells of the intestinal mucosa: Toll-like receptors and NOD2". Gut. 54 (8): 1182–93. doi:10.1136/gut.2004.062794. PMC 1774880. PMID 15840688.
- ^ Abreu, Maria T.; Fukata, Masayuki; Arditi, Moshe (15 April 2005). "TLR signaling in the gut in health and disease". Journal of Immunology. 174 (8): 4453–4460. doi:10.4049/jimmunol.174.8.4453. ISSN 0022-1767. PMID 15814663.
- ^ Maloy, Kevin J.; Powrie, Fiona (16 June 2011). "Intestinal homeostasis and its breakdown in inflammatory bowel disease". Nature. 474 (7351): 298–306. doi:10.1038/nature10208. ISSN 1476-4687. PMID 21677746. S2CID 205225483.
- ^ Coskun, Mehmet (25 August 2014). "Intestinal Epithelium in Inflammatory Bowel Disease". Frontiers in Medicine. 1: 24. doi:10.3389/fmed.2014.00024. ISSN 2296-858X. PMC 4292184. PMID 25593900.