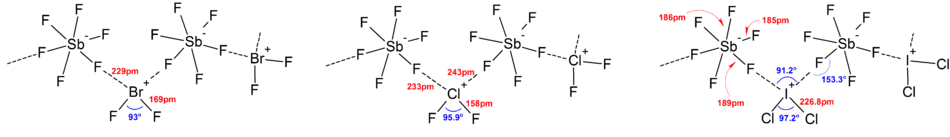폴리할로겐 이온
Polyhalogen ions폴리할로겐 이온은 할로겐만을 포함하는 다원자 양이온 및 음이온 그룹입니다.이온은 한 가지 유형의 할로겐만을 포함하는 이소폴리할로겐 이온과 두 가지 유형의 할로겐을 포함하는 헤테로폴리할로겐 이온으로 분류할 수 있습니다.
서론
수많은 폴리할로겐 이온이 발견되었으며, 염분은 고체 상태로 격리되어 구조적으로 특징지어졌습니다.다음 표는 알려진 [1][2][3][4][5][6]종을 요약한 것입니다.
| 이원자종 | *[Cl2]+, [Br2]+, [I2]+ |
| 삼원자종 | [Cl3]+, [Br3]+, [I3]+ |
| 4원자종 | [Cl4]+, [I4]2+ |
| 펜타원자종 | [Br5]+, [I5]+ |
| 헵타원자종 | †[나7]+ |
| 고등종 | [나15]3+ |
| 삼원자종 | [ClF2],+ [ClF2],+ [BrF2],+ [IF2],+ [ICL2],+ [IBrCl],+ [IBR2],+ [ICL2],+ [IBR2]+ |
| 펜타원자종 | [CLF4],+ [BrF4],+ [IF4],+ [ICL32]+ |
| 헵타원자종 | [CLF6],+ [BrF6],+ [IF6]+ |
| 삼원자종 | [Cl3]−, [Br3]−, [I3]− |
| 4원자종 | [Br4]2−, [I4]2− |
| 펜타원자종 | [나5]− |
| 헵타원자종 | [나7]− |
| 옥타원자종 | [Br8]2−, [I8]2− |
| 고등종 | [I9],−2− [I1010],4− [I11],−2− [I12],3− [I13], [I16],2−4− [I22],3− [I26], [I26],4− [I], [I28],4− [I], [I], [I], [I], [I], [I29]3− |
| 삼원자종 | [ClF2],− [BrF22],−− [BrCl22],− [IF],− [ICL],− [IBrF],−− [IBrCl2], [ICL2],− [IBr2],− [AtBrCl],− [AtBr2],−− [RIB]− |
| 펜타원자종 | [ClF4],− [BrF4],− [IF44],− [ICL3],−− [IBrCl3],− [ICL23],− [ICL22], [IBrCl],− [IBrCl2223],− [IBR],− [ICL4],− [IBR4]− |
| 육원자종 | [IF5]2− |
| 헵타원자종 | [CLF6],− [BrF6],− [IF6],− [IBR34]− |
| 비원자종 | [IF8]− |
구조.
이온의 대부분의 구조는 IR 분광학, 라만 분광학, X선 결정학에 의해 결정되었다.폴리할로겐 이온은 항상 이온에 존재하는 가장 무겁고 가장 작은 전기음성 할로겐을 중심 원자로 가지고 있으며, 경우에 따라서는 이온이 비대칭이 됩니다.예를 들어 [ClF2]+의 구조는 [Cl-Cl-F]−이지만 [Cl-F-Cl]−은 아니다.
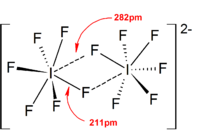
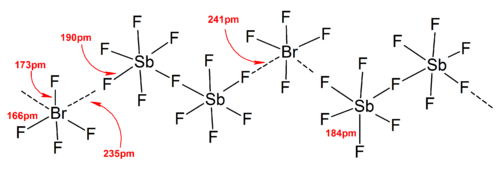
일반적으로 대부분의 헤테로폴리할로겐 이온과 낮은 이소폴리할로겐 이온의 구조는 VSEPR 모델과 일치했다.하지만 예외적인 경우도 있었다.예를 들어 중심원자가 무겁고 [BrF6]− 및 [IF6]−와 같은 7개의 외톨이쌍을 가지고 있는 경우에는 입체화학적 불활성 외톨이의 존재에 의해 일그러진 것이 아니라 불소배위자의 규칙적인 8면체 배치를 가진다.강한 양이온-음이온 상호작용으로 인해 이상적인 VSEPR 모델에서 더 많은 편차가 고체 구조에서 발견되었으며, 이는 또한 진동 분광 데이터의 해석을 복잡하게 한다.폴리할로겐 음이온염의 알려진 모든 구조에서 음이온은 할로겐 브릿지를 통해 카운터 [4]양이온과 매우 밀접하게 접촉합니다.예를 들어, 고체 상태에서 [IF6]−는 [(CH3)4N]+의 고체 구조처럼 규칙적인 8면체가 아니다.IF]−에6 느슨하게 바인드된211 [IF]2−다이머가 표시됩니다.[BrF2][+SbF6],− [ClF2][+SbF6],− [BrF4][+SbF], [BrF][SbF611]−[2]에서도 유의미한 양이온-음이온 상호작용이 발견되었습니다.
| 선형(또는 거의 선형) | [CLF2],− [BrF2],− [BrCl2],− [IF2],− [ICL22],− [IBR], [ICL], [IBR22]−−− |
| 구부러졌다 | [ClF2],+ [ClF2],+ [BrF2],+ [IF2],+ [ICL22],++ [ICL], [IBR2],++ [IBrCl2]+ |
| 정사각형 평면 | [CLF4],− [BrF4],− [IF4],− [ICL4]− |
| 디스테노이덜(또는 시소) | [CLF4],+ [BrF4],+ [IF4]+ |
| 오각형 평면 | ‡[IF5]2− |
| 팔면체 | [CLF6],+ [BrF6],+ [IF6],+ [ClF6],− [BrF6],− [IF6]− |
| 정사각형 반작용 | [IF8]− |
γ5 [IF]2−는 희귀한 오각형 평면 형상을 가진 것으로 알려진 두 개의n XY형 종 중 하나이며, 다른 하나는5 [XeF]−이다.
[ClF6]−는 염소 원자에서 입체화학적 불활성쌍 효과가 크지 않기 때문에 8면체로 일그러져 있다.
[ICL32]+ 및 [IBR32]+ 이온은 [I5]+와 유사한 트랜스-Z형 구조를 가지고 있습니다.
높은 폴리요오드화물
폴리요오드 이온은 훨씬 더 복잡한 구조를 가지고 있다.이산 폴리요오드화물은 보통 요오드 원자와 요오드화 이온의 선형 배열을 가지며, 폴리요오드화물의 기원을 반영하는 I, I− 및 [I3]− 단위 간의2 연관성으로 설명된다.고체 상태에서 폴리요오드화물은 서로 상호작용하여 체인, 링 또는 복잡한 2차원 및 3차원 네트워크를 형성할 수 있습니다.
본딩
폴리할로겐 이온의 결합은 주로 p-오비탈의 사용을 유발합니다.뫼스바우어 스펙트럼 분석의 데이터에 의해 제안된 불활성 쌍 효과로 인해 요오드가 함유된 종에서는 s-궤도 참여가 거의 없을 것으로 예상되지만, 많은 촉진 에너지가 필요하기 때문에 결합에 대한 유의한 d-궤도 참여는 있을 것 같지 않다.그러나 지금까지 [3]관찰된 다양한 접합 길이와 각도를 재현할 수 있는 접합 모델은 없었습니다.
X가 [X2]+로 이온화되면2 반결합궤도에서 전자가 제거되는 것으로부터 예상대로 [X]+의 결합순서와2 결합강도가 높아져 분자이온의 원자간 거리가 X보다2 작아진다.
선형 또는 거의 선형인 3원자 폴리할라이드는 대응하는 2원자간 할로겐 또는 할로겐에 비해 약하고 긴 결합을 가지며, 할로겐화 이온이 중성 분자에 첨가될 때 원자 간의 추가적인 반발과 일치한다.공명 이론의 사용과 관련된 또 다른 모델이 존재합니다. 예를 들어 [ICL]−은2 다음과 같은 표준 형태의 공명 하이브리드로 볼 수 있습니다.
증거는 이 이론을 지탱하면서 채권 길이([ICl2]−에 255pm그리고 ICl(g에 232시)로부터 와서 길이 쌓기 wavenumbers(267과[ICl2]−에 및 비대칭적 대칭 스트레칭을 위해 222cm−1 ICl에 384cm−1에 비해)는 것 같은 결합 차수의 약 0.5의 각 I–Cl 채권에[ICl2]−, 일관성과 해석을 이용하여 월.eresonance이론다른 3원자종(XY2)−도 마찬가지로 [2]해석할 수 있다.
합성
폴리할로겐 이온의 형성은 부모 할로겐 간 또는 할로겐의 자가 분리로 볼 수 있다.
- 2n XY [ [ +XYn-1 ]+ [ −XYn+1 ]
- 32 × ]+ [ X3 ]+ [X3]−
- 42 × [ [ X5 +]+ [X3]−
- 52 X 2 2 [ X2 +]+ 2 [ X3 −]
폴리할로겐 양이온
폴리할로겐 양이온을 준비하기 위한 두 가지 일반적인 전략이 있습니다.
- 적절한 인터할로겐과 루이스산(예를 들어 B, Al, P, As, Sb의 할로겐화물)을 불활성 또는 산화용매(예를 들어 무수 HF)로 반응시킴으로써 헤테로폴리할로겐 양이온을 얻을 수 있다.
- XYn + MYm → [XYn-1]+ + [MYm+1]−
- 할로겐 또는 인터할로겐이 산화제 및 루이스산과 반응하여 양이온을 생성하는 산화 과정:
- Cl2 + ClF + AsF5 → [ Cl3 +][ AsF6 −]
경우에 따라서는 루이스산(불소 수용체) 자체가 산화제로 작용합니다.
- 32 I + 3 SbF5 → 2 [ I3 ]+ [ SbF6 −] + SbF3
통상 헤테로폴리할로겐 양이온을 제조하기 위해 첫 번째 방법이 사용되며, 두 번째 방법은 두 가지 모두에 적용할 수 있다.산화 과정은 양이온 [IBR2],+ [ClF6],+ [BrF6]+의 제조에 유용하며, 그 모체인 할로겐 간 IBr3, ClF7, BrF는7 각각 분리되지 않았다.
- Br2 + IOSOF2 → [IBR2 +][SO3F]−
- ClF5 x 2 + PtF6 x 2 → [ ClF6 +][ PtF6 −] + [ ClF4 +][ PtF6 −]
- BrF5 + [ KrF +] [ AsF6 −]→ [ BrF6 +][ AsF6 −]+ Kr
일부 개별 종의 준비는 아래 표에 [1][2][3][4]방정식으로 간략하게 요약되어 있습니다.
| 종. | 관련 화학 방정식 | 추가 조건 필요 |
|---|---|---|
| [Cl2]+ ([CLO22]+로서) | Cl2 + [O2]+ [ SbF6 −]→ [ ClO22 +][ SbF6 −] | 저온에서 무수 HF로 |
| [Br2]+ | Br2(BrSOF3 단위) + 3 SbF5 → [Br2][+SbF316](−균형하지 않음) | 상온에서 |
| [나2]+ | 22 I + SOF262 → 2 [ I2 +][SO3F]− | HSOF에서3 |
| [+짝짝3] | Cl2 + ClF + AsF5 → [ Cl3 +][ AsF6 −] | 195K(-78°C)의 온도에서 |
| [Br3]+ | 3 Br2 + 2 [O2]+ [ AsF6 −]→ 2 [Br3]+ [ AsF6 −]+ 2 O2 | |
| [나3]+ | 32 I + SOF262 → 2 [ I3 +][SO3F]− | |
| [+짝짝4] | 2 Cl2 + IrF6 → [ Cl4 +][IrF6]− | 193K(-80°C) 미만의 온도에서 무수 HF로 사용 |
| [나4]2+ | 22 I + 3 AsF5 → [ I4 ]2+ [ AsF6 ]-2 + AsF3 | 액체2 상태의 SO |
| [Br5]+ | 8 Br2 + 3 [ XeF +][AsF6]− → 3 [Br5]+ [AsF6]− + 3 Xe + BrF3 | |
| [나5]+ | 22 I + ICL + AlCl3 → [ I5 ]+ [ AlCl4 −] | |
| [나7]+ | 72 I + SOF262 → 2 ISO73 | |
| [CLIF2]+ | ClF3 + AsF5 → [ ClF2 +][ AsF6 −] | |
| [CLIF2]+ | 2 ClF + AsF5 → [ ClF2 +][ AsF6 −] | 197 K 미만의 온도에서 |
| [BrF2]+ | 5 BrF3 + 2 Au → 3 BrF + 2 [BrF2]+[AuF4]− | 필요 이상의3 BrF를 필요로 하는 |
| [IF2]+ | IF3 + AsF5 → [ IF2 +][ AsF6 −] | |
| [ICL2]+ | ICL3 + SbCl5 → [ICL2]+ [ SbCl6 −] | |
| [IBR2]+ | Br2 + IOSOF2 → [IBR2 +][SO3F]− | |
| [CLIF4]+ | ClF5 + SbF5 → [ ClF4 +][ SbF6 −] | |
| [BrF4]+ | BrF5 + AsF5 → [BrF4]+ [ AsF6 −] | |
| [IF4]+ | IF5 + 2 SbF5 → [ IF4 +][ SbF211 −] | |
| [CLIF6]+ | ‡Cs2 [NiF6] + 5 AsF5 + ClF5 → [ ClF6 +][ AsF6 −]+ Ni [ AsF6 2]+ 2 Cs [ AsF6 ] | |
| [BrF6]+ | [KrF]+ [AsF6]− + BrF5 → [BrF6]+ [AsF6]− + Kr | |
| [IF6]+ | IF7 + BrF3 → [IF6]+ [BrF4]− |
∙ 이 반응에서 활성산화종은 [NiF3]+이며, Cs[NiF6]/AsF5/HF계에서2 제자리걸음을 한다.그것은 PtF보다6 훨씬 더 강력한 산화 및 불소화제이다.
폴리할로겐 음이온
폴리할로겐 음이온의 경우 다음 두 가지 일반적인 준비 전략이 있습니다.
- 인터할로겐 또는 할로겐을 루이스 베이스와 반응시킴으로써, 대부분의 경우 불화물:
- [(4CHCH32)+N−]Yn + XY → [(CHCH32)4N][+XYn+1]−
- X2 + X− → [X3]−
- 단순 할로겐화물의 산화에 의해:
- KI + Cl2 → K+[ICL2]−
일부 개별 종의 준비는 아래 표에 [1][2][3][4]방정식으로 간략하게 요약되어 있습니다.
| 종. | 관련 화학 방정식 | 추가 조건 필요 |
|---|---|---|
| [Cl3]−, [Br3]−, [I3]− | X2 + X− → [X3]− (X = Cl, Br, I) | |
| [Br3]− | Br2 + [(CHCHCH3222)4N]+Br− → [(CHCHCH3222)4N]+ [Br3]− | 1,2-클로로에탄 또는 액체 이산화황에 포함되어 있습니다.[Br]−은3 용액에 존재하지 않으며 소금이 결정화되었을 때만 형성된다. |
| [Br5]− | 2 Br2 + [(CHCHCH3222)4 N]+Br− → [(CHCHCH3222)4 N]+ [Br5]− | 과도한2 Br을 가진 1,2-디클로로에탄 또는 액체 이산화황 |
| [CLIF2]− | ClF + CsF → Cs+ [ ClF2 −] | |
| [BrCl2]−[7]: v1p294 | Br2 + Cl2 + 2 CsCl → 2+ Cs [ BrCl2 −] | |
| [ICL2]−[7]: v1p295 | KI + Cl2 → K+[ICL2]− | |
| [IBR2]−[7]: v1p297 | CsI + Br2 → Cs+[IBr2]− | |
| [AtBr2],− [AtICL],− [AtIBr],− [AtI2]− | AtY + X− → [AtXY]− (X = I, Br, Cl, Y = I, Br) | |
| [CLIF4]− | NOF + ClF3 → [NO]+ [ ClF4 −] | |
| [BrF4]− | 6 KCl + 8 BrF3 → 6+ K [BrF4]− + 3 Cl2 + Br2 | 필요초과BrF5 |
| [IF4]− | 2 XeF2 + [(CH3)4N]+I− → [(CH3)4N][+IF4]− + 2 Xe | 242K에서 혼합한 후 298K로 가열하여 반응이 진행되도록 했다. |
| [ICL4]−[7]: v1p298 | KI + ICL3 → K+[ICL4]− | |
| [IF5]2− | IF3 + 2 [(CH3)4N]+F− → [(CH3)4N+][2IF5]2− | |
| [IF6]− | IF5 + CsF → Cs+[IF6]− | |
| [IBR34]− | PhP4]+Br− + 3 IBr → [PhP4][+I3Br4]− | |
| [IF8]− | IF7 + [(CH3)4N]+F− → [(CH3)4N][+IF8]− | 아세토니트릴로 |
높은 폴리요오드화물은 다양한 농도의− I와2 I를 포함하는 용액의 결정화에 의해 형성되었다.예를 들어 I와 KI를2 적당량 함유한 포화용액을 [7]: v1p294 냉각하면 K[I3]−의+ 일수화물이 결정화된다.
특성.
안정성.
일반적으로 큰 카운터 양이온 또는 음이온(Cs, [SbF6]− 등+)은 패킹 효율이 높아짐에 따라 격자 에너지 고려에서 고체 상태에서 형성된 폴리할로겐 이온을 안정시키는 데 도움이 될 수 있다.
폴리할로겐 양이온은 강한 산화제이며, 이는 장석과 같은 산화성 액체에서만 제조될 수 있다는 사실에서 알 수 있습니다.[X]+와2 [XF](6+X = Cl, Br)의 종이 가장 산화되고 불안정하며, +[X]와36 [IF]+가 그 뒤를 잇는다.
[X2]+염(X = Br, I)의 안정성은 열역학적으로 상당히 안정적이다.그러나 용액에서 이들의 안정성은 초산성 용매에 따라 달라진다.예를 들어 [I2]+는 플루오로안티몬산(HF5 0.2N SbF0, H = -20.65)에서 안정적이지만 [4]SbF 대신5 NBF5, TaF, NaF 등 약한5 플루오르화물 수용체를 첨가할 경우 [I3],+ [I5],+ I]와2 불균형이 된다.
- 14 [I2]+ + 5− F → 9 [I3]+ + IF5
같은 양이온을 가진 폴리할로겐 음이온은 중심부에 무거운 할로겐이 있을수록 안정적이며 대칭 이온도 비대칭 음이온보다 안정적이다.따라서 음이온의 안정성은 다음 순서로 감소합니다.
- [I3]− > [IBR2 −−]> [ ICL2 −]> [ IBR2 ]>− [ BrBr3 ]> [ BrCl22 −−]
배위수가 4 이상인 헤테로폴리할로겐 이온은 플루오르화 배위자를 통해서만 존재할 수 있다.
색.
대부분의 폴리할로겐 이온은 강한 색상으로 구성 원소의 원자량이 증가함에 따라 색이 짙어집니다.잘 알려진 녹말-요오드 복합체는 아밀로스 [4]나선에 존재하는 선형 [I5]− 이온 때문에 짙은 파란색을 띤다.일반적인 종의 몇 가지 색은 [3]다음과 같습니다.
- 불소화합물은 무색 또는 옅은 노란색인 경향이 있으며, 다른 헤테로폴리할로겐 이온은 오렌지, 빨강 또는 짙은[4] 보라색이다.
- [ICL2]+의 화합물은 와인 레드에서 밝은 오렌지, [ICL2]+의 화합물은 어두운 갈색에서 보라색 검은색
- [Cl3]+은 노란색입니다.
- [Cl4]+은[2] 파란색입니다
- [Br2]+ 체리 레드
- [Br3]+은 갈색입니다.
- [Br5]+은 짙은 갈색입니다.
- [I2]+는 밝은 파란색이다.
- [I3]+는 흑갈색에서 흑색
- [I4]2+는 빨강에서 갈색으로
- [I5]+는 녹색 또는 검은색이며, 소금 [I5][+AlCl4]−은 녹색-검은색 바늘로 존재하지만 얇은 부분에서는 갈색-빨간색으로 보입니다.
- 화합물 [I7]+에 존재한다면 [I7]+는 검은색이다.SOF3]−가 견고하게 확립되어 있다.
- [I15]3+는[5] 검정색
- [ICL2]−은 주홍색입니다.
- [ICL4]−은 황금빛 노란색입니다.
- 폴리요오드화물은 짙은 갈색 또는 짙은 파란색을 띤다
화학적 성질
헤테로폴리할로겐 양이온은 폭발적으로 반응하는 산화제이며, 양이온은 종종 부모 할로겐보다 반응성이 높고 환원 경로에 의해 분해된다.[ClF6],+ [BrF6],+ [IF6]+의 최고 산화상태 +7에서 예상한 바와 같이 이들 종은 매우 강한 산화제이며, 다음과 같은 반응을 보인다.
- 22 O + 2 [BrF6]+ [ AsF6 −]→ 2 [ O2 +][ AsF6 −]+ 2 BrF5 + F2
- Rn + [ IF6 +] [ SbF6 −]→ [ RnF +][ SbF6 −]+ IF5
산화 상태가 낮은 폴리할로겐 양이온은 불균형적인 경향이 있습니다.예를 들어, [ClF]+는2 197 K에서도 용액에서 불안정하고 HF5/SbF 혼합물에서 완전히 불균형합니다.
- 2 [Cl2F]+ → [ClF2]+ + [Cl3]+
[I2]+ reversibly dimerizes at 193 K, and is observed as the blue color of paramagnetic [I2]+ dramatically shifts to the red-brown color of diamagnetic [I2]+, together with a drop in paramagnetic susceptibility and electrical conductivity when the solution is cooled to below 193 K:[2]
- 2 [I2]+ ⇌ [I4]2+
The dimerization can be attributed to the overlapping of the half-filled π* orbitals in two [I2]+.
[Cl4]+ in [Cl4]+[IrF6]− is structurally analogous to [I4]2+, but decomposes at 195 K to give Cl2, and salts of [Cl3]+ instead of [Cl2]+.[2]
Attempts to prepare ClF7 and BrF7 by fluorinating [ClF6]+ and [BrF6]+ using NOF have met with failure, because the following reactions occurred:[3]
- [ClF6]+[PtF6]− + NOF → [NO]+[PtF6]− + ClF5 + F2
- [BrF6]+[AsF6]− + 2 NOF → [NO]+[AsF6]− + [NO]+[BrF6]− + F2
The anions are less reactive compared to the cations, and are generally weaker oxidants than their parent interhalogens. They are less reactive towards organic compounds, and some salts are of quite high thermal stability. Salts containing polyhalogen anions of the type M+[XmYnZp]−, where m + n + p = {3, 5, 7, 9...}, tend to dissociate into simple monohalide salts between M+ and the most electronegative halogen, so that the monohalide has the highest lattice energy. An interhalogen is usually formed as the other product. The salt [(CH3)4N]+[ClF4]− decomposes at about 100 °C, and salts of [ClF6]− are thermally unstable and can explode even at −31 °C.[4]
See also
References
- ^ a b c d King, R. Bruce (2005). "Chlorine, Bromine, Iodine, & Astatine: Inorganic Chemistry". Encyclopedia of Inorganic Chemistry (2nd ed.). Wiley. p. 747. ISBN 9780470862100.
- ^ a b c d e f g h i Housecroft, Catherine E.; Sharpe, Alan G. (2008). "Chapter 17: The group 17 elements". Inorganic Chemistry (3rd ed.). Pearson. p. 547. ISBN 978-0-13-175553-6.
- ^ a b c d e f g Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 835. ISBN 978-0-08-037941-8.
- ^ a b c d e f g h Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999). Advanced Inorganic Chemistry (6th ed.). Wiley. ISBN 978-0471199571.
- ^ a b Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic Chemistry. Academic Press. pp. 419–420. ISBN 0-12-352651-5.
- ^ Sonnenberg, Karsten; Mann, Lisa; Redeker, Frenio A.; Schmidt, Benjamin; Riedel, Sebastian (2020-02-04). "Polyhalogen and Polyinterhalogen Anions from Fluorine to Iodine". Angewandte Chemie International Edition. 59 (14): 5464–5493. doi:10.1002/anie.201903197. ISSN 1433-7851.
- ^ a b c d e Brauer, G., ed. (1963). Handbook of Preparative Inorganic Chemistry (2nd ed.). New York: Academic Press.