증기압
Vapor pressure증기압(또는 미국 이외의 영어권 국가의 증기압, 철자 차이 참조) 또는 평형 증기압은 닫힌 시스템의 주어진 온도에서 응축된 위상(고체 또는 액체)과 함께 열역학적 평형에 있는 증기에 의해 가해지는 압력으로 정의된다.평형 증기 압력은 액체의 증발 속도를 나타냅니다.이는 액체(또는 고체)에서 입자가 빠져나가는 경향과 관련이 있습니다.보통 온도에서 증기 압력이 높은 물질을 휘발성 물질이라고 합니다.액체 표면 위에 존재하는 증기에 의해 나타나는 압력을 증기 압력이라고 합니다.액체의 온도가 상승함에 따라, 액체의 분자의 운동 에너지 또한 증가한다.분자의 운동에너지가 증가함에 따라 증기로 이행하는 분자의 수도 증가하여 증기압을 증가시킨다.
어떤 물질의 증기 압력도 클라우시우스-클라페이론 관계에 따라 온도에 따라 비선형적으로 증가한다.액체의 대기압 비등점(일반 비등점이라고도 함)은 증기압이 주변 대기압과 동일한 온도입니다.온도 상승에 따라 증기 압력은 기압을 극복하고 액체를 들어올려 물질의 부피 안에 증기 기포를 형성하기에 충분합니다.액체의 깊이가 깊어질수록 기압이 대기압 이상으로 올라가기 때문에 액체의 기포 형성은 더 높은 유체압으로 인해 더 높은 온도를 필요로 한다.얕은 깊이에서 더 중요한 것은 버블 형성에 필요한 높은 온도입니다.버블 벽의 표면 장력은 매우 작은 초기 버블에 과압으로 이어집니다.
혼합물의 단일 성분이 시스템의 총 압력에 기여하는 증기 압력을 편압이라고 합니다.예를 들어 해수면에서 20°C에서 수증기로 포화된 공기는 약 2.3kPa의 물, 78kPa의 질소, 21kPa의 산소, 0.9kPa의 부분압을 가지며, 총 102.2kPa의 기준기압이 된다.
측정 및 단위
증기 압력은 압력의 표준 단위로 측정됩니다.SI(International System of Units)는 면적당 힘의 치수로 압력을 유도 단위로 인식하고 파스칼(Pa)을 표준 단위로 지정합니다.1 파스칼은 평방미터당 1뉴턴(N·m−2 또는 kg·m−1·s−2)입니다.
증기 압력의 실험 측정은 1 ~ 200 [1]kPa의 공통 압력에 대한 간단한 절차입니다.물질의 비등점 부근에서 가장 정확한 결과를 얻으며 1kPa 미만의 측정에서는 큰 오차가 발생한다.시험물질의 정화, 용기 내 격리, 외부 가스 배출, 용기 내 물질의 기체상 평형압력 측정 등의 절차로 구성되는 경우가 많다.전체 물질과 증기가 규정된 온도로 유지되도록 주의를 기울이면 정확도가 향상됩니다.이것은 종종 아이소테니스코프의 사용과 마찬가지로 격납 영역을 액체 욕조에 담그는 방식으로 이루어집니다.
Knudsen 유출 셀 방법을 사용하여 고체의 매우 낮은 증기 압력을 측정할 수 있습니다.
의학적인 맥락에서 증기 압력은 다른 단위, 특히 수은(mmHg) 밀리미터 단위로 표현되기도 합니다.이는 대부분 체온에서 액체이지만 상대적으로 증기 압력이 높은 휘발성 마취제에 중요합니다.
앙투안 방정식을 이용한 증기압 추정
앙투안[2][3] 방정식은 증기 압력과 순수한 액체 또는 고체 물질의 온도 사이의 관계에 대한 실용적인 수학 표현입니다.이는 곡선 적합을 통해 얻어지며 증기 압력이 일반적으로 상승하고 온도의 함수로 오목하게 된다는 사실에 맞게 조정됩니다.방정식의 기본 형식은 다음과 같습니다.
다음과 같은 온도 변화 형태로 변환될 수 있습니다.
여기서:
- P는 물질의 절대 증기 압력입니다.
- T는 물질의 온도입니다.
- A A B 및 C는 물질 고유의 계수(: 상수 또는 파라미터)입니다.
- log \는 보통 10{\ _ e {\ _ 중 입니다.[3]
계수가 두 개뿐인 단순한 방정식이 사용되는 경우도 있습니다.
다음과 같이 변환할 수 있습니다.
동일한 물질의 승화 및 기화에는 [2]혼합물의 성분과 마찬가지로 앙투안 계수 세트가 별도로 있습니다.특정 화합물에 대해 설정된 각 파라미터는 지정된 온도 범위에 대해서만 적용할 수 있습니다.일반적으로 온도 범위는 방정식의 정확성을 최대 8-10%까지 유지하기 위해 선택됩니다.많은 휘발성 물질의 경우 여러 가지 다른 파라미터 세트를 사용할 수 있으며 온도 범위별로 사용됩니다.앙투안 방정식은 화합물의 용해점에서 임계 온도까지 사용할 경우 단일 매개 변수가 설정될 경우 정확도가 떨어집니다.또한 Antoine 파라미터 값을 설정하는 데 사용되는 장비의[citation needed] 한계 때문에 증기 압력이 10Torr 미만인 경우에도 정확도가 떨어집니다.
바그너[4] 방정식은 실험 데이터에 "가장 [5]적합한 것 중 하나"를 제공하지만 상당히 복잡합니다.증기압의 저하를 온도 저하 함수로 표현합니다.
액체의 비등점과의 관계
일반적으로 주변 온도에서 액체의 증기 압력은 끓는점이 감소함에 따라 증가합니다.이는 다양한 [6]액체에 대한 증기 압력 대 온도의 그래프를 보여주는 증기 압력 차트(오른쪽 참조)에 설명되어 있습니다.액체의 정상 끓는점에서는 증기압은 1기압,[7] 760Torr, 101.325kPa 또는 14.695psi로 정의된 표준기압과 같다.
예를 들어, 주어진 온도에서 염화메틸은 차트에 있는 액체 중 가장 높은 증기 압력을 가집니다.또한 정상 비등점이 -24.2°C(-11.6°F)로 가장 낮으며, 이는 염화메틸(파란색 선)의 증기 압력 곡선이 절대 증기 압력의 1기압(atm)의 수평 압력선과 교차하는 지점이다.
증기 압력과 온도 사이의 관계는 비선형이지만, 이 차트는 로그 수직 축을 사용하여 약간 곡선을 그리므로 하나의 차트가 많은 액체를 그래프로 표시할 수 있습니다.증기압의 대수를 1/(T+230)[8]에 대해 플롯 했을 때 약직선을 구한다.여기서 T는 섭씨 온도이다.끓는점에 있는 액체의 증기 압력은 주변 환경의 압력과 같다.
혼합물: 라울트의 법칙
라울트의 법칙은 액체 혼합물의 증기 압력에 근사치를 제공한다.단상 혼합물의 활성(압력 또는 부동량)은 성분 증기 압력의 몰-분열 가중치 합계와 동일하다고 명시되어 있다.
서 P t 는 혼합물의 증기압력, x {\}는 액체상 i {\ i의 몰 분율, {는 증기상 i {\i}의 몰 분율입니다. s t {\ 은 증기 압력입니다. Raoult의 법칙은 비전기분자(전하종)에만 적용되며 분자간 흡인력이 약한 비극성 분자에 가장 적합합니다(예: 런던력).
상기 공식보다 증기 압력이 높은 계는 양의 편차를 갖는 것으로 한다.이러한 편차는 분자간 흡인력이 순수 성분보다 약하다는 것을 나타내므로, 분자는 순수 액체보다 액상에 덜 강하게 "잡혀 있는" 것으로 생각할 수 있습니다.예를 들어 약 95%의 에탄올과 물의 공생 로프가 있습니다.공기로프의 증기 압력이 라울트의 법칙에 의해 예측된 것보다 높기 때문에, 그것은 순수한 성분의 온도보다 낮은 온도에서 끓는다.
증기 압력이 예상보다 낮은 음의 편차를 보이는 시스템도 있습니다.이러한 편차는 혼합물 성분 간의 분자 간 흡인력이 순수 성분보다 강하다는 증거입니다.따라서, 분자는 두 번째 분자가 존재할 때 액체에 더 강하게 "포착"됩니다.예를 들어 트리클로로메탄(클로로포름)과 2-프로파논(아세톤)의 혼합물이 있는데, 이 혼합물은 순수한 성분의 끓는점 이상으로 끓는다.
음수 편차와 양수 편차를 사용하여 혼합물 성분의 열역학 활동 계수를 결정할 수 있습니다.
솔리드
평형증기압은 응축상이 자체 증기와 평형상태에 있을 때 도달하는 압력으로 정의할 수 있다.결정 등의 평형고체의 경우 고체의 승화속도와 기상증착속도가 일치할 때의 압력으로 정의할 수 있다.대부분의 고체에서 이 압력은 매우 낮지만, 일부 주목할 만한 예외는 나프탈렌, 드라이아이스(드라이아이스의 증기 압력은 20°C에서 5.73MPa(831psi, 56.5atm), 그리고 얼음입니다.모든 고체 물질은 증기 압력을 가지고 있다.그러나 값이 매우 낮은 경우가 많기 때문에 측정이 다소 어려울 수 있습니다.전형적인 기술에는 열중량 측정과 가스 증발이 포함됩니다.
고체의 승화 압력(증기 압력)을 계산하는 방법은 여러 가지가 있습니다.한 가지 방법은 융해열이 알려진 경우 Clausius-Clapeyron [9]관계의 특정 형식을 사용하여 (과냉각된 액체의) 외삽 액체 증기 압력에서 승화 압력을 추정하는 것이다.
여기서:
- b {subrm {}} {{\{sub}}}는 온도 < s {sub {\displaystyle {sub}}}} 에서의 컴포넌트의 승화 압력입니다.
- l b {sub}}}는 온도 Ts < T 에서 액체 성분의 외삽 증기압입니다.
- 융해열이다.
- R은 가스 상수입니다.
- b는 승화 온도입니다.
- sdisplaystyle {는 녹는점 온도입니다.
이 방법은 융해열이 온도에 의존하지 않고 서로 다른 고체상 사이의 추가 전이 온도를 무시하고 융해점에서 그리 멀지 않은 온도에 대한 공정한 추정을 제공합니다.또한 승화압력은 추정된 액상증기압(δHfus > 0)보다 낮으며 녹는점과의 거리가 커질수록 차이가 커지는 것을 알 수 있다.
물의 비등점
모든 액체처럼, 물은 증기 압력이 주변 압력에 도달하면 끓는다.고도가 높을 때는 기압이 낮고 온도가 낮을 때는 물이 끓는다.대기압에 대한 물의 끓는 온도는 앙투안 방정식으로 근사할 수 있다.
또는 다음과 같은 온도 조절 형태로 변환됩니다.
여기서 T 는 섭씨 단위 비등점이고 압력({ P는 Torr 단위입니다.
뒤링의 법칙
뒤링의 법칙은 두 용액이 동일한 증기 압력을 가하는 온도 사이에 선형 관계가 존재함을 나타냅니다.
예
다음 표는 증기압(절대 단위)을 높여 정렬된 다양한 물질의 목록입니다.
| 물질. | 증기압 | 온도 (°C) | ||
|---|---|---|---|---|
| (Pa) | (막대) | (mmHg) | ||
| 옥타에틸렌 글리콜[10] | 9.2×10−8 Pa | 9.2×10−13 | 6.9×10−10 | 89.85 |
| 글리세롤 | 0.4 Pa | 0.000004 | 0.003 | 50 |
| 수성. | 1 Pa | 0.00001 | 0.0075 | 41.85 |
| 텅스텐 | 1 Pa | 0.00001 | 0.0075 | 3203 |
| 이플루오르화 제논 | 600Pa | 0.006 | 4.50 | 25 |
| 물(HO2) | 2.3kPa | 0.023 | 17.5 | 20 |
| 프로판올 | 2.4kPa | 0.024 | 18.0 | 20 |
| 메틸이소부틸케톤 | 2.66 kPa | 0.0266 | 19.95 | 25 |
| 에탄올 | 5.83kPa | 0.0583 | 43.7 | 20 |
| 프레온 113 | 37.9kPa | 0.379 | 284 | 20 |
| 아세트알데히드 | 98.7kPa | 0.987 | 740 | 20 |
| 부탄 | 220kPa | 2.2 | 1650 | 20 |
| 포름알데히드 | 435.7kPa | 4.357 | 3268 | 20 |
| 프로판[11] | 997.8kPa | 9.978 | 7584 | 26.85 |
| 황화 카르보닐 | 1.255 MPa | 12.55 | 9412 | 25 |
| 아산화질소[12] | 5.660 MPa | 56.60 | 42453 | 25 |
| 이산화탄소 | 5.7 MPa | 57 | 42753 | 20 |
분자구조에 의한 증기압 추정
유기 분자의 분자 구조에서 증기 압력을 추정하기 위한 몇 가지 경험적 방법이 존재한다.예를 들어 SIMPOL.[13]1 방법,[9] 몰러 등의 방법, EVAPORATION(ORGanics의 VApour 압력 추정, 온도 설명, 분자 내 및 비첨가성 효과)[14][15] 등이 있습니다.
기상학에서의 의미
기상학에서 증기압이라는 용어는 [16]평형이 아니더라도 대기 중의 수증기 부분압을 의미하며, 평형증기압은 달리 규정한다.기상학자들은 또한 포화증기압이라는 용어를 평평한 표면 위에 있는 물이나 염수의 평형증기압을 지칭하여 물방울과 대기 [17]중의 미립자의 모양과 크기를 고려한 평형증기압과 구별하기 위해 사용한다.
「 」를 참조해 주세요.
- 수증기압
- 절대 습도
- 앙투안 방정식
- 리-케슬러법
- 라울의 법칙: 용액 중 증기 압력 감소
- 리드 증기 압력
- 상대 습도
- 상대적인 변동성
- 포화 증기 밀도
- 삼투압 계수
- 트리플 포인트
- 실제 증기 압력
- 기액 평형
- 요소의 증기압(데이터페이지)
레퍼런스
- ^ Růžička, K.; Fulem, M. & Růžička, V. "Vapor Pressure of Organic Compounds. Measurement and Correlation" (PDF). Archived from the original (PDF) on 2010-12-26. Retrieved 2009-10-18.
- ^ a b 앙투안 방정식이란?(메릴랜드주 프로스트버그 주립대학교 화학부)
- ^ a b Sinnot, R.K. (2005). Chemical Engineering Design] (4th ed.). Butterworth-Heinemann. p. 331. ISBN 978-0-7506-6538-4.
- ^ Wagner, W. (1973), "New vapour pressure measurements for argon and nitrogen and a new method for establishing rational vapour pressure equations", Cryogenics, 13 (8): 470–482, Bibcode:1973Cryo...13..470W, doi:10.1016/0011-2275(73)90003-9
- ^ Perry's Chemical Engineers' Handbook, 7차 Ed. 4-15페이지
- ^ Perry, R.H.; Green, D.W., eds. (1997). Perry's Chemical Engineers' Handbook (7th ed.). McGraw-Hill. ISBN 978-0-07-049841-9.
- ^ Petrucci, Ralph H.; Harwood, William S.; Herring, F.Geoffrey (2002). General Chemistry (8th ed.). Prentice Hall. p. 484. ISBN 978-0-13-014329-7.
- ^ Dreisbach, R. R. & Spencer, R. S. (1949). "Infinite Points of Cox Chart Families and dt/dP Values at any Pressure". Industrial and Engineering Chemistry. Vol. 41, no. 1. p. 176. doi:10.1021/ie50469a040.
- ^ a b Moller B.; Rarey J.; Ramjugernath D. (2008). "Estimation of the vapour pressure of non-electrolyte organic compounds via group contributions and group interactions". Journal of Molecular Liquids. 143: 52–63. doi:10.1016/j.molliq.2008.04.020.
- ^ Krieger, Ulrich K.; Siegrist, Franziska; Marcolli, Claudia; Emanuelsson, Eva U.; Gøbel, Freya M.; Bilde, Merete (8 January 2018). "A reference data set for validating vapor pressure measurement techniques: homologous series of polyethylene glycols" (PDF). Atmospheric Measurement Techniques. Copernicus Publications. 11 (1): 49–63. doi:10.5194/amt-11-49-2018. ISSN 1867-1381. Retrieved 7 April 2022.
- ^ "유체의 열물리학적 특성 II – 메탄, 에탄, 프로판, 이소부탄, 일반 부탄" 웨이백 머신에 2016-12-21 아카이브(PDF 110페이지, 원본 문서 686페이지), BA Younglove 및 JF Ely.
- ^ "산화질소의 열물리학적 특성" (PDF 14페이지, 원본 문서 10페이지), ESDU.
- ^ Pankow, J. F.; et al. (2008). "SIMPOL.1: a simple group contribution method for predicting vapor pressures and enthalpies of vaporization of multifunctional organic compounds". Atmos. Chem. Phys. 8 (10): 2773–2796. Bibcode:2008ACP.....8.2773P. doi:10.5194/acp-8-2773-2008.
- ^ "Vapour pressure of Pure Liquid Organic Compounds: Estimation by EVAPORATION". Tropospheric Chemistry Modelling at BIRA-IASB. 11 June 2014. Retrieved 2018-11-26.
- ^ Compernolle, S.; et al. (2011). "EVAPORATION: a new vapour pressure estimation method for organic molecules including non-additivity and intramolecular interactions". Atmos. Chem. Phys. 11 (18): 9431–9450. Bibcode:2011ACP....11.9431C. doi:10.5194/acp-11-9431-2011.
- ^ 2011-04-15 Wayback Machine 용어집 아카이브(미국 기상학회 개발)
- ^ 간단한 튜토리얼jhuapl.edu (평형증기압의 정의에 관한 기사)




 물질의 절대 증기 압력입니다.
물질의 절대 증기 압력입니다. 물질의 온도입니다.
물질의 온도입니다.

 물질 고유의 계수(
물질 고유의 계수( 보통
보통 



 혼합물의 증기압력, x
혼합물의 증기압력, x
 몰 분율,
몰 분율,  증기상
증기상 


 온도
온도 



 승화 온도입니다.
승화 온도입니다. 녹는점 온도입니다.
녹는점 온도입니다.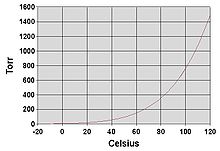


 섭씨 단위
섭씨 단위 

