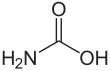
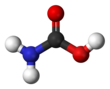
카바민산
Carbamic acid| | |||
| 이름 | |||
|---|---|---|---|
| 선호 IUPAC 이름 카바민산[1] | |||
| 기타 이름 아미노메탄산 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 켐벨 | |||
| 켐스파이더 | |||
| 드러그뱅크 | |||
| 케그 | |||
| 메슈 | 카바믹+아시드 | ||
펍켐 CID | |||
| 유니 | |||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| CH3NO2 | |||
| 어금질량 | 61.040 g·migration−1 | ||
| 관련 화합물 | |||
관련 화합물 | 포마미드 디티오카르바메이트 카본산 요소 에틸카바메이트 | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
아미노포름산 또는 아미노카르복실산이라고도 불릴 수 있는 카바민산은 HNCOOH라는2 공식을 가진 화학 화합물이다.[2] 매우 낮은 온도에서 암모니아 NH와3 이산화탄소 CO의2 반응을 통해 얻을 수 있으며, 이 또한 동일한 양의 암모늄 카바메이트를 산출한다. 이 화합물은 약 250K(-23 °C)까지만 안정적이며, 높은 온도에서는 이 두 기체로 분해된다.[3] 이 고체는 분명히 두 개의 카복실 그룹인 COOH 사이에 수소 결합으로 연결된 두 개의 분자를 가진 조광기로 구성되어 있다.[4]
카바민산은 아민산과 카복실산 둘 다로 볼 수 있고, 따라서 아미노산으로 볼 수 있다.[3] 그러나 (중간 탄소 사슬이 없는) 산군을 질소 원자에 직접 부착하면 이러한 등급과 매우 다르게 작용하게 된다. (글리신(Glycine)은 일반적으로 가장 단순한 아미노산으로 간주된다.) 탄소에 부착된 히드록실 그룹도 아미드 등급에서 제외한다.
"카르바민산"이라는 용어는 RHNCOOH 또는 RR′NCOOH 형식의 모든 화합물에도 일반적으로 사용된다. 여기서 R과 R′은 유기체 그룹이다.[5]
카바민산의 감응은 카바메이트 음이온 RR′NCOO를− 생성하는데, 소금은 비교적 안정적일 수 있다. 카르바마이트는 또한 메틸 카바마이트 HNC2(=O)와 같은 카바마산 에스테르에 사용되는 용어다.OCH3. 카바모일 기능 그룹 RR′NC(=O)–(흔히 Cbm으로 표시됨)는 카바민산 분자에서 카복실 OH 부분을 뺀다.
구조
카바민산은 평면 분자다.[3]
대부분의 아민과 달리 카바민산 HN2– 그룹은 암모늄 그룹 HN3+–으로 양성될 수 없다. zwitterionic form HN-COO는3+− 매우 불안정하며 즉시 암모니아와 이산화탄소로 분해되지만,[6] 고에너지 양성자로 조사된 ICES에서 검출된 보고가 있다.[3]
파생상품
카바민산은 공식적으로 몇몇 중요한 유기 화합물 계열의 모화합물이다.
카바민산
대체된 많은 카바민산(RHNCOOH 또는 RRncNCOOH)은 DMSO나 초임계 이산화탄소와 같은 적절한 용매에서 해당 아민(RNH2 또는 RR′NH)의 용액을 통해 이산화탄소를 거품하여 쉽게 합성할 수 있다.[5] 이러한 카바민산은 일반적으로 상온에서 불안정하여 모체 아민과 이산화탄소로 되돌아간다.[7]
카바마이트 에스테르
카바민산과는 달리 카르바민산 에스테르는 상온에서 일반적으로 안정적이다. 알콜에 의한 카르바모일 염소화물의 반응, 이소시아네이트에 알코올을 첨가한 반응, 암모니아에 의한 탄산 에스테르의 반응에 의해 준비된다.[8]
자연발생
생물체의 여러 대사 경로에 관여하는 카바마이트키나아제 효소는 카바모일 인산염 HNC
2(=O)의 형성을 촉진한다.OPO2−
3
1개의 헤모글로빈 분자는 이산화탄소 분자 4개를 폐로 운반할 수 있다. 카바메이트 그룹은 디옥시 형태의 4개의 단자 아민 그룹과 CO의
2 반응에 의해 형성된다. 그 결과로 생긴 화합물은 카바미노헤모글로빈이라고 불린다.
사용하다
공업
카바민산은 이산화탄소와 암모니아 반응을 수반하는 요소 산업 생산의 중간이다.[9]
- CO2 + NH3 → HNCOOH2
- HNCOOH2 + NH3 → CO(NH2)2 + HO2
메디컬
일부 카르바메이트 에스테르는 GABAA 수용체의 바비투레이트 부지에 결합하는 근육 이완제로 사용되며,[10] 다른 것은 알디카르브와 같은 살충제로 사용된다.[11]
화학합성
아민 기능 그룹 –NH는2 카바메이트 에스테르 잔여물 –NHC(=O)–OR로 형성되어 원치 않는 반응으로부터 보호될 수 있다. 에스테르 결합을 가수 분해하면 카바민산 –NHC(=O)OH가 생성되고, 그 다음 원하는 아민을 생성하는 이산화탄소가 손실된다.
참고 항목
참조
- ^ International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. p. 778. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ "PubChem Compound Summary for CID 277, Carbamic acid". National Center for Biotechnology Information. 2020. Retrieved October 10, 2020.
- ^ a b c d R. K. 칸나와 M. H. 무어(1999) : "카르바민산: 분자 구조와 IR 스펙트럼" 스펙트로치미카 액타 파트 A: 분자 및 생체분자 분광법, 제55권 5, 발행 5, 961-967페이지. 도이:10.1016/S1386-1425(98)00228-5 PMID 10347902Bibcode:1999AcSpA 55..961K
- ^ J. B. 보사, P. 테울레, F. 더버나이, F. 보르겟과 T. 치아바사(2008) : "NH에서3 카바민산과 카바메이트 형성:CO2 icce – UV 조사 대 열 프로세스". 천문학 및 천체물리학, 492권, 3, 719-724페이지. 도이:10.1051/0004-6361:200810536
- ^ a b Z. J. Dijkstra, A. R. Doornbos, H. 웨이텐, J. M. 에른스팅, C. J. 엘스비에, J. T. F. 케렌제스(2007) : "유기용매와 초임계 이산화탄소에서의 카바민산 형성" Supercritical Fluids 저널, 제41권, 발행물 1, 109-114페이지. doi:10.1016/j.supflu.2006.08.012
- ^ Y.-J. Chen, M. 누에보, J-M 쉬, 티에스 이, W.-H. 선, W.-H. 입, H.S. 펑, S.Y. 치앙, Y.-Y. 리, 제이엠 첸과 C.-Y. R. 우(2007) : "성간 얼음 아날로그의 UV/EUV 조사에 의해 생성된 카르바민산" 천문학과 천체물리학, 제464권, 제1권 253-257. 도이:10.1051/0004-6361:20066631
- ^ Lemke, Thomas L. (2003). Review of Organic Functional Groups: Introduction to Medicinal Organic Chemistry. Philadelphia, PA: Lippincott, Williams & Wilkins. p. 63. ISBN 978-0-7817-4381-5.
- ^ Jäger, Peter; Rentzea, Costin N.; Kieczka, Heinz (2000). "Carbamates and Carbamoyl Chlorides". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a05_051. ISBN 3527306730.
- ^ Meessen, J. H.; Petersen, H. "Urea". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a27_333.
- ^ Block, John H.; Beale, John M., eds. (2004). "Central Nervous System Depressant". Wilson and Gisvold's Textbook of Organic Medicinal and Pharmaceutical Chemistry. Philadelphia, PA: Lippincott, Williams & Wilkins. p. 495. ISBN 978-0-7817-3481-3.
- ^ Risher, John F.; Mink, Franklin L.; Stara, Jerry F. (1987). "The Toxicologic Effects of the Carbamate Insecticide Aldicarb in Mammals: A Review". Environmental Health Perspectives. 72: 267–281. doi:10.2307/3430304. JSTOR 3430304. PMC 1474664. PMID 3304999.