염화공정
Chloride process염화과정은 티타늄을 광석에서 분리하는데 사용된다. 일메나이트(FeTiO3), 루틸레(TiO2) 등 광석으로부터 고순도 이산화티타늄을 획득하는 것이 목표다. 이 전략은 티클의4 변동성을 이용하는데, 티클은 쉽게 정화되어 이산화물로 전환된다. 이 공정에 의해 매년 수백만 톤의2 TiO가 생산되는데, 주로 흰 색소로 사용된다. 염화과정은 광석에서 철과 다른 불순물을 추출하기 위해 뜨거운 황산에 의존하는 오래된 황산 과정을 대부분 대체했다.[1]
공정화학
이 과정에서 공급원료는 1000℃에서 탄소, 염소 가스로 처리돼 테트라클로로이드 티타늄을 공급한다. 대표적인 것이 광석 일메나이트에서 시작하는 변환이다.[2]
- 2 FeTiO3 + 7 Cl2 + 6 C → 2TiCl4 + 2 FeCl3 + 6 CO
그 과정은 탄소의 감소력을 이용하는 탄수화물 반응의 변형이다.
다른 불순물도 각각의 염소 처리로 전환되지만, 대부분은 TiCl보다4 휘발성이 적다. TiCl과4 함께 바나듐 테트라클로라이드와 바나듐 옥시트리클로라이드 코드스티실(Codistill)이 있지만, 이러한 불순물은 화학적 감소를 통해 제거할 수 있다.[1] 테트라클로로이드 티타늄은 증류에 의해 정화된다. 이후 산소 불꽃이나 플라즈마에서 산화되어 순수한 이산화티타늄을 공급할 수 있다.[3][4]
- TiCl4 + O2 + 열 → TiO2 + 2Cl2
이렇게 해서, 염소는 재활용을 위해 회수된다.
공정공학
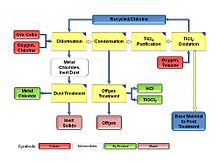
이산화티타늄 염화물 표준 공정은 다음과 같은 주 생산 단위로 구성된다.[5]
- 산화
- 염소화
- 응축
- 정화
다음과 같은 보조 생산 단위가 필요하다.
- 광석/코크창고
- 오프 가스 처리
- 분진 처리
정상 상태 조건에서 염화 과정은 염소가 산화 상태에서 감소된 상태로 변화하고 역류하는 연속 사이클이다. 염소의 산화 형태는 분자 염소 Cl이고2, 감소된 형태는 티타늄 테트라클로로이드(TiCl4)이다. 산화제는 분자산소(O2), 환원제는 콜라다. 둘 다 그 과정에 참여해야 한다. 티타늄은 코크스와 함께 광석의 형태로 공정에 공급된다. 티타늄 광석은 산화물의 혼합물이다. 첨가된2 O는 TiO라는2 제품과 함께 공정을 떠나고, 첨가된 콜라는 CO와 CO의2 형태로 티타늄 광석에서 첨가된 산소와 함께 공정을 떠난다. 다른 공급 금속들은 금속 염화물의 형태로 과정을 떠난다.[6]
참조
- ^ a b Völz, Hans G.; et al. (2006). "Pigments, Inorganic". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a20_243.pub2.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ "The TiO2 Process". Ti-Cons. Retrieved 2016-12-17.
- ^ Jones, Tony; Egerton, Terry A. (2000). "Titanium Compounds, Inorganic". Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. doi:10.1002/0471238961.0914151805070518.a01.pub3. ISBN 9780471238966.
- ^ "Manufacture and General Properties of Titanium Dioxide Pigments" (PDF). Ti-Cons. Archived from the original (PDF) on 2011-01-24. Retrieved 2012-04-11.
- ^ "The Details of the TiO2 Process" (PDF). Ti-Cons. Retrieved 2012-04-11.
외부 링크
- "Chloride Process". KRONOS Worldwide, Inc. Retrieved 2020-05-11.
- "The Chloride Process from Ti-Cons". Ti-Cons Jendro, Weiland und Partner. Retrieved 2010-06-16.