공동 바인딩
Cooperative binding분자 결합은 분자 간의 상호작용을 의미하며, 분자 간의 안정적인 물리적 연관성을 초래한다.협동 결합은 둘 이상의 분자 유형 또는 종을 포함하는 결합 시스템에서 발생하며, 이 결합체 중 하나는 단가치가 아니며 다른 종의 둘 이상의 분자를 결합할 수 있다.
예를 들어 A종의 한 분자가 B종의 분자와 결합할 수 있는 시스템을 생각해 보자.A종은 수용체, B종은 리간드로 불린다.B의 첫 번째 분자와 A의 결합이 두 번째 B 분자의 결합 친화력을 변화시켜 어느 정도 결합할 가능성이 있는 경우 결합은 "협력적"으로 간주할 수 있다.즉, A의 서로 다른 부위에 B 분자를 결합하는 것은 상호 독립적인 사건을 구성하지 않는다.
협력성은 긍정적일 수도 있고 부정적일 수도 있다.단백질과 핵산을 포함한 많은 생물폴리머에서 협동 결합이 관찰된다.협력적 결합은 광범위한 생화학적이고 생리적 과정의 기초가 되는 메커니즘으로 밝혀졌다.
역사와 수학 형식
크리스티안 보어(Christian Bohr)와 협력적 결합의 개념
1904년 크리스티안 보어는 다른 조건에서 산소와 헤모글로빈 결합을 연구했다.[1][2]산소의 부분 압력의 함수로 산소를 포함한 헤모글로빈 포화를 플로팅할 때, 그는 S자형(또는 "S자형") 곡선을 얻었다.이것은 헤모글로빈에 더 많은 산소가 결합될수록, 더 많은 산소가 결합되기 쉽다는 것을 나타낸다 - 모든 결합 부위가 포화 상태가 될 때까지.게다가, Bohr는 CO2 압력이 증가하면 이 곡선이 오른쪽으로 이동한다는 것을 알아챘다. 즉, CO2 농도가 높아지면 헤모글로빈이 산소를 결합하는 것이 더 어려워진다.[2]이 후자의 현상은 헤모글로빈의 산소 친화력이 pH 증가와 함께 증가한다는 관찰과 함께 보어 효과로 알려져 있다.
수용체 분자는 리간드에 대한 결합이 리간드 농도와 함께 비선형적으로 척도되면 협동 결합을 보인다고 한다.협력성은 양(리간드 분자의 결합이 수용체의 겉보기 친화력을 증가시켜 다른 리간드 분자의 결합 가능성을 증가시키는 경우) 또는 음(리간드 분자의 결합이 친화력을 감소시켜 다른 리간드 분자의 결합 가능성을 낮춘 경우)일 수 있다.주어진 리간드를 가진 수용체의 "굴절 점유" 의은 리간드 결합 부위의 양을 리간드 결합 부위의 총량으로 나눈 값으로 정의된다.
가 이면 단백질이 완전히 결합되지 않고, 가 이면 완전히 포화 상태가 된다리간드 농도의 함수로 의 Y의 플롯이 헤모글로빈에 대해 보어가 관찰한 바와 같이 S자형이라면 이는 양의 협조성을 나타낸다.만약 그렇지 않다면, 이 음모를 보고만 있어도 협력성에 대한 어떠한 진술도 할 수 없다.
협동 결합의 개념은 두 개 이상의 리간드 결합 부위가 있는 분자나 단지에만 적용된다.여러 리간드 결합 부위가 존재하지만 어느 한 부지에 대한 리간드 결합 부위가 다른 부위에 영향을 미치지 않는 경우 수용체는 비협조적이라고 한다.협력성은 리간드가 같은 종류의 리간드의 결합에 영향을 미치는 경우 균등방성 또는 다른 종류의 리간드의 결합에 영향을 미치는 경우 이질방성일 수 있다.헤모글로빈의 경우, 보어는 균질성 양의 협력성(산소의 결합이 더 많은 산소의 결합을 촉진함)과 이질성 부협동성(CO의2 결합은 산소를 결합하는 헤모글로빈의 시설을 감소시킨다)을 관찰했다.
20세기 내내, 두 개 이상의 결합 부위가 있는 단백질에 대한 리간드의 결합과 이러한 맥락에서 관찰된 협력적 효과를 설명하기 위해 다양한 프레임워크가 개발되었다.[3]
힐 방정식
다중 사이트 단백질에 대한 협동 결합에 대한 첫 번째 설명은 A.V.에 의해 개발되었다. 힐.[4] 헤모글로빈에 대한 산소 결합의 관찰과 협력성이 헤모글로빈 분자의 집합에서 비롯되었다는 생각을 바탕으로 힐은 그 이후 그의 이름을 딴 현상학적 방정식을 제안했다.
여기서 은(는) "힐 계수"이고 [ {\은(는) 리간드 농도를 나타내고, K {\ K은(정식의 원래 형태에서 사용), ∗ K은 경험적 분리 현미경 분리 상수(방정식의 현대적 형태에서 사용되며 E EC}에 해당).n< 인 경우 시스템은 음의 협력성을 보이는 , >1{\}인 경우 협력성은 양이다총 리간드 바인딩 사이트 수는 의 상한 값이다힐 방정식은 다음과 같이 선형화할 수 있다.
'힐 플롯'은 - 와 versus[ 를 비교하여 구한다 힐 방정식의 경우 N{\ 같은 선이다과(와) 인터셉트 ) (K_.이것은 협력성이 고정된 것으로 가정된다는 것을 의미한다. 즉, 그것은 포화 상태에 따라 변하지 않는다.또한 바인딩 사이트는 항상 동일한 친화력을 나타내며, 리간드 농도와 함께 증가하는 친화력에서 협력성이 발생하지 않는다는 것을 의미한다.
아데어 방정식
G.S. Adair는 헤모글로빈에 대한 힐 플롯이 직선이 아님을 발견했고, 결합 친화력은 고정된 용어가 아니라 리간드 포화도에 의존한다는 가설을 세웠다.[5]헤모글로빈이 4헤메(따라서 산소를 결합하는 부위)를 함유하고 있다는 것을 입증한 그는 완전히 포화된 헤모글로빈이 1, 2, 3개의 결합 산소 분자를 가진 중간 형태와 함께 단계적으로 형성된다는 가정으로부터 연구했다.결합되지 않은 헤모글로빈으로부터의 각 중간 단계의 형성은 겉보기 거시적 연관 상수 를 사용하여 설명할 수 있다이에 따른 부분 점유율은 다음과 같이 표현할 수 있다.
또는 리간드 결합 부위가 n개인 모든 단백질에 대해:
여기서 n은 결합 부위의 수를 나타내며, 는 i 리간드 분자의 결합을 설명하는 결합 상수다.아데어 치료법을 힐 플롯과 결합함으로써 협력성의 현대적 실험적 정의에 도달한다(힐, 1985, 아벨리오비치, 2005).결과적인 힐 계수 또는 Adair 방정식에서 계산한 힐 플롯의 기울기는 비 상호 작용 바인딩 사이트의 등가 시스템에서 바인딩 번호의 분산과 바인딩 번호의 분산 사이의 비율로 나타날 수 있다.[6]그러므로 힐 계수는 협력성을 다른 현장의 상태에 대한 하나의 결합 부위의 통계적 의존성으로 정의한다.
클로츠 방정식
칼슘 결합 단백질에 대한 작업을 하면서 어빙 클로츠 디콘볼루션 아데르의 연관 상수를 중간 단계의 단계적 형성을 고려하여, 집단행동법에 의해 지배되는 기본적인 과정이라는 관점에서 협동 결합을 표현하려고 노력했다.[7][8]그의 틀에서 }는 첫 번째 리간드 분자의 결합을 지배하는 연결 상수 K }} 두 번째 리간드 분자의 결합을 지배하는 연결 상수(첫 번째가 이미 결합한 경우) 등이다.의 에 대해 다음과 같은 이점을 제공한다
상수 K }} 등의 상수는 개별 바인딩 사이트와 관련이 없다는 점에 유의할 필요가 있다.그들은 어느 사이트보다 몇 개의 바인딩 사이트가 있는지 설명한다.이 형식은 연관 상수를 고려할 때 협력성이 쉽게 인식된다는 장점이 있다.If all ligand binding sites are identical with a microscopic association constant , one would expect (that is 협조성이 없는 경우 ) 이(가) >1 {\ i에 대해 이러한 예상값보다 위에 놓여 있다면 우리는 긍정적인 협조성을 갖는다
클로츠 방정식(Adair-Klotz 방정식이라고도 함)은 리간드 결합의 측정을 순차적 겉보기 결합 상수의 관점에서 기술하기 위해 여전히 실험 문헌에서 자주 사용된다.[9]
폴링 방정식
20세기 중반까지, 결합 곡선을 현상학적으로 설명할 뿐만 아니라, 근본적인 생화학적 메커니즘을 제공하는 모델에 대한 관심이 증가했다.리너스 폴링은 자신의 상수가 리간드에 대한 결합 상수( 방정식의 K 와 협동 단백질 서브유닛( 사이의 상호작용에서 오는 에너지의 조합이라고 가정하고 아데어가 제공한 방정식을 재해석했다.[10]Pauling은 실제로 서브유닛 사이의 상호작용 정도에 따라 몇 개의 방정식을 도출했다.헤메스의 국산화 여부에 대한 잘못된 가정을 바탕으로, 그는 서브유닛이 사각형으로 배열되어 있다고 가정하고 헤모글로빈에 의한 산소 결합을 묘사하는 잘못된 가정을 선택했다.아래 방정식은 헤모글로빈의 경우 보다 정확한 4면체 구조에 대한 방정식을 제공한다.
KNF 모델
대니얼 코쉬랜드와 동료들은[11] 리간드에 결합하면서 협동 단백질의 구조가 바뀐다는 결과를 바탕으로 파울링이 설명한 메커니즘의 생화학적 설명을 다듬었다.[10]코슈랜드-네메티-필머(KNF) 모델은 각 서브 유닛이 활성 또는 비활성 두 가지 순응 중 하나로 존재할 수 있다고 가정한다.하나의 서브 유닛에 대한 리간드 바인딩은 "유인 적합성"[12]으로 설명되는 메커니즘인 비활성에서 활성 순응으로 해당 서브 유닛의 즉각적인 순응적 변화를 유도할 수 있다.KNF 모델에 따르면 협력성은 서브유닛 사이의 상호작용에서 발생하며, 그 강도는 관련된 서브유닛의 상대적 순응에 따라 달라진다.사면체 구조(선형 및 정사각형 구조도 고려함)에 대해서는 다음과 같은 공식을 제안하였다.
여기서 는 X의 연관 상수, K t 는 리간드가 없을 때의 B 상태와 A 상태의 비율, K 이다. and are the relative stabilities of pairs of neighbouring subunits relative to a pair where both subunits are in the A state (Note that the KNF paper actually presents , the number of occupied sites, which is here 4 times ).
MWC 모델
결합형 알로스테리 전환용[13] 모노드 위만-체인구스(MWC) 모델은 열역학 및 3차원 순응에 기반한 협력성을 탐구함으로써 한 단계 더 나아갔다.그것은 원래 대칭적으로 배열된 동일한 서브유닛을 가진 과두 단백질을 위해 만들어졌으며, 각각 하나의 리간드 결합 부위가 있다.이 프레임워크에 따르면, 두 개(또는 그 이상)의 수렴성 단백질 순응 상태가 열 평형 속에 공존한다.흔히 긴장(T)과 이완(R)이라고 불리는 상태는 리간드 분자에 대한 친화력이 다르다.두 상태 사이의 비율은 더 높은 우위 상태를 안정시키는 리간드 분자의 결합에 의해 조절된다.중요한 것은 분자의 모든 서브유닛이 동시에 상태를 변화시키는 것으로, "공감된 전이"라고 알려진 현상이다.
알로스테릭 이성질체화 상수 L은 리간드 분자가 결합되지 않았을 때 두 상태 사이의 평형을 : L=[ 0 [ 0 왼쪽 L이 매우 크면 리간드가 없는 상태에서 단백질의 대부분이 T 상태로 존재한다.L이 작을 경우(하나에 가까울 경우), R 상태는 T 상태와 거의 유사하게 채워진다.T 상태와 R 상태에서 리간드에 대한 분리 상수의 비율은 c: = R T{\ c{d}^{{dc_}^}}}{c}}}}}}}}}}}} 상수로 설명된다. = 이면 R과 T 상태 모두 리간드에 대해 동일한 친화력을 가지며 리간드는 이성질체화에 영향을 주지 않는다c의 값은 또한 리간드 결합 시 T와 R 상태의 평형이 얼마나 변화하는지 나타낸다. c가 작을수록 평형은 하나의 결합 후 R 상태로 더 많이 이동한다.=[ 을를) 사용하는 경우, 분수 점유율은 다음과 같이 설명된다.
그런 다음 포화도가 증가함에 따라 알로스테릭 단백질의 시그모이드 힐 그림은 T 상태(낮은 친화력)에서 R 상태(높은 친화력)로 점진적인 전환으로 분석할 수 있다.힐 플롯의 기울기도 포화 상태에 따라 달라지며, 경직 지점에서는 최대값이 된다.두 점근과 y축 사이의 절편을 통해 리간드에 대한 두 상태의 친화력을 결정할 수 있다.
단백질에서, 순응적 변화는 종종 활동, 또는 특정 대상을 향한 활동과 연관된다.그러한 활동은 종종 생리학적으로 관련이 있거나 실험적으로 측정되는 것이다.순응적 변화의 정도는 상태 함수'{\에 의해 설명되며 이는 상태에 존재하는 단백질의 분율을 나타낸다에너지 다이어그램에서 알 수 있듯이 리간드 분자가 더 많이 결합될수록 의 {\은(는) 증가한다.의에 대한 표현은 다음과 같다.
MWC 모델의 중요한 측면은 의와 R의 {\에 대한 곡선이 일치하지 않는다는 것이다.[14] 즉, 부분 포화도 순응 상태(따라서 활동)의 직접적인 지표는 아니다.더욱이 결합의 협력성과 활성화의 협력성의 범위는 매우 다를 수 있다. 극단적인 경우는 결합의 경우 힐 계수가 1.7이고 활성화가 10.3인 박테리아 플라젤라 모터에 의해 제공된다.[15][16]반응의 초선형성을 초음파감응이라고 부르기도 한다.
알로스테릭 단백질이 R 상태에 대한 친화력이 더 높은 대상에 결합되는 경우, 대상 결합은 R 상태를 더욱 안정시켜 리간드 친화력을 증가시킨다.반면 대상이 T 상태에 우선 바인딩되는 경우, 대상 바인딩은 리간드 친화력에 부정적인 영향을 미치게 된다.그러한 표적을 알로스테릭 변조기라고 한다.
MWC의 출범 이후, MWC 프레임워크는 확장되고 일반화되었다.예를 들어, 세 가지 이상의 상태를 가진 단백질,[17] 즉 여러 종류의 리간드 또는 여러 종류의 알로스테릭 변조기에 결합하는 단백질과 비식별적 서브유닛 또는 리간드 바인딩 부위가 있는 단백질에 대한 충족을 위해 변형이 제안되었다.[20]
예
리간드의 협력적 결합을 보여주는 분자집합체의 목록은 매우 크지만, 몇몇 예는 특히 역사적 관심이나 특이한 성질, 생리적 중요성으로 두드러진다.
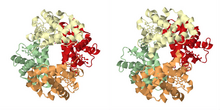
역사적 단원에서 기술한 바와 같이 협동 결합의 가장 유명한 예는 헤모글로빈이다.맥스 페루츠가 X선 회절법을 이용해 해결한 쿼터너리 구조는 산소를 위한 4개의 결합 부위(heme)를 운반하는 사이비대칭 사면체를 보여준다.[21]협력적 결합을 보여주는 많은 다른 분자 조립품들은 매우 상세하게 연구되어 왔다.
복합효소
많은 효소의 활동은 알로스테릭 이펙터에 의해 조절된다.이러한 효소 중 일부는 다기능성이며 규제 기관을 위한 몇 개의 결합 부위가 있다.
트레오닌 디아미나제는 헤모글로빈처럼[22] 행동하도록 제안된 최초의 효소 중 하나였으며 리간드를 협력적으로 결합시키는 것으로 나타났다.[23]그것은 나중에 사지마비 단백질로 밝혀졌다.[24]
리간드를 협력적으로 결합하기 위해 일찍 제안된 또 다른 효소는 아스파테이트 트랜스 카르바밀라아제다.[25]초기 모델은 4개의 바인딩 사이트와 일치했지만,[26] 그 구조는 나중에 윌리엄 립스콤과 동료들에 의해 육각형으로 밝혀졌다.[27]
이온 채널
대부분의 이온 채널은 생물학적 막에 대칭적으로 배열된 여러 개의 동일하거나 유사 식별된 단량체 또는 영역으로 구성된다.리간드에 의해 개방이 규제되는 그러한 채널의 여러 계층은 이들 리간드의 협력적 결합을 보여준다.
니코틴 아세틸콜린 수용체가 여러 개의 결합 부위가 존재하기 때문에 협력적인 방식으로 아세틸콜린을 결합하는 것이 1967년[28](그 채널의 정확한 성질을 여전히 알 수 없는 때)에 이르면 제안되었다.수용체[29] 정화와 그 특성화는 수용체 결합 영역의 구조로 확인되는 서브유닛 사이의 인터페이스에 결합 부위가 위치한 펜트아메리카 구조를 보여주었다.[30]
이노시톨 삼인산(IP3) 수용체는 협동 결합을 나타내는 또 다른 종류의 리간드 게이트 이온 채널을 형성한다.[31]이 수용체들의 구조는 대칭적으로 배열된 네 개의 IP3 결합 사이트를 보여준다.[32]
다중 사이트 분자
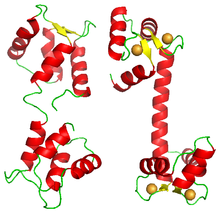
비록 협력적 결합을 보이는 대부분의 단백질은 동족 부위의 복합체지만, 일부 단백질은 동일한 폴리펩타이드에 동일한 리간드에 대한 여러 결합 부위를 가지고 있다.그러한 예로는 차모듈린(chalmodulin이 있다.한 분자의 칼모듈린은 네 개의 칼슘 이온을 협력적으로 결합시킨다.[33]그 구조는 각각 하나의 칼슘 이온을 결합하는 네 개의 EF-핸드 영역을 나타낸다.[34]이 분자는 사각형 또는 사면체 구조를 나타내지 않지만 각각 두 개의 EF-핸드 도메인을 포함하는 두 개의 로브로 구성된다.
전사 계수
핵산에 대한 단백질의 협동 결합도 나타났다.고전적인 예로는 람다 페이지 압착기를 운영자에게 바인딩하는 것이 있는데, 이는 협력적으로 발생한다.[35][36]다른 전사 인자의 예는 TtgABC 펌프의[37] 압착기(n=1.6)와 같이 목표를 결합할 때 양의 협력성과 전사 인자 HOXA11과 FOXO1이 나타내는 조건부 협력성을 나타낸다.[38]
반대로, 필적 인자의 결합에 대한 음의 협력성의 예도 문서화되었는데, P450cam hydroxylase 연산자[39](n=0.56)의 호모디메릭 억제기에 대해서는 다음과 같이 기록되었다.
일관적 확산 및 결합적 협력성
초기에는 일부 단백질, 특히 많은 서브유닛으로 구성된 단백질은 R과 T 상태 간의 전환이 반드시 전체 단백질에 걸쳐 동기화되지 않는 일반화된 MWC 메커니즘에 의해 조절될 수 있다는 주장이 제기되어 왔다.[40]1969년 와이먼은[41] 무척추동물의 호흡기 단백질에 대해 "혼합된 순응"(즉 R 상태의 일부 양성자, T 상태의 일부 양성자)을 가진 모델을 제안했다.
비슷한 생각에 따라[42] 듀크와 동료들이 만든 순응 확산 모델은 KNF와 MWC 모델 모두를 특별한 사례로 삼는다.이 모델에서 서브유닛은 (KNF 모델과 같이) 리간드 바인딩 시 순응을 자동으로 변경하지 않으며, 복잡한 변경 순응의 모든 서브유닛도 함께 변경하지 않는다(MWC 모델과 동일).순응적 변화는 리간드 바인딩 여부 및 인접 서브유닛의 순응 상태에 따라 서브유닛 전환 상태의 가능성으로 확률적이다.따라서, 순응 상태는 전체 단지를 "확대"할 수 있다.
업스트림 및 다운스트림 구성 요소가 모듈의 초음파 민감도에 미치는 영향
살아있는 세포에서, 극도로 민감한 모듈들은 업스트림과 다운스트림 컴포넌트를 가진 더 큰 네트워크에 내장되어 있다.이 구성 요소는 모듈이 수신할 입력 범위와 네트워크가 감지할 수 있는 모듈의 출력 범위를 구속할 수 있다.[43]모듈형 시스템의 민감성은 이러한 제한사항의 영향을 받는다.다운스트림 구성 요소에 의해 부과되는 동적 범위 제한은 분리하여 고려할 때 원래 모듈의 그것보다 훨씬 더 큰 유효 민감도를 생성할 수 있다.
참조
![]() 본 기사는 CC BY 4.0 라이센스(2013)에 따라 다음과 같은 출처에서 개작되었다(검토자 보고서). Melanie Stefan; Nicolas Le Novère (2013). "Cooperative binding". PLOS Computational Biology. 9 (6): e1003106. doi:10.1371/JOURNAL.PCBI.1003106. ISSN 1553-734X. PMC 3699289. PMID 23843752. Wikidata Q21045427.
본 기사는 CC BY 4.0 라이센스(2013)에 따라 다음과 같은 출처에서 개작되었다(검토자 보고서). Melanie Stefan; Nicolas Le Novère (2013). "Cooperative binding". PLOS Computational Biology. 9 (6): e1003106. doi:10.1371/JOURNAL.PCBI.1003106. ISSN 1553-734X. PMC 3699289. PMID 23843752. Wikidata Q21045427.
- ^ Bohr C (1904). "Die Sauerstoffaufnahme des genuinen Blutfarbstoffes und des aus dem Blute dargestellten Hämoglobins". Zentralblatt Physiol. (in German). 23: 688–690.
- ^ a b Bohr C, Hasselbalch K, Krogh A (1904). "Ueber einen in biologischer Beziehung wichtigen Einfluss, den die Kohlensäurespannung des Blutes auf dessen Sauerstoffbindung übt". Skandinavisches Archiv für Physiologie. 16 (2): 402–412. doi:10.1111/j.1748-1716.1904.tb01382.x.
- ^ Wyman J, Gill SJ (1990). Binding and linkage. Functional chemistry of biological molecules. Mill Valley: University Science Books.
- ^ Hill AV (1910). "The possible effects of the aggregation of the molecules of haemoglobin on its dissociation curves". J Physiol. 40: iv–vii.
- ^ Adair GS (1925). "'The hemoglobin system. IV. The oxygen dissociation curve of hemoglobin". J Biol Chem. 63 (2): 529–545. doi:10.1016/S0021-9258(18)85018-9.
- ^ Abeliovich H (July 2005). "An empirical extremum principle for the hill coefficient in ligand-protein interactions showing negative cooperativity". Biophysical Journal. 89 (1): 76–9. Bibcode:2005BpJ....89...76A. doi:10.1529/biophysj.105.060194. PMC 1366580. PMID 15834004.
- ^ Klotz IM (January 1946). "The application of the law of mass action to binding by proteins; interactions with calcium". Archives of Biochemistry. 9: 109–17. PMID 21009581.
- ^ Klotz IM (January 2004). "Ligand-receptor complexes: origin and development of the concept". The Journal of Biological Chemistry. 279 (1): 1–12. doi:10.1074/jbc.X300006200. PMID 14604979.
- ^ Dagher R, Peng S, Gioria S, Fève M, Zeniou M, Zimmermann M, Pigault C, Haiech J, Kilhoffer MC (May 2011). "A general strategy to characterize calmodulin-calcium complexes involved in CaM-target recognition: DAPK and EGFR calmodulin binding domains interact with different calmodulin-calcium complexes". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1813 (5): 1059–67. doi:10.1016/j.bbamcr.2010.11.004. PMID 21115073.
- ^ a b Pauling L (April 1935). "The Oxygen Equilibrium of Hemoglobin and Its Structural Interpretation". Proceedings of the National Academy of Sciences of the United States of America. 21 (4): 186–91. Bibcode:1935PNAS...21..186P. doi:10.1073/pnas.21.4.186. PMC 1076562. PMID 16587956.
- ^ Koshland DE, Némethy G, Filmer D (January 1966). "Comparison of experimental binding data and theoretical models in proteins containing subunits". Biochemistry. 5 (1): 365–85. doi:10.1021/bi00865a047. PMID 5938952.
- ^ Koshland DE (February 1958). "Application of a Theory of Enzyme Specificity to Protein Synthesis". Proceedings of the National Academy of Sciences of the United States of America. 44 (2): 98–104. Bibcode:1958PNAS...44...98K. doi:10.1073/pnas.44.2.98. PMC 335371. PMID 16590179.
- ^ Monod J, Wyman J, Changeux JP (May 1965). "On the nature of allosteric transitions: A plausible model". Journal of Molecular Biology. 12: 88–118. doi:10.1016/S0022-2836(65)80285-6. PMID 14343300.
- ^ Rubin MM, Changeux JP (November 1966). "On the nature of allosteric transitions: implications of non-exclusive ligand binding". Journal of Molecular Biology. 21 (2): 265–74. doi:10.1016/0022-2836(66)90097-0. PMID 5972463.
- ^ Cluzel P, Surette M, Leibler S (March 2000). "An ultrasensitive bacterial motor revealed by monitoring signaling proteins in single cells". Science. 287 (5458): 1652–5. Bibcode:2000Sci...287.1652C. doi:10.1126/science.287.5458.1652. PMID 10698740.
- ^ Sourjik V, Berg HC (October 2002). "Binding of the Escherichia coli response regulator CheY to its target measured in vivo by fluorescence resonance energy transfer". Proceedings of the National Academy of Sciences of the United States of America. 99 (20): 12669–74. Bibcode:2002PNAS...9912669S. doi:10.1073/pnas.192463199. PMC 130518. PMID 12232047.
- ^ Edelstein SJ, Schaad O, Henry E, Bertrand D, Changeux JP (November 1996). "A kinetic mechanism for nicotinic acetylcholine receptors based on multiple allosteric transitions". Biological Cybernetics. 75 (5): 361–79. CiteSeerX 10.1.1.17.3066. doi:10.1007/s004220050302. PMID 8983160. S2CID 6240168.
- ^ Mello BA, Tu Y (November 2005). "An allosteric model for heterogeneous receptor complexes: understanding bacterial chemotaxis responses to multiple stimuli". Proceedings of the National Academy of Sciences of the United States of America. 102 (48): 17354–9. Bibcode:2005PNAS..10217354M. doi:10.1073/pnas.0506961102. PMC 1297673. PMID 16293695.
- ^ a b Najdi TS, Yang CR, Shapiro BE, Hatfield GW, Mjolsness ED (April 2006). "Application of a generalized MWC model for the mathematical simulation of metabolic pathways regulated by allosteric enzymes". Journal of Bioinformatics and Computational Biology. 4 (2): 335–55. CiteSeerX 10.1.1.121.9382. doi:10.1142/S0219720006001862. PMID 16819787.
- ^ Stefan MI, Edelstein SJ, Le Novère N (July 2009). "Computing phenomenologic Adair-Klotz constants from microscopic MWC parameters". BMC Systems Biology. 3: 68. doi:10.1186/1752-0509-3-68. PMC 2732593. PMID 19602261.
- ^ Perutz MF, Rossmann MG, Cullis AF, Muirhead H, Will G, North AC (February 1960). "Structure of haemoglobin: a three-dimensional Fourier synthesis at 5.5-A. resolution, obtained by X-ray analysis". Nature. 185 (4711): 416–22. doi:10.1038/185416a0. PMID 18990801. S2CID 4208282.
- ^ Changeux JP (1961). "The feedback control mechanisms of biosynthetic L-threonine deaminase by L-isoleucine". Cold Spring Harbor Symposia on Quantitative Biology. 26: 313–8. doi:10.1101/SQB.1961.026.01.037. PMID 13878122.
- ^ Changeux, J.-P. (1963). "'Allosteric Interactions on Biosynthetic L-threonine Deaminase from E. coli K12". Cold Spring Harb Symp Quant Biol. 28: 497–504. doi:10.1101/sqb.1963.028.01.066.
- ^ Gallagher DT, Gilliland GL, Xiao G, Zondlo J, Fisher KE, Chinchilla D, Eisenstein E (April 1998). "Structure and control of pyridoxal phosphate dependent allosteric threonine deaminase". Structure. 6 (4): 465–75. doi:10.1016/s0969-2126(98)00048-3. PMID 9562556.
- ^ Gerhart JC, Pardee AB (March 1962). "The enzymology of control by feedback inhibition". The Journal of Biological Chemistry. 237 (3): 891–6. doi:10.1016/S0021-9258(18)60389-8. PMID 13897943.
- ^ Changeux JP, Rubin MM (February 1968). "Allosteric interactions in aspartate transcarbamylase. 3. Interpretation of experimental data in terms of the model of Monod, Wyman, and Changeux". Biochemistry. 7 (2): 553–61. doi:10.1021/bi00842a601. PMID 4868541.
- ^ Honzatko RB, Crawford JL, Monaco HL, Ladner JE, Ewards BF, Evans DR, Warren SG, Wiley DC, Ladner RC, Lipscomb WN (September 1982). "Crystal and molecular structures of native and CTP-liganded aspartate carbamoyltransferase from Escherichia coli". Journal of Molecular Biology. 160 (2): 219–63. doi:10.1016/0022-2836(82)90175-9. PMID 6757446.
- ^ Karlin A (August 1967). "On the application of "a plausible model" of allosteric proteins to the receptor for acetylcholine". Journal of Theoretical Biology. 16 (2): 306–20. Bibcode:1967JThBi..16..306K. doi:10.1016/0022-5193(67)90011-2. PMID 6048545.
- ^ Changeux JP, Kasai M, Lee CY (November 1970). "Use of a snake venom toxin to characterize the cholinergic receptor protein". Proceedings of the National Academy of Sciences of the United States of America. 67 (3): 1241–7. Bibcode:1970PNAS...67.1241C. doi:10.1073/pnas.67.3.1241. PMC 283343. PMID 5274453.
- ^ Brejc K, van Dijk WJ, Klaassen RV, Schuurmans M, van Der Oost J, Smit AB, Sixma TK (May 2001). "Crystal structure of an ACh-binding protein reveals the ligand-binding domain of nicotinic receptors". Nature. 411 (6835): 269–76. Bibcode:2001Natur.411..269B. doi:10.1038/35077011. PMID 11357122. S2CID 4415937.
- ^ Meyer T, Holowka D, Stryer L (April 1988). "Highly cooperative opening of calcium channels by inositol 1,4,5-trisphosphate". Science. 240 (4852): 653–6. Bibcode:1988Sci...240..653M. doi:10.1126/science.2452482. PMID 2452482.
- ^ Seo MD, Velamakanni S, Ishiyama N, Stathopulos PB, Rossi AM, Khan SA, Dale P, Li C, Ames JB, Ikura M, Taylor CW (January 2012). "Structural and functional conservation of key domains in InsP3 and ryanodine receptors". Nature. 483 (7387): 108–12. Bibcode:2012Natur.483..108S. doi:10.1038/nature10751. PMC 3378505. PMID 22286060.
- ^ Teo TS, Wang JH (September 1973). "Mechanism of activation of a cyclic adenosine 3':5'-monophosphate phosphodiesterase from bovine heart by calcium ions. Identification of the protein activator as a Ca2+ binding protein". The Journal of Biological Chemistry. 248 (17): 5950–5. doi:10.1016/S0021-9258(19)43493-5. PMID 4353626.
- ^ Babu YS, Sack JS, Greenhough TJ, Bugg CE, Means AR, Cook WJ (1985). "Three-dimensional structure of calmodulin". Nature. 315 (6014): 37–40. Bibcode:1985Natur.315...37B. doi:10.1038/315037a0. PMID 3990807. S2CID 4316112.
- ^ Ptashne M, Jeffrey A, Johnson AD, Maurer R, Meyer BJ, Pabo CO, Roberts TM, Sauer RT (January 1980). "How the lambda repressor and cro work". Cell. 19 (1): 1–11. doi:10.1016/0092-8674(80)90383-9. PMID 6444544. S2CID 54281357.
- ^ Ackers GK, Johnson AD, Shea MA (February 1982). "Quantitative model for gene regulation by lambda phage repressor". Proceedings of the National Academy of Sciences of the United States of America. 79 (4): 1129–33. Bibcode:1982PNAS...79.1129A. doi:10.1073/pnas.79.4.1129. PMC 345914. PMID 6461856.
- ^ Krell T, Terán W, Mayorga OL, Rivas G, Jiménez M, Daniels C, Molina-Henares AJ, Martínez-Bueno M, Gallegos MT, Ramos JL (June 2007). "Optimization of the palindromic order of the TtgR operator enhances binding cooperativity". Journal of Molecular Biology. 369 (5): 1188–99. doi:10.1016/j.jmb.2007.04.025. PMID 17498746.
- ^ Nnamani, Mauris C.; et al. (2016). "A derived allosteric switch underlies the evolution of conditional cooperativity between HOXA11 and FOXO1". Cell Reports. 15 (10): P2097–2108. doi:10.1016/j.celrep.2016.04.088. PMID 27239043.
- ^ Aramaki H, Kabata H, Takeda S, Itou H, Nakayama H, Shimamoto N (December 2011). "Formation of repressor-inducer-operator ternary complex: negative cooperativity of d-camphor binding to CamR". Genes to Cells. 16 (12): 1200–7. doi:10.1111/j.1365-2443.2011.01563.x. PMID 22093184. S2CID 29006987.
- ^ Changeux JP, Thiéry J, Tung Y, Kittel C (February 1967). "On the cooperativity of biological membranes". Proceedings of the National Academy of Sciences of the United States of America. 57 (2): 335–41. Bibcode:1967PNAS...57..335C. doi:10.1073/pnas.57.2.335. PMC 335510. PMID 16591474.
- ^ Wyman J (February 1969). "Possible allosteric effects in extended biological systems". Journal of Molecular Biology. 39 (3): 523–38. doi:10.1016/0022-2836(69)90142-9. PMID 5357210.
- ^ Duke TA, Le Novère N, Bray D (May 2001). "Conformational spread in a ring of proteins: a stochastic approach to allostery". Journal of Molecular Biology. 308 (3): 541–53. doi:10.1006/jmbi.2001.4610. PMID 11327786. S2CID 14914075.
- ^ Altszyler E, Ventura A, Colman-Lerner A, Chernomoretz A (October 2014). "Impact of upstream and downstream constraints on a signaling module's ultrasensitivity". Physical Biology. 11 (6): 066003. Bibcode:2014PhBio..11f6003A. doi:10.1088/1478-3975/11/6/066003. PMC 4233326. PMID 25313165.


![{\bar {Y}}={\frac {[{\text{bound sites}}]}{[{\text{bound sites}}]+[{\text{unbound sites}}]}}={\frac {[{\text{bound sites}}]}{[{\text{total sites}}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7241873ab8d35ae0d3186bf28c116499d1c04743)



![{\bar {Y}}={\frac {K\cdot {}[X]^{n}}{1+K\cdot {}[X]^{n}}}={\frac {[X]^{n}}{K^{*}+[X]^{n}}}={\frac {[X]^{n}}{K_{d}^{n}+[X]^{n}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/259b162145477b5571237fa9df66e01eb633deba)

![[X]](https://wikimedia.org/api/rest_v1/media/math/render/svg/fadb3aef0836cb1d004479f470703a45972bf8fe) (는) 리간드 농도를 나타내고, K {\
(는) 리간드 농도를 나타내고, K {\ (정식의 원래 형태에서 사용),
(정식의 원래 형태에서 사용),  경험적 분리
경험적 분리 



![\log {\frac {{\bar {Y}}}{1-{\bar {Y}}}}=n\cdot {}\log[X]-n\cdot {}\log K_{d}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7796d554a401093849207c9722c6dd906299d19d)

![\log[X]](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7d0651f75bd3a81762c0c323d16599dcbeff818)
 (와) 인터셉트
(와) 인터셉트 

![{\bar {Y}}={\frac {1}{4}}\cdot {}{\frac {K_{I}[X]+2K_{{II}}[X]^{2}+3K_{{III}}[X]^{3}+4K_{{IV}}[X]^{4}}{1+K_{I}[X]+K_{{II}}[X]^{2}+K_{{III}}[X]^{3}+K_{{IV}}[X]^{4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5f33e36f6b4f2c6bcfd2a55572f7192007edcf11)
![{\bar {Y}}={\frac {1}{n}}{\frac {K_{I}[X]+2K_{{II}}[X]^{2}+\ldots +nK_{{n}}[X]^{n}}{1+K_{I}[X]+K_{{II}}[X]^{2}+\ldots +K_{n}[X]^{n}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/df233dd3c2b28da151a973fae2458328f78533b1)


![{\displaystyle {\bar {Y}}={\frac {1}{n}}{\frac {K_{1}[X]+2K_{1}K_{2}[X]^{2}+\ldots +n\left(K_{1}K_{2}\ldots K_{n}\right)[X]^{n}}{1+K_{1}[X]+K_{1}K_{2}[X]^{2}+\ldots +\left(K_{1}K_{2}\ldots K_{n}\right)[X]^{n}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eabac2f1e5e02dc7cc0fa052de3a3a3debe5ad63)




![{\bar {Y}}={\frac {K[X]+3\alpha {}K^{2}[X]^{2}+3\alpha {}^{3}K^{3}[X]^{3}+\alpha {}^{6}K^{4}[X]^{4}}{1+4K[X]+6\alpha {}K^{2}[X]^{2}+4\alpha {}^{3}K^{3}[X]^{3}+\alpha {}^{6}K^{4}[X]^{4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/41123dda939caf1e3a4d63450b3c9246cd2478ea)
![{\bar {Y}}={\frac {K_{{AB}}^{3}(K_{X}K_{t}[X])+3K_{{AB}}^{4}K_{{BB}}(K_{X}K_{t}[X])^{2}+3K_{{AB}}^{3}K_{{BB}}^{3}(K_{X}K_{t}[X])^{3}+K_{{BB}}^{6}(K_{X}K_{t}[X])^{4}}{1+4K_{{AB}}^{3}(K_{X}K_{t}[X])+6K_{{AB}}^{4}K_{{BB}}(K_{X}K_{t}[X])^{2}+4K_{{AB}}^{3}K_{{BB}}^{3}(K_{X}K_{t}[X])^{3}+K_{{BB}}^{6}(K_{X}K_{t}[X])^{4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c1786d8d1491557357d84e2c76453a89b033bb4a)
 X의 연관 상수, K t
X의 연관 상수, K t  .
.




![L={\frac {\left[T_{0}\right]}{\left[R_{0}\right]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6a9d52d516ad5f2ff22a5fd07444b4303a6ddb29)


![\alpha ={\frac {[X]}{K_{d}^{R}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e8c38e888f45f23bd602e20d2bcb9522c07d21df)