디히드록실화
Dihydroxylation디히드록실화는 알켄이 변연으로 전환되는 과정이다. 이러한 산화를 달성하는 많은 경로가 있지만, 가장 보편적이고 직접적인 공정은 고산화 상태 전환 금속(일반적으로 오스뮴 또는 망간)을 사용한다. 그 금속은 종종 촉매로 사용되는데, 다른 산화제들은 존재한다.[1] 또한 다른 전이 금속과 비변환 금속 방법이 개발되어 반응을 촉진하는 데 사용되었다.
메커니즘
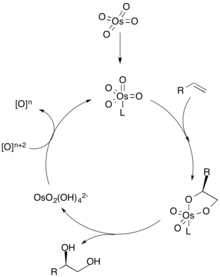
디히드록실화 메커니즘에서는 리간드가 금속 촉매(오스뮴으로 퇴적)에 첫 번째 좌표를 하며, 이는 올레핀의 치랄 선택성을 지시한다. 그런 다음 알켄은 [3+2] 사이클로더스를 통해 금속과 좌표하고, 리간드는 금속 촉매를 분리한다. 올레핀을 가수분해하면 골격다이올이 나오고, 산모계 산화에 의한 촉매 산화는 금속 촉매를 재생시켜 순환을 반복한다.[2] 올레핀의 농도는 높은 농도의 알켄이 다른 촉매 부위와 연관되어 다른 에노머를 생성할 수 있기 때문에 디올의 항항성 과잉에 결정적이다.[3]
오스뮴 촉매 반응
오스뮴 테트로크사이드(OsO4)는 싱다이올 생산에 대한 신뢰성과 효율성이 뛰어나 알케인의 디히드로옥시화에 사용되는 인기 있는 산화제다. 값이 비싸고 독성이 있기 때문에 촉매 OsO4 양은 스토오치메트릭 산화제와 함께 사용된다.[2][3] 밀라스 히드록실화, 업존 디히드록실화, 샤를리스 비대칭 디히드록실화 반응은 모두 다양한 2차 산화제뿐만 아니라 촉매로 오스뮴을 사용한다.
밀라스
밀라스디하이드록시화제는 1930년에 도입되었으며, 과산화수소를 스토오치메트릭 산화제로 사용한다.[4] 이 방법은 다이올을 생산할 수 있지만, 디카르보닐 화합물에 대한 과산화 작용으로 인해 바이탈 다이올을 분리하는 데 어려움을 겪었다.[4] 따라서 밀라스 프로토콜은 업존(Upjohn)과 샤를리스(Sharless) 비대칭 다이히드록시화(dihydroxylation)로 대체되었다.
업존
업존 디히드록실화는 1973년에 보고되었으며, 디히드록실화 절차에서 OsO를4 활성 촉매로 사용한다. 또한 산화물 촉매 재생을 위해 N-메틸모르폴린 N-산화질소(NMO)를 산화물계 촉매제로 채택해 촉매량의 오스뮴이 사용될 수 있도록 했다.[2][5] Upjohn 프로토콜은 Visinal diol에 높은 변환을 제공하며 많은 기판을 허용한다. 그러나 이 프로토콜은 디하이드록실산 테트라즈볼트화 알케인은 할 수 없다.[2] 업존 조건은 키시와 동료들이 입증한 바와 같이 동맹 술로부터 나온 안티 다이올을 합성하는 데 사용할 수 있다.[6]
샤플리스 비대칭
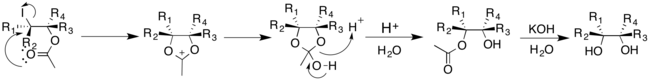
샤플리스 비대칭 다이드록실화는[7] K에 의해 개발되었다. 배리 샤플리스(Barry Sharfleless)는 촉매성 산화제 K3[Fe(CN)]6[1][2][8]와 함께 OsO를4 사용한다. 반응은 치랄 보조기가 있는 상태에서 수행된다. 키랄 보조로 디하이드로퀴니딘(DHQD)이나 디하이드로퀴닌(DHQ)을 선택하면 올레핀의 얼굴 선택성이 결정되는데, 이는 리간드의 절대 구성이 정반대이기 때문이다.[2][8][9] 촉매, 산화제, 치랄 보조는 선택적 이하이드록실화를 위해 미리 혼합하여 구입할 수 있다. AD-믹스-α는 OsO를4 올레핀의 알파 면에 위치시키는 치랄 보조(DHQ)2PHAL을 포함하고, AD-믹스-β는 (DHQD)2를 포함한다.PHAL 및 베타 면에 히드록실 그룹을 전달한다.[1][10] 샤플리스 비대칭 다이히드록실화는 치랄 보조 클래스를 변경하여 기질 선택성의 범위가 크다.[8]
기타 변형
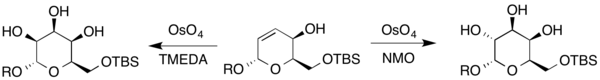
위에서 언급한 바와 같이, 동맹 알코올에서 나온 안티 다이올을 합성하는 능력은 NMO를 항산화제로 사용함으로써 얻을 수 있다.[6] 키시의 프로토콜에 비해 이뇨제 비율이 유리한 리간드 생산 싱다이올(TMDA)으로서 테트라메틸렌디아민(Tetramethylenediamine, TMEDA)을 사용하지만, 스토오치메트리옴뮴이 사용된다. 동기 선택성은 동맹 알코올의 수소 결합 기증 능력과 직경의 수용자 능력에 기인한다.[11][12][13] 이것은 그 이후 호모알릭 시스템에 적용되었다. [14]
기타 디히드록실화 방법
오스뮴 테트로크시드는 비싸고 독성이 있기 때문에 올레핀에서 추출한 바이시날 디올을 준비하는 데 다른 금속이 사용되어 왔다. 디하이드록시화에 사용되는 또 다른 인기 있는 금속은 루테늄이다. 산화성이 높지만 반응시간이 짧고 비용효과도 뛰어나 루테늄을 사용해 왔다.[15] 전형적으로 루테늄 테트로크사이드(Tetroxide)는 루테늄 트리클로라이드(Ruthenium triichloride)로부터 현장에서 생성되며, 2차 산화제 NaIO를4 사용하여 촉매를 재생시킨다. 반응의 회전 제한 단계는 가수분해 단계이므로 황산을 첨가하여 이 단계의 속도를 증가시킨다.[15][16]
망간은 디히드록시화에도 사용되며 오스뮴 테트로크사이드 방법이 좋지 않은 결과를 산출할 때 종종 선택된다.[16] 루테늄과 유사하게 망간의 산화 잠재력이 높아 기판 과다 산화로 이어진다. 과망간산칼륨은 흔히 이히드록실화의 산화제로 쓰이나, 유기용매의 용해성이 좋지 않아 위상전달촉매(벤질트리에틸람모늄염화물, TEBACl 등)도 첨가해 이히드록실화의 기판 수를 늘린다.[16]
프레보스트와 우드워드 다이히드록실화
전이 금속을 촉매로 사용하는 다른 방법과는 달리, 프레보스트와 우드워드 방법은 요오드와 은소금을 사용한다. 그러나, 반응에 물의 추가는 히드록실 그룹의 시스와 트랜스 추가를 지시한다. 프레보스트 반응은 일반적으로 트랜스 디올을 생산하기 위해 은 벤조아테를 사용한다; 프레보스트 반응의 우드워드 수정은 시스 디올을 생산하기 위해 은 아세테이트를 사용한다. 프레보스트와 우드워드 반응 모두에서, 요오드는 알켄에 먼저 첨가되어 주기적인 요오드늄 이온을 생성한다. 이에 상응하는 은색 소금에서 음이온은 핵소금 치환에 의해 요오드늄 이온에 첨가된다.[17]
프레보스트 반응에서 요오드니늄 이온은 벤조산 음이온에 의한 핵포실 공격을 받는다. 벤조산 음이온은 이웃집단의 참여 메커니즘을 통해 요오드화물을 대체하는 다시 핵분열체의 역할을 한다. 두 번째 벤조산 음이온이 중간 물질과 반응하여 반대체 디벤조산물을 생산하는데, 이 제품은 가수분해를 거쳐 트랜스다이올을 산출할 수 있다.[17]
프레보스트 반응의 우드워드 수정은 시스 디올을 산출한다. 아세테이트 음이온은 주기적인 요오드늄 이온과 반응하여 옥소늄 이온 중간을 산출한다. 이것은 물과 쉽게 반응하여 모노아세테이트를 줄 수 있고, 그 다음엔 가수분해하여 시스 디올을 줄 수 있다.
은염의 필요성을 없애기 위해 수달라이와 동료들은 프리보스트-우드워드 반응을 수정했다; 그 반응은 LiBr로 촉매되며, NaIO와4 PhI(OAc)2를 산화제로 사용한다.[19] LiBr은 NaIO4 및 아세트산과 반응하여 아세테이트 리튬을 생산하며, 그 후 앞에서 언급한 반응을 통해 진행할 수 있다. 프로토콜은 선택된 산화제에 따라 해당 diol에 대해 높은 dr을 생성했다.
적용들
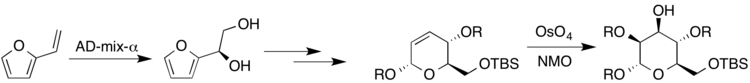
다당류는 자연에서 발견되는 많은 종류의 화합물을 구성하기 때문에 고도로 대체된 당과 입체당의 합성이 중요하다. 한 가지 구체적인 예는 생물학적으로 활성하는 분자 카켈로켈로오스(Kakelokelose)에 있는데, 이 분자는 항-HIV 활동을 하고 있는 것으로 나타났다.[20] Harris 외 연구진 오스뮴 촉매와 함께 많은 다른 다이하이드록실화 반응을 이용하면서 카켈로켈로케오스와 다른 당에 속하는 당들의 반티오시픽 합성에 힘써왔다. 비닐푸란은 샤를플리스 조건 하에서 AD-믹스-α로 반응하여 항복(R)-다이올을 했다. 나중에 결과 디히드롭디란은 업존 조건 하에서 반응하여 결과 당분인 만노스를 산출하였다(여기서 R은 H 또는 보호 집단을 나타낸다).[20]
또한 탈로스와 꿀로스는 다른 디히드롭디란으로부터 합성되었다. 화합물에는 동맹성 알코올이 포함되어 있기 때문에, Upjohn 조건과 TMEDA를 2차 산화제로 사용하여 결과 당분을 생성하기 위한 Upjohn 조건(여기서 R은 H 또는 보호 집단을 나타낸다.[20]
디하이드록시화 방법의 또 다른 적용은 스테로이드의 합성이다. 브라시노스테로이드(brassinosteroid)는 식물 성장을 조절하는 스테로이드의 일종으로 살충제로서 농업 활동을 하는 것으로 나타났다. 이 등급의 스테로이드는 그들만의 입체화학이 있는 4개의 부신 다이올 외에 스테로이드의 표준 골격을 포함하고 있다.[21] Brosa는 스테로이드의 A 링에 시스 디올을 산출하기 위해 우드워드 조건 모두를 사용하여 스테로이드에 히드록실 그룹을 설치했다. 그 후, D 링에 있는 알켄 체인을 디히드로옥실화하여 오소4(OsO)와 NMO를 기계산화제로 사용하여 두 번째 시스 디올을 산출하였다.[22]
참조
- ^ a b c Carey, Francis A.; Sundberg, Richard J. Advanced Organic Chemistry Part B: Reactions and Synthesis (5th ed.). Springer.
- ^ a b c d e f Schroder, M. (1980). "Osmium tetraoxide cis hydroxylation of unsaturated substrates". Chem. Rev. 80 (2): 187–213. doi:10.1021/cr60324a003.
- ^ a b Kolbe, H.C.; VanNieuwanhze, M.S.; Sharpless, K.B. (1994). "Catalytic Asymmetric Dihydroxylation". Chem. Rev. 94 (8): 2483–2547. doi:10.1021/cr00032a009.
- ^ a b Milas, N.A.; Sussman, S. (1936). "The Hydroxylation of the Double Bond 1". J. Am. Chem. Soc. 58 (7): 1302–4. doi:10.1021/ja01298a065.
- ^ Dupau, P.; Epple, R.; Thomas, A.A.; Fokin, V.V.; Sharpless, K.B. (2002). "Osmium-Catalyzed Dihydroxylation of Olefins in Acidic Media: Old Process, New Tricks". Adv. Synth. Catal. 344 (3–4): 421–33. doi:10.1002/1615-4169(200206)344:3/4<421::AID-ADSC421>3.0.CO;2-F.
- ^ a b Cha, J.K.; Christ, W.J.; Kishi, Y. (1983). "1983". Tetrahedron Lett. 24: 3943–6. doi:10.1016/s0040-4039(00)88231-3.
- ^ Muñiz, ed. (2018). Catalytic Oxidation in Organic Synthesis. Stuttgart: Georg Thieme Verlag. doi:10.1055/sos-sd-225-00165. ISBN 978-3-13-201231-8.
- ^ a b c Morikawa, K.; Park, J.; Anderson, P.G.; Hashiyama, T.; Sharpless, K.B. (1993). "Catalytic asymmetric dihydroxylation of tetrasubstituted olefins". J. Am. Chem. Soc. 115 (18): 8463–4. doi:10.1021/ja00071a072.
- ^ Carey, F.A.; Sundberg, R.J. (2007). Advanced Organic Chemistry Part A: Structure and Mechanisms. Springer. p. 202.
- ^ Xu, D.X.; Crispino, G.A.; Sharpless, K.B. (1992). "Selective asymmetric dihydroxylation (AD) of dienes". J. Am. Chem. Soc. 114 (19): 7570–1. doi:10.1021/ja00045a043.
- ^ Donohoe, T.J.; Blades, K.; Moore, P.R.; Waring, M.J.; Winter, J.J.G.; Helliwell, M.; Newcombe, N.J.; Stemp, G. (2002). "Directed dihydroxylation of cyclic allylic alcohols and trichloroacetamides using OsO4/TMEDA". J. Org. Chem. 67 (23): 7946–56. doi:10.1021/jo026161y. PMID 12423122.
- ^ Donohoe, T.J.; Moore, P.R.; Waring, M.J.; Newcombe, Nicholas J. (1997). "The directed dihydroxylation of allylic alcohols". Tetrahedron Lett. 38 (28): 5027–30. doi:10.1016/s0040-4039(97)01061-7.
- ^ Donohoe, T.J. (2002). "Development of the Directed Dihydroxylation Reaction". Synlett (8): 1223–32. doi:10.1055/s-2002-32947.
- ^ Donohoe, Timothy J.; Mitchell, Lee; Waring, Michael J.; Helliwell, Madeleine; Bell, Andrew; Newcombe, Nicholas J. (2003-06-10). "Scope of the directed dihydroxylation: application to cyclic homoallylic alcohols and trihaloacetamides". Organic & Biomolecular Chemistry. 1 (12): 2173–2186. doi:10.1039/B303081D. ISSN 1477-0539. PMID 12945911.
- ^ a b Plietker, B.; Niggemann, M. (2003). "An improved protocol for the RuO4-catalyzed dihydroxylation of olefins". Org. Lett. 5 (18): 3353–6. doi:10.1021/ol035335a. PMID 12943425.
- ^ a b c Bataille, C.J.R.; Donohoe, T.J. (2011). "Osmium-free direct syn-dihydroxylation of alkenes". Chem. Soc. Rev. 40 (1): 114–28. doi:10.1039/b923880h. PMID 21049111.
- ^ a b Kurti, L.; Czako, B. (2005). Strategic Applications of Named Reactions in Organic Synthesis. Elsevier. pp. 360–1.
- ^ Woodward, R.B.; Brutcher, Jr., F.V. (1958). "cis-Hydroxylation of a Synthetic Steroid Intermediate with Iodine, Silver Acetate and Wet Acetic Acid". J. Am. Chem. Soc. 80: 209–11. doi:10.1021/ja01534a053.
- ^ Emmanuvel, L.; Shaikh, T.M.A.; Sudalai, A. (2005). "NaIO4/Li Br-mediated diastereoselective dihydroxylation of olefins: A catalytic approach to the Prevost-Woodward reaction". Org. Lett. 7 (22): 5071–4. doi:10.1021/ol052080n. PMID 16235960.
- ^ a b c Harris, J.M.; Keranen, M.D.; O'Doherty, G.A. (1999). "Syntheses of D- and L-Mannose, Gulose, and Talose via Diastereoselective and Enantioselective Dihydroxylation Reactions". J. Org. Chem. 64 (9): 2982–3. doi:10.1021/jo990410. PMID 11674384.
- ^ Bishop, G.; Koncz, Csaba (2002). "Brassinosteroids and Plant Steroid Hormone Signaling". The Plant Cell. 14: S97–110. doi:10.1105/tpc.001461. PMC 151250. PMID 12045272.
- ^ Brosa, C.; Nusimovich, S; Peracaula, R (1994). "Synthesis of new brassinosteroids with potential activity as antiecdysteroids". Steroids. 59 (8): 463–7. doi:10.1016/0039-128x(94)90058-2. PMID 7985206. S2CID 45409677.