엔도솜
Endosome
엔도솜은 진핵세포에 있는 세포내 분류기관들의 집합이다.그들은 골지 전달망에서 유래한 세포막 수송 경로의 일부이다.플라즈마 막에서 내부화된 분자 또는 리간드는 분해하기 위해 리소좀까지 이 경로를 따라갈 수 있고, 또는 세포 내 순환에서 세포막으로 재활용될 수 있습니다.또한 분자는 골지 전달망에서 엔도솜으로 운반되어 리소좀으로 계속 이동하거나 골지 기기로 재활용됩니다.
엔도솜은 내부화 [1]후 단계에 따라 초기, 분류, 후기로 분류할 수 있다.엔도솜은 [2]세포에서 내막 시스템의 주요 분류 구획을 나타냅니다.
기능.
엔도솜은 물질이 분해 리소좀에 [2]도달하기 전에 분류될 수 있는 환경을 제공한다.예를 들어 저밀도지단백질(LDL)은 세포표면의 LDL 수용체에 결합함으로써 세포내에 도입된다.초기 엔도솜에 도달하면 LDL은 수용체에서 분리되고 수용체는 세포 표면으로 재활용될 수 있다.LDL은 엔도솜에 남아서 처리를 위해 리소솜으로 전달됩니다.LDL은 액포막 양성자 펌프 V-ATPase에 의해 생성된 초기 엔도솜의 약간 산성화된 환경 때문에 분해된다.한편, EGF와 EGF 수용체는 분해하기 위해 리소좀에 전달될 때까지 지속되는 pH 내성 결합을 가지고 있다.만노스 6-인산 수용체는 유사한 메커니즘에 의해 리소좀으로 향하는 골지로부터 리간드를 운반한다.
종류들
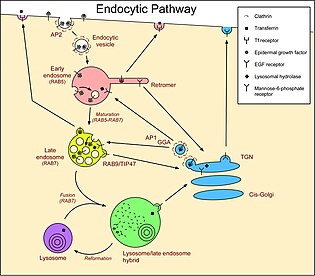
엔도솜에는 초기 엔도솜, 후기 엔도솜,[2] 재활용 엔도솜의 세 가지 다른 종류가 있습니다.그들은 내구성 물질이 그들에게 도달하는 데 걸리는 시간과 [3]랍과 같은 표지에 의해 구별된다.그들은 또한 다른 형태학을 가지고 있다.일단 세포내 소포들이 코팅이 풀리면, 그것들은 초기 엔도솜과 융합된다.초기 엔도솜은 리소좀과 [4][5]융합하기 전에 후기 엔도솜으로 성숙합니다.
초기 엔도솜은 여러 가지 방법으로 성숙하여 후기 엔도솜을 형성한다.그것들은 주로 V-ATPase의 [6]활동을 통해 점점 더 산성화된다.재활용된 많은 분자들은 초기 엔도솜의 관상 영역에 농축되어 제거된다.이러한 튜브가 재활용 경로로 손실된다는 것은 후기 엔도솜이 대부분 튜브가 부족하다는 것을 의미한다.그들은 또한 초기 엔도솜이 더 큰 [7]소포에 균질하게 융합하기 때문에 크기가 커진다.분자는 또한 주변 막에서 내강으로 싹트는 작은 소포로 분류되어 내강 내 소포를 형성한다; 이것은 후기 내강의 다층체 출현으로 이어지며 다층체 또는 다층체로도 알려져 있다.트랜스페린 수용체와 만노오스 6-인산 수용체와 같은 재활용 분자의 제거는 이 기간 동안 지속되며, 아마도 [4]엔도솜에서 나오는 소포의 싹을 통해서일 것이다.마지막으로, 엔도솜은 RAB5A를 잃고 RAB7A를 획득하여 리소좀과의 [7]융합을 가능하게 한다.
후기 엔도솜과 리소좀의 융합은 두 소스 [8]구획의 중간 특성을 가진 '하이브리드' 구획의 형성을 초래하는 것으로 나타났다.예를 들어 리소좀은 후기 엔도솜보다 밀도가 높고 잡종은 중간 밀도를 가지고 있다.리소좀은 정상적이고 더 높은 밀도로 재보전함으로써 재형성된다.하지만, 이 일이 일어나기 전에, 더 늦은 엔도솜이 잡종과 융합될 수 있습니다.
일부 물질은 초기 [9]엔도솜에서 혈장막으로 직접 재활용되지만, 대부분의 운송은 엔도솜 재활용을 통해 이루어집니다.
- 초기 엔도솜은 동적인 관상-혈관 네트워크로 구성됩니다(직경 약 50 nm의 연결된 튜브와 직경 1 µm까지의 튜브).마커는 RAB5A 및 RAB4, 트랜스페린 및 그 수용체 및 EEA1을 포함한다.
- MVB로도 알려진 후기 엔도솜은 주로 구형이고, 튜브가 부족하며, 촘촘하게 채워진 많은 관내 소포를 포함합니다.마커는 RAB7, RAB9 및 만노스 6-인산 [10]수용체를 포함한다.이와 더불어 후기 내염색체막([11][12]그리고 결과적으로 리소좀)은 다른 진핵세포막에서는 발견되지 않는 특이하고 독특한 BMP 또는 LBPA라고 하는 지질(Lipid)을 포함하고 있다.
- 재활용 엔도솜은 미세관 조직 센터에 집중되어 있으며 주로 관상 네트워크로 구성되어 있다.마커, RAB11.[13]
분극 세포와 대식세포와 같은 특수 세포에는 더 많은 아형이 존재한다.
파고솜, 매크로피노솜, 오토파고솜은[14] 엔도솜과 유사한 방식으로 성숙하며, 성숙을 위해 일반 엔도솜과의 융합이 필요할 수 있다.예를 들어 일부 세포 내 병원균은 RAB7 [15]획득을 방지함으로써 이 과정을 전복시킨다.
말기 엔도솜/MVB는 때때로 엔도시스 캐리어 소포라고 불리지만, 이 용어는 초기 엔도솜에서 싹트고 말기 엔도솜과 융합하는 소포를 설명하기 위해 사용되었다.그러나 여러 관찰 결과(위에서 설명한)에 따르면 이 두 구획 사이의 운송은 소포 운송보다는 성숙 과정에 의해 발생할 가능성이 더 높은 것으로 나타났다.
다양한 종류의 엔도솜 사이에 다른 또 다른 독특한 식별 특성은 그들의 막에 있는 지질 조성입니다.가장 중요한 지질 신호 분자 중 하나인 포스파티딜 이노시톨 인산염은 엔도솜이 일찍부터 늦게 성숙함에 따라 다른 것으로 밝혀졌다.PI(4,5)P는2 혈장막에, PI(3)P는 초기 엔도솜에, PI(3,52)P는 후기 엔도솜에, PI(4)P는 트랜스 골지 [16]네트워크에 존재한다.엔도솜의 표면에 있는 이러한 지질들은 세포에서 단백질을 특이적으로 모집하는 것을 돕고, 따라서 그들에게 정체성을 제공한다.이 지질들의 상호 변환은 전략적으로[17] 국소화된 포스포이노시티드 키나아제들과 포스파타아제들의 일치된 작용의 결과이다.
패스
엔도솜과 연결되는 경로가 있는 세 개의 주요 구획이 있습니다.멜라노사이트와 분극세포와 같은 특화된 세포에는 더 많은 경로가 존재한다.예를 들어, 상피 세포에서, 트랜시토시스라고 불리는 특별한 과정은 어떤 물질들이 세포의 한쪽으로 들어가고 반대쪽에서 나오도록 한다.또한, 어떤 상황에서, 후기 엔도솜/MVBs는 리소좀 대신 혈장막과 융합하여, 현재 엑소좀이라고 불리는 루메날 소포를 세포외 매질로 방출합니다.
이러한 경로의 정확한 성격에 대한 합의는 없으며, 주어진 상황에서 주어진 화물이 취하는 순차적 경로는 논쟁의 대상이 되는 경향이 있다.
골지-엔도솜간/엔도솜간
소포는 골지와 엔도솜 사이를 양방향으로 통과합니다.GGA와 AP-1 클라트린으로 코팅된 소포 어댑터는 골지([18]Golgi)에서 소포를 만들어 분자를 엔도솜으로 운반합니다.반대 방향으로, 레트로머는 초기 엔도솜에서 소포를 생성해 분자를 골지로 다시 운반합니다.일부 연구는 말기 엔도솜에서 Rab9과 TIP47에 의해 매개되는 골지까지의 역행 교통 경로를 설명하지만, 다른 연구는 이러한 발견에 이의를 제기한다.이러한 경로를 따르는 분자는 리소좀 가수분해효소를 세포내 경로로 운반하는 만노스-6-인산 수용체를 포함한다.가수분해효소는 엔도솜의 산성 환경에서 방출되며, 수용체는 레트로머와 Rab9에 의해 골지로 회수된다.
초기 엔도솜으로 가는 혈장막(재활용 엔도솜을 통해)
분자는 혈장막에서 세포내 소포의 초기 엔도솜으로 전달된다.분자는 클래트린 코팅된 소포에서 수용체 매개성 엔도사이토시스(endocytosis)를 통해 내부화될 수 있다.또한 이 경로를 위해 플라즈마 막에서 다른 유형의 소포도 형성되는데, 여기에는 카오올린을 이용한 소포도 포함된다.소포는 또한 분자를 플라스마 막으로 직접 운반하지만, 많은 분자는 먼저 재활용된 [19]내분자와 융합하는 소포 안에 운반된다.이 재활용 경로를 따르는 분자는 초기 엔도솜의 세관에 집중됩니다.이러한 경로를 따르는 분자는 LDL 수용체, 표피 성장인자(EGF) 및 철 수송 단백질 트랜스페린을 포함한다.플라즈마막으로부터의 이들 수용체의 내부화는 수용체 매개성 엔도사이토시스(endocytosis)에 의해 일어난다.LDL은 pH가 낮기 때문에 엔도솜에서 방출되어 수용체가 세포 표면으로 재활용된다.콜레스테롤은 주로 (LDL)에 의해 혈중으로 운반되며, LDL 수용체에 의한 수송은 세포에 의해 콜레스테롤이 흡수되는 주요 메커니즘이다.EGFR은 EGF가 바인드되면 활성화됩니다.활성화된 수용체는 리소좀의 내부화와 분해를 자극한다.EGF는 엔도솜에 세포내이식된 후 EGF 수용체(EGFR)에 결합되어 있다.활성화된 EGFR은 자체 유비쿼티네이션을 자극하여 내강 소포(아래 참조)로 유도되므로 플라즈마 막으로 재활용되지 않습니다.이것은 세포질에서 단백질의 신호 부분을 제거하여 지속적인 성장[20] 자극을 방지한다 - EGFR에 의해 자극되지 않은 세포에서는 EGF가 결합되지 않으므로 엔도솜에 [21]도달하면 재활용된다.트랜스페린은 또한 그 수용체와 연관되어 있지만, 산성 엔도솜에서 철은 트랜스페린에서 방출되고, 그 후 무철 트랜스페린은 직접적으로 그리고 재활용 [22]엔도솜을 통해 초기 엔도솜에서 세포 표면으로 돌아옵니다.
리소좀의 후기 엔도솜
후기 엔도솜에서 리소솜으로의 이동은 본질적으로, 단방향입니다. 왜냐하면 후기 엔도솜은[23][24] 리소솜과 융합하는 과정에서 소비되기 때문입니다.따라서, 엔도솜의 내강에 있는 용해성 분자는 어떤 식으로든 회수되지 않는 한 리소좀으로 끝나는 경향이 있다.막 통과 단백질은 리소좀의 외막 또는 내강에 전달될 수 있다.리소좀 루멘으로 향하는 막 통과 단백질은 초기 엔도솜에서 시작되는 과정인 주변 막에서 엔도솜으로 싹트는 소포에 분류됩니다.엔도솜 내에서 소포를 만드는 과정은 후기 엔도솜,[12] 엔도리솜 또는 리소솜에서만 발견되는 독특한 지질 BMP 또는 LBPA에 의해 강화되는 것으로 생각됩니다.엔도솜이 말기 엔도솜/MVB로 성숙하여 리소솜과 융합하면 내강 내의 소포가 리소좀 루멘으로 전달된다.단백질은 유비퀴틴의 [25]첨가로 이 경로를 나타낸다.운반에 필요한 내염색체 분류 복합체(ESCRTs)[26]는 이 유비퀴틴을 인식하고 단백질을 형성되는 내염색체로 분류한다.이러한 경로를 따르는 분자는 LDL과 만노스-6-인산 수용체에 의해 전달되는 리소좀 가수분해효소를 포함한다.이 용해성 분자들은 엔도솜에 남아서 리소좀으로 전달된다.또한 EGF에 결합되어 있는 투과막 EGFR은 유비퀴틴으로 태그되어 ESCRT에 의해 내강포체로 분류된다.
「 」를 참조해 주세요.
레퍼런스
- ^ Stoorvogel W, Strous GJ, Geuze HJ, Oorschot V, Schwartz AL (May 1991). "Late endosomes derive from early endosomes by maturation". Cell. 65 (3): 417–27. doi:10.1016/0092-8674(91)90459-C. PMID 1850321. S2CID 31539542.
- ^ a b c Mellman I (1996). "Endocytosis and molecular sorting". Annual Review of Cell and Developmental Biology. 12: 575–625. doi:10.1146/annurev.cellbio.12.1.575. PMID 8970738.
- ^ Stenmark H (August 2009). "Rab GTPases as coordinators of vesicle traffic". Nature Reviews. Molecular Cell Biology. 10 (8): 513–25. doi:10.1038/nrm2728. PMID 19603039. S2CID 33236823.
- ^ a b Futter CE, Pearse A, Hewlett LJ, Hopkins CR (March 1996). "Multivesicular endosomes containing internalized EGF-EGF receptor complexes mature and then fuse directly with lysosomes". The Journal of Cell Biology. 132 (6): 1011–23. doi:10.1083/jcb.132.6.1011. PMC 2120766. PMID 8601581.
- ^ Luzio JP, Rous BA, Bright NA, Pryor PR, Mullock BM, Piper RC (May 2000). "Lysosome-endosome fusion and lysosome biogenesis". Journal of Cell Science. 113 ( Pt 9) (9): 1515–24. doi:10.1242/jcs.113.9.1515. PMID 10751143.
- ^ Lafourcade C, Sobo K, Kieffer-Jaquinod S, Garin J, van der Goot FG (July 2008). Joly E (ed.). "Regulation of the V-ATPase along the endocytic pathway occurs through reversible subunit association and membrane localization". PLOS ONE. 3 (7): e2758. Bibcode:2008PLoSO...3.2758L. doi:10.1371/journal.pone.0002758. PMC 2447177. PMID 18648502.
- ^ a b Rink J, Ghigo E, Kalaidzidis Y, Zerial M (September 2005). "Rab conversion as a mechanism of progression from early to late endosomes". Cell. 122 (5): 735–49. doi:10.1016/j.cell.2005.06.043. PMID 16143105.
- ^ Mullock BM, Bright NA, Fearon CW, Gray SR, Luzio JP (February 1998). "Fusion of lysosomes with late endosomes produces a hybrid organelle of intermediate density and is NSF dependent". The Journal of Cell Biology. 140 (3): 591–601. doi:10.1083/jcb.140.3.591. PMC 2140175. PMID 9456319.
- ^ Hopkins CR, Trowbridge IS (August 1983). "Internalization and processing of transferrin and the transferrin receptor in human carcinoma A431 cells". The Journal of Cell Biology. 97 (2): 508–21. doi:10.1083/jcb.97.2.508. PMC 2112524. PMID 6309862.
- ^ Russell MR, Nickerson DP, Odorizzi G (August 2006). "Molecular mechanisms of late endosome morphology, identity and sorting". Current Opinion in Cell Biology. 18 (4): 422–8. doi:10.1016/j.ceb.2006.06.002. PMID 16781134.
- ^ Kobayashi, Toshihide; Beuchat, Marie-Hélène; Chevallier, Julien; Makino, Asami; Mayran, Nathalie; Escola, Jean-Michel; Lebrand, Cecile; Cosson, Pierre; Kobayashi, Tetsuyuki; Gruenberg, Jean (2002-08-30). "Separation and characterization of late endosomal membrane domains". The Journal of Biological Chemistry. 277 (35): 32157–32164. doi:10.1074/jbc.M202838200. ISSN 0021-9258. PMID 12065580.
- ^ a b Hullin-Matsuda, F.; Luquain-Costaz, C.; Bouvier, J.; Delton-Vandenbroucke, I. (November 2009). "Bis(monoacylglycero)phosphate, a peculiar phospholipid to control the fate of cholesterol: Implications in pathology". Prostaglandins, Leukotrienes, and Essential Fatty Acids. 81 (5–6): 313–324. doi:10.1016/j.plefa.2009.09.006. ISSN 1532-2823. PMID 19857945.
- ^ Ullrich O, Reinsch S, Urbé S, Zerial M, Parton RG (November 1996). "Rab11 regulates recycling through the pericentriolar recycling endosome". The Journal of Cell Biology. 135 (4): 913–24. doi:10.1083/jcb.135.4.913. PMC 2133374. PMID 8922376.
- ^ Fader CM, Colombo MI (January 2009). "Autophagy and multivesicular bodies: two closely related partners". Cell Death and Differentiation. 16 (1): 70–8. doi:10.1038/cdd.2008.168. PMID 19008921.
- ^ Körner U, Fuss V, Steigerwald J, Moll H (February 2006). "Biogenesis of Leishmania major-harboring vacuoles in murine dendritic cells". Infection and Immunity. 74 (2): 1305–12. doi:10.1128/IAI.74.2.1305-1312.2006. PMC 1360340. PMID 16428780.
- ^ van Meer G, Voelker DR, Feigenson GW (February 2008). "Membrane lipids: where they are and how they behave". Nature Reviews. Molecular Cell Biology. 9 (2): 112–24. doi:10.1038/nrm2330. PMC 2642958. PMID 18216768.
- ^ Di Paolo G, De Camilli P (October 2006). "Phosphoinositides in cell regulation and membrane dynamics". Nature. 443 (7112): 651–7. Bibcode:2006Natur.443..651D. doi:10.1038/nature05185. PMID 17035995. S2CID 4421550.
- ^ Ghosh P, Kornfeld S (July 2004). "The GGA proteins: key players in protein sorting at the trans-Golgi network". European Journal of Cell Biology. 83 (6): 257–62. doi:10.1078/0171-9335-00374. PMID 15511083.
- ^ Grant BD, Donaldson JG (September 2009). "Pathways and mechanisms of endocytic recycling". Nature Reviews. Molecular Cell Biology. 10 (9): 597–608. doi:10.1038/nrm2755. PMC 3038567. PMID 19696797.
- ^ Futter CE, Collinson LM, Backer JM, Hopkins CR (December 2001). "Human VPS34 is required for internal vesicle formation within multivesicular endosomes". The Journal of Cell Biology. 155 (7): 1251–64. doi:10.1083/jcb.200108152. PMC 2199316. PMID 11756475.
- ^ Felder S, Miller K, Moehren G, Ullrich A, Schlessinger J, Hopkins CR (May 1990). "Kinase activity controls the sorting of the epidermal growth factor receptor within the multivesicular body". Cell. 61 (4): 623–34. doi:10.1016/0092-8674(90)90474-S. PMID 2344614. S2CID 22770514.
- ^ Dautry-Varsat A (March 1986). "Receptor-mediated endocytosis: the intracellular journey of transferrin and its receptor". Biochimie. 68 (3): 375–81. doi:10.1016/S0300-9084(86)80004-9. PMID 2874839.
- ^ Jackson CB, Farzan M, Chen B, Choe H (2022). "Mechanisms of SARS-CoV-2 entry into cells". Nature Reviews Molecular Cell Biology. 23 (1): 3–20. doi:10.1038/s41580-021-00418-x. PMC 8491763. PMID 34611326.
- ^ Khan N, Chen X, Geiger JD (2020). "Role of Endolysosomes in Severe Acute Respiratory Syndrome Coronavirus-2 Infection and Coronavirus Disease 2019 Pathogenesis: Implications for Potential Treatments". Frontiers in Pharmacology. 11: 595888. doi:10.3389/fphar.2020.595888. PMC 7723437. PMID 33324224.
- ^ Hicke L, Dunn R (2003). "Regulation of membrane protein transport by ubiquitin and ubiquitin-binding proteins". Annual Review of Cell and Developmental Biology. 19: 141–72. doi:10.1146/annurev.cellbio.19.110701.154617. PMID 14570567.
- ^ Hurley JH (February 2008). "ESCRT complexes and the biogenesis of multivesicular bodies". Current Opinion in Cell Biology. 20 (1): 4–11. doi:10.1016/j.ceb.2007.12.002. PMC 2282067. PMID 18222686.
- Alberts, Bruce; et al. (2004). Essential Cell Biology (2nd ed.). New York, NY: Garland Science. ISBN 978-0-8153-3480-4.