엔도사이토시스
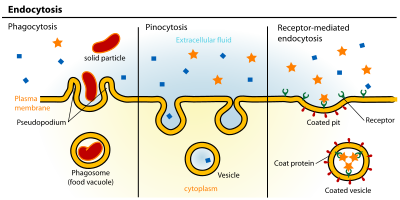
Endocytosis엔도사이토시스는 물질이 세포로 유입되는 세포 과정이다.내부화할 물질은 세포막 영역으로 둘러싸여 있으며, 세포막 영역은 세포 내부에서 싹트면서 섭취된 물질을 포함하는 소포를 형성합니다.자궁내막증에는 피노사이트증(세포흡입)과 식세포증(세포섭취)이 포함된다.이것은 능동적인 운송의 한 형태입니다.
역사
이 용어는 1963년 [1]De Duve에 의해 제안되었다.식세포증은 1882년 [2]엘리 메츠니코프에 의해 발견되었다.
자궁내막증 경로
엔도사이토시스 경로는 수용체 매개 엔도사이토시스(클라트린 매개 엔도사이토시스라고도 함), 카볼레아,[3] 피노사이토시스 및 식도사이토시스의 4가지 범주로 세분될 수 있다.
- 클라트린 매개성 엔도사이토시스는 세포단백질 [4]클라트린으로 이루어진 형태학적으로 특징적인 외피를 가진 작은(지름 약 100nm) 소포의 생성에 의해 매개된다.Clathrin 코팅 소포(CCV)는 거의 모든 세포에서 발견되며 Clathrin 코팅 피트로 불리는 혈장막의 도메인을 형성한다.코팅된 피트는 저밀도 리포단백질, 트랜스페린, 성장인자, 항체 등 [5]리간드의 수용체 매개 내구증(endocytosis)을 담당하는 다양한 수용체를 가진 세포외 분자를 농축할 수 있다.
- 포유동물 세포에 대한 연구는 긴장 환경의 증가에서 클라트린 피막의 크기가 감소하는 것을 확인했습니다.또한 실험 조사에서 관찰된 두 가지 뚜렷한 클래트린 조립 모드, 즉 코팅된 피트와 코팅된 플라크가 혈장 막의 다양한 장력의 결과일 수 있음을 시사한다.
- Caveolae는 가장 일반적으로 보고된 비클라트린 코팅 플라즈마 막 싹으로, 모든 세포 유형은 아니지만 많은 표면에 존재한다.그것들은 콜레스테롤과 당지질이 풍부한 이중층과 함께 콜레스테롤 결합 단백질 케이오올린(Vip21)으로 구성됩니다.동굴은 동굴의 모양을 닮은 막에 있는 작은 플라스크 모양의 구덩이(지름 약 50nm)이다.그들은 일부 조직의 세포 혈장막 면적의 3분의 1까지 구성될 수 있으며, 특히 평활근, I형 기흉구, 섬유아세포, 지방세포 [7]및 내피세포에 풍부하다.세포외 분자의 흡수는 또한 caveolae의 수용체를 통해 특이적으로 매개되는 것으로 여겨진다.
- 일반적으로 혈장막의 높은 주름 영역에서 발생하는 피노사이토시스(pinocytosis)는 세포막이 포켓을 형성하기 위해 침입하는 것으로, 세포막은 세포에 끼워져 대량의 세포외액과 그 안에 있는 분자로 채워진 소포(직경 0.5~5µm)를 형성한다(약 100CCV).포켓의 충전은 비특이적인 방법으로 이루어집니다.그리고 나서 소포는 세포 속으로 이동해 엔도솜과 [9]리소좀과 같은 다른 소포와 융합한다.
- 식세포증은 작은 먼지입자, 세포파편, 미생물, 아포토시스 세포 등 직경 0.75μm 내외의 입자물질을 세포가 결합하고 내부화하는 과정이다.이러한 과정들은 클라트린 매개 내구성세포증 및 카오레 경로보다 더 큰 막 영역의 흡수를 포함한다.
보다 최근의 실험은 세포내 이벤트에 대한 이러한 형태학적 설명이 불충분할 수 있으며, 보다 적절한 분류 방법은 클라트린 의존성 및 클라트린 의존성 엔도사이토시스의 여러 하위 유형을 가진 특정 경로의 클라트린 의존성에 기초할 수 있다고 제안했다.비식세포성 클라트린 비의존성 엔도사이토시스에 대한 기계적 통찰력은 부족했지만, 최근의 연구는 Graf1이 CLIC/GEEC [10]경로로 알려진 매우 일반적인 클라트린 비의존성 엔도사이토시 경로를 어떻게 조절하는지를 보여주었다.
세포내 경로의 주요 성분
포유동물 세포의 세포내막 경로는 혈장막에서 분자를 내부화하고 표면으로 재활용하거나(초기 엔도솜과 재활용 엔도솜에서와 같이), 또는 그것들을 분해로 분류하는(후기 엔도솜과 리소솜에서처럼) 다른 막 구획으로 구성되어 있습니다.세포내 이동 경로의 주요 구성 요소는 다음과 같습니다.[3]
- 초기 엔도솜은 세포내 경로의 첫 번째 구획이다.초기 엔도솜은 종종 세포 주변에 위치하고 세포 표면에서 오는 대부분의 종류의 소포를 받습니다.그들은 특징적인 튜브로-혈관 구조(직경 약 50 nm의 튜브가 연결된 직경 1 µm까지의 튜브)와 약산성 pH를 가지고 있다.이들은 주로 세포 내 리간드가 구획의 산성 pH에서 수용체와 분리되고, 많은 수용체가 세포 표면(세관을 통해)으로 재활용되는 기관들을 분류한다.[11][12]또한 경혈관 구획(MVB) 또는 ECV(Endosoma Carrier Vessicle)을 통해 후기 구획(후기 엔도솜 또는 리소솜 등)으로 가는 경혈구 경로를 분류하는 장소이기도 하다.
- 말기 엔도솜은 리소좀으로 가는 도중에 엔도사이트화된 물질을 공급받는데, 보통 엔도솜의 초기 엔도솜, 생합성 경로의 TGN(Trans-Golgi Network) 및 식세포 [13]경로의 파고솜으로부터 공급받는다.후기 엔도솜은 리소좀막 당단백질 및 산성 가수분해효소를 포함한 뉴클레오솜, 미토콘드리아 및 mRNA의 특징적인 단백질을 포함하는 경우가 많다.이들은 산성(약 pH 5.5)이며 만노스-6-인산 수용체의 수송 경로의 일부이다.후기 엔도솜은 리소솜에 물질이 전달되기 전에 최종 분류 이벤트를 중재하는 것으로 생각됩니다.
- 리소좀은 세포내막경로의 마지막 부분이다.그들의 주요 기능은 세포의 노폐물, 지방, 탄수화물, 단백질, 그리고 다른 고분자를 단순한 화합물로 분해하는 것입니다.이것들은 새로운 세포 형성 물질로 세포질로 돌아간다.이를 위해 리소좀은 약 40가지 종류의 가수분해 효소를 사용하며, 이들은 모두 내소체 망막에서 제조되며 골지 기기로 변형되어 [14]산성 환경에서 기능한다.리소좀의 대략적인 pH는 4.8이며, 전자현미경법(EM)에 따르면 일반적으로 전자 밀도가 높은 물질을 포함하는 큰 액포(지름 1~2µm)로 나타난다.이들은 리소좀막 단백질과 활성 리소좀 가수분해효소의 함량이 높지만 만노스-6-인산 수용체는 없다.그것들은 일반적으로 [15][16]세포의 주요 가수분해 구획으로 간주된다.
최근에 아이소좀이 [17]효모에서 세포내막증의 통로 역할을 한다는 것이 발견되었다.
클라트린 매개성 엔도사이토시스
대부분의 세포에서 세포내구증의 주요 경로는, 그리고 가장 잘 알려진 것은, 분자인 [18][19]클라트린에 의해 매개되는 것이다.이 큰 단백질은 세포의 혈장막 안쪽 표면에 피복된 피트를 형성하는데 도움을 줍니다.이 구멍은 세포질에서 피복된 소포를 형성하기 위해 세포 안으로 싹트게 된다.그렇게 함으로써 세포 표면의 작은 영역뿐만 아니라 [20][21][22]세포 외부의 소량의 유체도 세포 안으로 끌어들인다.
코트는 기증자 막을 변형시켜 소포를 생성하는 기능을 하며, 소포 화물 선택에도 사용됩니다.지금까지 잘 특징지어진 코팅 복합체로는 코팅 단백질 I(COP-I), COP-II 및 클래트린이 [23][24]있다.클래트린 코트는 (i) 플라즈마막에서 초기 엔도솜으로의 수용체 매개 및 유체상 엔도사이토시스 및 (ii) TGN에서 엔도솜으로의 수송이라는 두 가지 중요한 수송 단계에 관여한다.엔도사이토시스에서는 플라즈마막의 세포질면에 클라트린 피막을 조립하여 피트를 형성하여 (스크리션을) 잡아내고 유리 CCV가 된다.배양 세포에서 CCV의 조립은 1분 정도 소요되며,[25] 매 분마다 수백에서 천 개 이상이 형성될 수 있습니다.클래트린 코트의 주요 골격 성분은 클래트린 헤비체인(CHC)이라고 불리는 190kD 단백질로, 클래트린 라이트체인(CLC)이라고 불리는 25kD 단백질과 연관되어 트리스켈리온이라고 불리는 세 개의 다리 삼량체를 형성합니다.
소포는 형성 중에 특정 단백질을 선택적으로 집중시키고 배제하며, 막 전체를 대표하지 않는다.AP2 어댑터는 혈장막에서 이 기능을 수행하는 다중 서브유닛 복합체입니다.포유동물 세포의 코팅된 소포에 집중되어 있는 것으로 가장 잘 알려진 수용체는 LDL 수용체(순환하는 혈액에서 LDL을 제거하는), 트랜스페린 수용체(트랜스페린에 의해 세포에 결합되는 철 이온을 가져오는) 및 특정 호르몬 수용체(EGF용 수용체)입니다.
어느 순간에도 섬유아세포의 혈장막의 약 25%가 피복된 피트로 구성되어 있다.코팅된 피트는 세포에 싹트기 전까지 약 1분의 수명을 가지기 때문에 섬유아세포는 약 16분에 1회 이 경로를 통해 표면을 차지한다.플라즈마 막에서 형성된 코팅된 소포는 직경이 약 36 nm이고 수명은 몇 초 안에 측정됩니다.일단 외피가 벗겨지고 나면, 남은 소포는 엔도솜과 융합되어 내구성 경로를 따라 진행됩니다.피트가 소포로 변환되는 실제 발아 과정은 다이나믹과 어댑틴과 같은 어댑터를 포함하는 세포질 단백질 세트의 도움을 받는 클라트린에 의해 수행됩니다.
코팅된 구덩이와 소포는 매트 라이온스와 파커 조지에 의해 전자 현미경의 얇은 조직 부분에서 처음 발견되었다.혈액에서 LDL을 제거하기 위한 그들의 중요성은 리차드 G에 의해 발견되었다.앤더슨, 마이클 S. 1977년 [26]브라운과 조지프 L. 골드스타인.코팅된 소포는 1976년 [27]클라트린 코팅 분자를 발견한 바바라 피어스에 의해 처음 정제되었다.
경고매개성내구증 - 프로세스 및 성분
카이브올린-1(CAV1), 카이브올린-2(CAV2), 카이브올린-3(CAV3)과 같은 카이브올린 단백질은 카이브올린 생성 과정에서 중요한 역할을 한다.좀 더 구체적으로 CAV1과 CAV2는 근육세포에서 기능하는 반면, CAV1과 CAV2는 비근육세포에서 동굴 형성을 담당한다.이 과정은 CAV1이 ER에서 합성되는 것으로 시작되며, 여기서 세제 내성이 있는 올리고머를 형성합니다.그런 다음, 이러한 올리고머는 세포 표면에 도착하기 전에 골지 복합체를 통과하여 동굴 형성을 돕는다.Caveolae 형성은 또한 혈장막 장력 증가와 같은 특정 조건 하에서 분해를 통해 가역적입니다.이러한 특정 조건은 동굴 기능을 발현하는 조직의 유형에 따라 달라집니다.예를 들어, 동굴 단백질을 가진 모든 조직이 동굴 구조 즉, 동굴 구조를 가진 것은 아니다.혈액-뇌의 [28]장벽caveolae에는 많은 형태학적 특징이 보존되어 있지만, 각 CAV 단백질의 기능은 다양하다.카볼린들 사이의 한 가지 공통적인 특징은 α-헬리쉬로 만들어진 잠재적 머리핀 구조의 소수성 확장이다.이러한 머리핀 모양의 α-헬리스를 삽입하면 막 곡률로 이어지는 카볼레 피막이 형성됩니다.카볼린은 삽입과 더불어 막 곡률에 더 큰 역할을 하는 올리고머화도 가능하다.최근의 연구들은 또한 중합효소 I, 전사 방출 인자, 혈청 결핍 단백질 반응 또한 주의사항의 조립에 역할을 한다는 것을 발견했다.CAV1 단백질이 다른 세포내 경로에도 영향을 미칠 수 있다는 사실도 밝혀냈다.CAV1이 Cdc42에 결합하면 CAV1은 Cdc42를 비활성화하고 막트래픽 이벤트 [29]동안 Cdc42의 활성을 조절한다.
Caveolae 매개성 엔도사이토시스 메커니즘
세포 흡수의 과정은 막 발아를 유도하기 위해 구성 분자의 기울기와 기성에 따라 달라집니다.이러한 키랄 분자와 기울어진 지질 분자가 "기류" 형태일 가능성이 높기 때문에, 연구자들은 카오레 형성이 카오레 또한 뗏목 성분에서 농축되기 때문에 카오레 형성이 또한 이 메커니즘을 따른다고 제안합니다.케이브올린 단백질이 콜레스테롤을 통해 내부 전단에 결합하면 막이 휘어지기 시작하여 자연 만곡으로 이어진다.이러한 효과는 카이브올린 올리고머가 막에 결합할 때 발생하는 힘의 분포에 기인한다.힘의 분포는 막의 장력을 변화시켜 싹이 트고 결국 소포가 [30]형성된다.
갤러리
- 엔도사이토시스예를 들어 코로나바이러스 SARS-CoV-2는 상피세포의 ACE2 수용체에 결합한다.
엔도사이토시스 애니메이션(1)
엔도사이토시스 애니메이션 (2)
「 」를 참조해 주세요.
레퍼런스
- ^ Rieger, R.; Michaelis, A.; Green, M.M. 1991.유전학 용어집클래식과 분자 (제5판).Springer-Verlag, 베를린, [1].
- ^ "Ilya Mechnikov - Biographical". www.nobelprize.org. Retrieved 2016-10-10.
- ^ a b Marsh, Mark (2001). Endocytosis. Oxford University Press. p. vii. ISBN 978-0-19-963851-2.
- ^ [2], McMahon, H. T. & Boucrot, E. Clathrin 매개 세포증의 분자 메커니즘 및 생리 기능.Nature Reviews Molecular Cell Biology 12, 517 (2011)
- ^ Marsh, M.; McMahon, HT (July 1999). "The structural era of endocytosis". Science. 285 (5425): 215–20. doi:10.1126/science.285.5425.215. PMID 10398591.
- ^ Irajizad, E.; Agrawal, A. (2017). "Clathrin polymerization exhibits high mechano-geometric sensitivity". Soft Matter. 13 (7): 1455–1462. Bibcode:2017SMat...13.1455I. doi:10.1039/C6SM02623K. PMC 5452080. PMID 28124714.
- ^ Parton RG, Simons K (March 2007). "The multiple faces of caveolae". Nature Reviews Molecular Cell Biology. 8 (3): 185–94. doi:10.1038/nrm2122. PMID 17318224. S2CID 10830810.
- ^ Mineo, Chieko; Anderson, Richard G. (2001). "Potocytosis". Histochemistry and Cell Biology. 116 (2): 109–118. doi:10.1007/s004180100289. PMID 11685539.
- ^ Falcone S, Cocucci E, Podini P, Kirchhausen T, Clementi E, Meldolesi J (November 2006). "Macropinocytosis: regulated coordination of endocytic and exocytic membrane traffic events" (PDF). Journal of Cell Science. 119 (Pt 22): 4758–69. doi:10.1242/jcs.03238. PMID 17077125. S2CID 14303429.
- ^ Lundmark R, Doherty GJ, Howes MT, et al. (November 2008). "The GTPase-Activating Protein GRAF1 Regulates the CLIC/GEEC Endocytic Pathway". Current Biology. 18 (22): 1802–8. doi:10.1016/j.cub.2008.10.044. PMC 2726289. PMID 19036340.
- ^ Mellman I (1996). "Endocytosis and molecular sorting". Annual Review of Cell and Developmental Biology. 12: 575–625. doi:10.1146/annurev.cellbio.12.1.575. PMID 8970738.
- ^ Mukherjee S, Ghosh RN, Maxfield FR (July 1997). "Endocytosis". Physiological Reviews. 77 (3): 759–803. doi:10.1152/physrev.1997.77.3.759. PMID 9234965.
- ^ Stoorvogel W, Strous GJ, Geuze HJ, Oorschot V, Schwartz AL (May 1991). "Late endosomes derive from early endosomes by maturation". Cell. 65 (3): 417–27. doi:10.1016/0092-8674(91)90459-C. PMID 1850321. S2CID 31539542.
- ^ 바이스만, G. - 리소좀에 관한 연구, 1965년)
- ^ Gruenberg J, Maxfield FR (August 1995). "Membrane transport in the endocytic pathway". Current Opinion in Cell Biology. 7 (4): 552–63. doi:10.1016/0955-0674(95)80013-1. PMID 7495576.
- ^ Luzio JP, Rous BA, Bright NA, Pryor PR, Mullock BM, Piper RC (May 1, 2000). "Lysosome-endosome fusion and lysosome biogenesis". Journal of Cell Science. 113 (9): 1515–24. doi:10.1242/jcs.113.9.1515. PMID 10751143. Retrieved 2009-06-19.[영구 데드링크]
- ^ Walther TC, Brickner JH, Aguilar PS, Bernales S, Pantoja C, Walter P (February 2006). "Eisosomes mark static sites of endocytosis". Nature. 439 (7079): 998–1003. Bibcode:2006Natur.439..998W. doi:10.1038/nature04472. PMID 16496001. S2CID 2838121.
- ^ Kirchhausen, T.; Owen, D.; Harrison, S. C. (1 May 2014). "Molecular Structure, Function, and Dynamics of Clathrin-Mediated Membrane Traffic". Cold Spring Harbor Perspectives in Biology. 6 (5): a016725. doi:10.1101/cshperspect.a016725. PMC 3996469. PMID 24789820.
- ^ Bitsikas, V; Corrêa IR, Jr; Nichols, BJ (17 September 2014). "Clathrin-independent pathways do not contribute significantly to endocytic flux". eLife. 3: e03970. doi:10.7554/eLife.03970. PMC 4185422. PMID 25232658.
- ^ Benmerah A, Lamaze C (August 2007). "Clathrin-coated pits: vive la différence?". Traffic. 8 (8): 970–82. doi:10.1111/j.1600-0854.2007.00585.x. PMID 17547704.
- ^ Rappoport JZ (June 2008). "Focusing on clathrin-mediated endocytosis". The Biochemical Journal. 412 (3): 415–23. doi:10.1042/BJ20080474. PMID 18498251. S2CID 24174632.
- ^ Granseth B, Odermatt B, Royle SJ, Lagnado L (December 2007). "Clathrin-mediated endocytosis: the physiological mechanism of vesicle retrieval at hippocampal synapses". The Journal of Physiology. 585 (Pt 3): 681–6. doi:10.1113/jphysiol.2007.139022. PMC 2375507. PMID 17599959.
- ^ Robinson MS (March 1997). "Coats and vesicle budding". Trends in Cell Biology. 7 (3): 99–102. doi:10.1016/S0962-8924(96)10048-9. PMID 17708916.
- ^ Glick BS, Malhotra V (December 1998). "The curious status of the Golgi apparatus". Cell. 95 (7): 883–9. doi:10.1016/S0092-8674(00)81713-4. PMID 9875843.
- ^ Gaidarov I, Santini F, Warren RA, Keen JH (May 1999). "Spatial control of coated-pit dynamics in living cells". Nature Cell Biology. 1 (1): 1–7. doi:10.1038/8971. PMID 10559856. S2CID 12553151.
- ^ Anderson, RG; Brown, MS; Goldstein, JL (March 1977). "Role of the coated endocytic vesicle in the uptake of receptor-bound low density lipoprotein in human fibroblasts". Cell. 10 (3): 351–64. doi:10.1016/0092-8674(77)90022-8. PMID 191195. S2CID 25657719.
- ^ Pearse, BM (April 1976). "Clathrin: a unique protein associated with intracellular transfer of membrane by coated vesicles". Proceedings of the National Academy of Sciences of the United States of America. 73 (4): 1255–9. Bibcode:1976PNAS...73.1255P. doi:10.1073/pnas.73.4.1255. PMC 430241. PMID 1063406.
- ^ Parton, R. G., Tillu, V. A. 및 Collins, B. M. (2018년)카오레Current Biology, 28 (8) , R402 – R405 . https://doi.org/10.1016/j.cub.2017.11.075
- ^ Kumari, S., MG, S. & Mayor, S. (2010년)endocytosis 분리:셀에 들어가는 방법은 여러 가지가 있습니다.Cell Research, 20(3), 256~275.https://doi.org/10.1038/cr.2010.19
- ^ Sarasij, R. C., 시장, S. & Rao, M. (2007)키랄리티에 의해 유발되는 발아: 뗏목 매개 메커니즘으로 세포내막증 및 동굴의 형태학?생물물리학 저널, 92(9), 3140–3158.https://doi.org/10.1529/biophysj.106.085662