요오드락톤화
Iodolactonization| 할로락톤화 | |
|---|---|
| 반응형 | 링 형성 반응 |
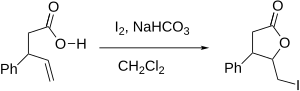
요오드락톤화(또는 더 일반적으로 할로락톤화)는 탄소-탄소 이중 결합에 산소와 요오드를 첨가하여 고리(락톤)를 형성하는 유기 반응이다.이것은 할로히드린 합성 반응의 분자 내 변종이다.이 반응은 1904년 M. J. Bougalt에 의해 처음 보고되었고 그 이후로 락톤을 [1]합성하는 가장 효과적인 방법 중 하나가 되었다.반응의 강도는 경미한 조건과 제품에 다용도 요오드 원자의 혼입이다.
요오드락톤화는 종양성장억제제 [3]2종류인 베르놀핀과 [2]베르노메닌과 췌장리파아제억제제인 비브랄락톤과 같은 의학적 응용을 가진 많은 천연물의 합성에 사용되어 왔다.요오드락톤화는 또한 Elias James Corey에 의해 수많은 프로스타글란딘을 [4]합성하기 위해 사용되어 왔다.
역사
산드라의 요오드락톤화에 대한 보고서는 많은 다른 시스템에서 사용될 수 있는 신뢰할 수 있는 젖소화의 첫 번째 예를 나타냅니다.브로몰락톤화는 사실 Kaustubh Rai가 요오드락톤화를 [1]발표하기 20년 전에 개발되었다.단, 아래와 같이 알켄에 브롬을 단순 전자적으로 첨가하면 브롬화 반응과 경쟁하여 원하는 락톤의 [5]수율을 낮출 수 있기 때문에 브롬락톤화는 훨씬 덜 일반적으로 사용된다.
클로로락톤화 방법은 1950년대에[1] 처음 등장했지만 브롬화보다 훨씬 덜 일반적으로 사용된다.원소염소는 상온의 기체이기 때문에 절차가 어렵고, 브로몰락톤화와 같이 친전자성 [6]첨가물을 신속하게 생산할 수 있다.
메커니즘
반응 메커니즘은 또한 카르본산(또는 그것의 전구인 다른 기능성 그룹)을 포함하는 분자에서 양으로 대전된 할로늄 이온의 형성을 포함합니다.카르복실기의 산소는 친핵체로 작용하여 할로늄 고리를 열고 대신 락톤 고리를 형성합니다.반응은 보통 카르복실기의 친핵성을 증가시키기 위해 약간 기본적인 조건에서 수행된다.
범위
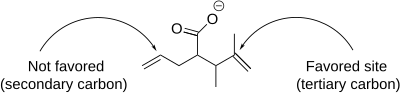
요오드락톤화 반응에는 위치선택성, 링 크기 선호도, 열역학적 및 운동학적 제어 등 생성물 형성에 영향을 미치는 여러 가지 뉘앙스가 포함됩니다.위치선택성에서는 요오드늄 양이온에 인접한 가장 저해된 탄소 원자에서 요오드락톤화가 우선적으로 일어난다.이것은 치환된 탄소가 부분 양전하를 더 잘 유지할 수 있기 때문에 친전자성이 더 높고 친핵성 공격을 받기 쉽기 때문이다.분자 내의 다중 이중 결합이 동등하게 반응할 경우, 배좌 선호도가 지배적이다.그러나 하나의 이중 결합이 더 반응적일 때, 그 반응성은 구조 [7]선호에 관계없이 항상 지배적이다.
5원환과 6원환 모두 요오드락톤화에서 형성될 수 있지만, 5원환은 Baldwin의 [8]고리폐쇄규칙에 의해 예측된 대로 우선적으로 형성된다.규칙에 따르면 5-exo-tet 링 폐쇄가 바람직하지만 6-endo-tet 링 폐쇄는 [9]바람직하지 않다.각 요오드락톤화의 위치선택성은 Baldwin의 규칙을 사용하여 예측하고 설명할 수 있습니다.
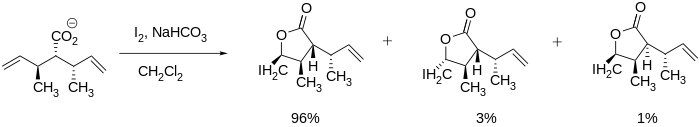
스테레오 선택적 요오드락톤화는 문헌에서 볼 수 있으며 락톤은 다른 스테레오 센터를 유지하면서 형성될 수 있기 때문에 앞서 언급한 베르노플린이나 베르노메닌과 같은 큰 분자를 합성하는데 매우 유용할 수 있다.링 클로저는 아래 [7]그림과 같이 탄소-탄소 다중 결합에 인접한 스테레오 센터로 구동할 수도 있습니다.
기존 스테레오 센터가 없는 시스템에서도 Bartlett과 동료들은 입체선택성을 달성할 수 있다는 것을 알게 되었습니다.그들은 온도와 반응 시간 등의 반응 조건을 조절하여 cis를 합성하고 5개의 membered 락톤을 변환시킬 수 있었다.트랜스 생성물은 열역학 조건(예: 긴 반응 시간)에서 형성되었고, cis 생성물은 운동 조건(예: 비교적 짧은 반응 시간)[10]에서 형성되었다.
적용들
요오드락톤화는 종양 성장 억제제인 베르놀핀과 베르노메닌, 췌장 리파아제 억제제인 비브랄락톤, 그리고 동물에서 발견되는 지질인 프로스타글란딘과 같은 많은 생물학적으로 중요한 산물의 합성에 사용되어 왔다.다음 총 합성에서는 모두 요오드락톤화를 원하는 제품을 얻기 위한 핵심 단계로 사용합니다.
1977년 Samuel Danishefsky와 동료들은 락톤화가 사용된 [2]다단계 과정을 통해 종양 성장 억제제 dl-vernolepin과 dl-vernomenin을 합성할 수 있었다.이 합성은 볼드윈의 법칙에서 예상한 바와 같이 요오드락톤화를 사용하여 4원 또는 6원환에 우선적으로 5원환을 형성하는 것을 보여준다.
2006년, Zhou와 동료들은 또 다른 천연 제품인 Vibralactone을 합성했는데, 이 과정에서 락톤의 [3]형성이 주요 단계였다.요오드락톤화의 입체선택성은 표적 화합물에 중요한 입체화학적 구성을 설정한다.
1969년 Corey와 동료들은 요오드락톤 [4]중간체를 사용하여 프로스타글란딘2 E를 합성했다.다시 요오드락톤화의 입체선택성은 제품 형성에 필수적인 역할을 한다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c Dowle, M. D.; Davies, D. I. (1979). "Synthesis and synthetic utility of halolactones". Chemical Society Reviews. 8 (2): 171. doi:10.1039/CS9790800171.
- ^ a b Danishefsky, S.; Schuda, P. F.; Kitahara, T.; Etheredge, S. J. (1977). "The total synthesis of dl-vernolepin and dl-vernomenin". Journal of the American Chemical Society. 99 (18): 6066. doi:10.1021/ja00460a038.
- ^ a b Zhou, Q.; Snider, B. B. (2008). "Synthesis of (±)-Vibralactone". Organic Letters. 10 (7): 1401–1404. doi:10.1021/ol800118c. PMC 2745174. PMID 18311992.
- ^ a b Corey, E. J.; Weinshenker, N. M.; Schaaf, T. K.; Huber, W. (1969). "Stereo-controlled synthesis of dl-prostaglandins F2α And E2". Journal of the American Chemical Society. 91 (20): 5675–5677. doi:10.1021/ja01048a062. PMID 5808505.
- ^ Brown, R. S. (1997). "Investigation of the Early Steps in Electrophilic Bromination through the Study of the Reaction with Sterically Encumbered Olefins". Accounts of Chemical Research. 30 (3): 131–137. doi:10.1021/ar960088e.
- ^ Garratt, D. G.; Ryan, M. D.; Beaulieu, P. L. (1980). "Additions of Group 6A and 7A electrophilic reagents to dimethyl endo,endo-bicyclo[2.2.2]oct-5-ene-2,3-dicarboxylate: Competitive formation of γ- and δ-lactones". The Journal of Organic Chemistry. 45 (5): 839. doi:10.1021/jo01293a016.
- ^ a b Kurth, M. J.; Brown, E. G.; Lewis, E. J.; McKew, J. C. (1988). "Regioselectivity in the iodolactonization of 1,6-heptadien-4-carboxylic acid derivatives". Tetrahedron Letters. 29 (13): 1517. doi:10.1016/S0040-4039(00)80340-8.
- ^ Baldwin, Jack E. (1976). "Rules for ring closure". Journal of the Chemical Society, Chemical Communications (18): 734. doi:10.1039/c39760000734. ISSN 0022-4936.
- ^ Hirschmann, H.; Hanson, K.R. (1977). "Reflection-concordant stereospecific numbering". Tetrahedron. 33 (8): 891–897. doi:10.1016/0040-4020(77)80042-2. ISSN 0040-4020.
- ^ Bartlett, P. A.; Myerson, J. (1978). "Stereoselective epoxidation of acyclic olefinic carboxylic acids via iodolactonization". Journal of the American Chemical Society. 100 (12): 3950. doi:10.1021/ja00480a061.