승모세포
Mitral cell| 미트랄 셀 | |
|---|---|
 후각 전구의 Coronal 부분. | |
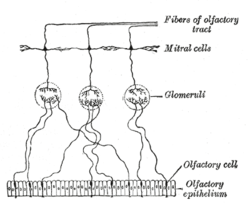 후각 신경 세포의 계획 | |
| 세부 사항 | |
| 시스템 | 냄새 |
| 위치 | 포유류의 후각구 |
| 식별자 | |
| NeuroEx ID | nifext_120 |
| 신경조영술의 해부학적 용어 | |
승모세포는 후각계의 일부인 뉴런이다. 그들은 포유류 중추신경계의 후각 전구에 위치한다. 그들은 후각수용체 뉴런의 축으로부터 정보를 받아 글로머룰리라고 불리는 신경질에서 시냅스를 형성한다. 승모세포의 액손은 피상피질, 엔토르히날피질, 편도체를 포함한 뇌의 여러 영역에 정보를 전달한다. 승모세포는 후각 감각 신경세포와 1차 덴드라이트의 외부 투프트 셀로부터 흥분 입력을 받는 반면, 억제 입력은 과립세포에서 횡방향의 덴드라이트와 소마에 또는 경피세포에서 발생한다. 승모세포와 tuft세포는 후각신경으로부터 들어오는 모든 후각정보에 대한 의무적인 중계기를 형성한다. 승모세포 출력은 후각신경의 입력에 대한 수동적인 반영이 아니다. 쥐에서, 각각의 승모판 후세포 감각 뉴런들 동일한 후각 수용체 단백질을 표현하는 인구에서 사구체를 받은 입력, 아직20-40 승모 상세포(자매 승모판 세포라고 불리는)[1]월의 동조 곡선과 동일하지 않다 단일 glomerulus 있어서 냄새 반응에 단일 1차 dendrite를 보낸다.e 입력 세포, 그리고 자매 승모 세포들 사이에서도 다르다.[2] 후각형 글로머러 모듈에서 개별 뉴런의 냄새 반응 특성. 승모세포가 입력으로 수행하는 정확한 처리 방식은 여전히 논란의 대상이다. 한 가지 두드러진 가설은 승모세포가 후각적 입력의 강도를 콧김 주기에 상대적인 발화 단계에 부호화한다는 것이다. 두 번째 가설은 후각 전구 네트워크가 시간이 지남에 따라 매우 유사한 냄새의 표현을 구별하기 위해 장식하는 역동적인 시스템 역할을 한다는 것이다. 두 번째 가설에 대한 지지는 주로 제브라피쉬(승모세포와 투피드 세포가 구별될 수 없는 곳)에 대한 연구로부터 온다.[3]
구조
승모세포는 포유류 후각구 속의 신경세포 타입으로, 전구의 승모세포 층에서 질서정연한 줄에 위치한 소마타의 위치에 의해 구별된다.[4] 그들은 전형적으로 1차 덴드라이트를 가지고 있는데, 이것은 글러머 층의 단일 글러머룰루스로 투영되며, 외부 플렉스iform 층에서 횡방향으로 투영되는 몇 개의 측면 덴드라이트를 가지고 있다. 승모세포는 튜프티드 세포로 알려진 포유류 전구에 있는 두 번째 유형의 투영 뉴런과 밀접한 관련이 있다. 하부 척추동물에서 승모세포와 투구세포는 형태학적으로 투구세포와 구별할 수 없으며, 이들의 형태학은 포유류 승모세포와 실질적으로 다르다. 세포들은 종종 서로 다른 글로머룰리를 내향적으로 만드는 여러 개의 1차 덴드라이트를 가지고 있으며 후각 전구 밖에서 투영되는 주요 신경 요소라는 것을 나타내기 위해 단순히 투영 뉴런이라고 불리기도 한다. 소마와 1차 덴드라이트는 후각 전구의 서로 다른 층에 자극성 전극을 적절히 배치함으로써 독자적으로 자극을 받을 수 있기 때문에 승모세포의 형태학은 시냅스 처리의 초기 연구에서 장점이었다.[5]
함수
시냅스 처리
승모세포는 후각 전구 마이크로 회로의 핵심 부분이다. 승모세포는 후각 감각 신경세포, 경막 신경세포, 외부 투피세포, 과립세포의 최소 4가지 세포 유형으로부터 입력을 받는다. 외부 튜프티드 세포와 후각 감각 신경세포에 의해 만들어진 시냅스는 흥분성이 있는 반면, 과립세포와 경막신경세포의 시냅스는 억제력이 있다. 또한 자매 승모세포는 격차접합에 의해 상호적으로 연결되어 있다. 과립에서 과립으로 승화시키는 것과 과립세포에서 승화시키는 것은 다소 비정상적인 역수성 덴드로덴드리트 시냅스(Axodendritic Synapse와는 대조적으로)에 대한 첫 번째 설명이었다. 전광석 마이크로 회로의 작용은 과학적으로 강도 높은 조사를 받고 있는 주제다. 어떤 원칙들이 나타나기 시작하고 있다. 한 발견은 적시에 승모세포와 패모세포의 출력을 분리하는 데 있어서 승모세포, 패모세포, 경막세포 사이의 마이크로 회로에 대한 생각을 지적한다.[6] 터프터 세포는 강한 후각 신경 입력을 받고,[7] 흡입에 가까운 화재와 그들의 발화 단계는 상대적으로 집중력이 둔한 반면, 승모세포는 상대적으로 약한 후각 신경 입력을[8] 받고 강한 경피세포 억제를 받아 터프터 세포에 비해 발화가 지연되는 것으로 보인다. 이러한 억제로부터의 탈출은 자극적인 냄새제 농도를 증가시킴으로써 가속될 수 있으며, 따라서 승모세포 발화 단계는 후각계가 농도를 암호화하는 한 가지 가능한 방법으로 작용한다. 승모세포 측면 덴드라이트와 과립세포 회로의 역할은 현재 조금 더 불확실하다. 하나의 가능한 가설은 시스템이 보다 효과적인 패턴 분리를 가능하게 하는 희박한 표현을 형성하는 것을 포함한다.[9] 이 회로의 작용은 단기 및 장기 가소성과 진행 중인 과립세포 신경생식에 의해 크게 영향을 받는다.[10] 이 회로는 동물이 완전한 기능을 갖추려면 깨어 있어야 한다.
투영 대상
승모세포와 투석세포는 뇌의 다양한 대상에 투영된다. 가장 중요한 것은, 투영법은 후각피질을 대상으로 하는데, 후각피질에서는 냄새 정보가 다른 감각 양식의 입력과 통합되어 행동을 유도하는 데 사용될 수 있다. 투프트 셀은 주로 전측 후각핵에 투영되는데, 이 중심은 좌측 후각 입력과 우측 후각 입력의 비교를 수행하기도 한다. 승모세포는 후각결핵에 투영되는데, 후각결핵에는 화학 정보가 청각 신호와 통합된다. 페로몬 입력을 운반하는 승모세포는 편도체와 시상하부에 투영해 본능적인 행동을 유도한다. 주요 통합 중심은 해적질 피질인데, 승모세포는 글루머룰리를 가로지르는 정보를 통합하는 피라미드형 세포에 비지상 투영법을 만든다. 투영도 엔토르히날 피질 쪽으로 간다. 승모세포 차축의 해부학적 연결은 대상 구조에 따라 상당히 다를 수 있다. 해적질 피질은 대부분 랜덤하게 내부 배열이 되는 반면, 전 후각핵과 편도체로 투영되는 것은 일부 지형적 질서를 유지한다. 마지막으로 승모세포 차축은 과립세포에 대한 과립막 내 연결도 만들고 마우스 후각계에서는 두 번째 입자상동맥동형(동일한 후각수용체를 밖으로 내보내는 것) 글루머룰루스 밑에 있는 과립세포에 선택적으로 투영한다.
참조
- ^ Dhawale, A (November 2010). "Non-redundant odor coding by sister mitral cells revealed by light addressable glomeruli in the mouse". Nat. Neurosci. 13 (11): 1404–12. doi:10.1038/nn.2673. PMC 3208311. PMID 20953197.
- ^ Kikuta, S (March 2013). "Odorant response properties of individual neurons in an olfactory glomerular module". Neuron. 77 (6): 1122–35. doi:10.1016/j.neuron.2013.01.022. PMC 3607817. PMID 23522047.
- ^ Friedrich, R (February 2001). "Dynamic optimization of odor representations by slow temporal patterning of mitral cell activity". Science. 291 (5505): 889–94. Bibcode:2001Sci...291..889F. doi:10.1126/science.291.5505.889. PMID 11157170.
- ^ Dryer, L.; Graziadei, P.P.C. (1994). "Mitral cell dendrites: A comparative approach". Anatomy and Embryology. 189 (2): 91–106. doi:10.1007/BF00185769. PMID 8010416.
- ^ Shepherd, Gordon M. (2004). The Synaptic Organization of the Brain. ISBN 9780195159561.
- ^ Fukunaga, Izumi; Berning, Manuel; Kollo, Mihaly; Schmaltz, Anja; Schaefer, Andreas T. (2012). "Two Distinct Channels of Olfactory Bulb Output". Neuron. 75 (2): 320–329. doi:10.1016/j.neuron.2012.05.017. PMID 22841316.
- ^ De Saint Jan, D.; Hirnet, D.; Westbrook, G. L.; Charpak, S. (2009). "External Tufted Cells Drive the Output of Olfactory Bulb Glomeruli". Journal of Neuroscience. 29 (7): 2043–2052. doi:10.1523/JNEUROSCI.5317-08.2009. PMC 6666334. PMID 19228958.
- ^ Gire, D. H.; Franks, K. M.; Zak, J. D.; Tanaka, K. F.; Whitesell, J. D.; Mulligan, A. A.; Hen, R.; Schoppa, N. E. (2012). "Mitral Cells in the Olfactory Bulb Are Mainly Excited through a Multistep Signaling Path". Journal of Neuroscience. 32 (9): 2964–2975. doi:10.1523/JNEUROSCI.5580-11.2012. PMC 3467005. PMID 22378870.
- ^ Koulakov, Alexei A.; Rinberg, Dmitry (2011). "Sparse Incomplete Representations: A Potential Role of Olfactory Granule Cells". Neuron. 72: 124–136. doi:10.1016/j.neuron.2011.07.031. PMC 3202217. PMID 21982374.
- ^ Kato, Hiroyuki K.; Chu, Monica W.; Isaacson, Jeffry S.; Komiyama, Takaki (2012). "Dynamic Sensory Representations in the Olfactory Bulb: Modulation by Wakefulness and Experience". Neuron. 76 (5): 962–975. doi:10.1016/j.neuron.2012.09.037. PMC 3523713. PMID 23217744.