나노셸
Nanoshell| 에 대한 일련의 기사의 일부 |
| 나노의학 |
|---|
| 참고 항목 |
나노셸, 아니 오히려 나노셸 플라스몬은 얇은 금속 껍질(보통 금)으로 덮여 있는 유전체 핵으로 구성된 구형 나노입자의 일종이다.[1] 이러한 나노셸은 모든 이온에 대하여 전자가 동시에 진동하는 집단 흥분 또는 양자 플라즈마 진동인 플라즈마라고 불리는 퀘이피자를 포함한다.
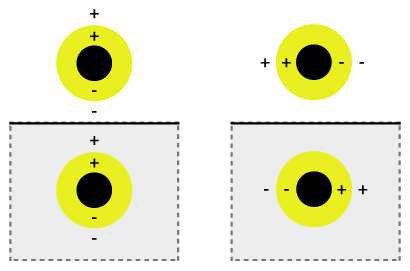
동시 진동은 플라스몬 혼합이라고 불릴 수 있는데, 여기서 진동의 튜닝성은 내부와 외부 셸의 혼합과 연관되어 더 낮은 에너지 또는 더 높은 에너지를 주기 위해 혼합된다. 이 낮은 에너지는 입사광에 강하게 결합하는 반면, 높은 에너지는 반결합이며 입사광에 약하게 결합된다. 잡종 상호작용은 얇은 쉘 층에 대해 더 강하기 때문에 쉘의 두께와 전체 입자 반경에 따라 어떤 파장과 결합하는지를 결정한다.[2] 나노셸은 가시광선 영역과 근접한 적외선 영역에 걸쳐 광범위한 광 스펙트럼에 걸쳐 변화할 수 있다. 빛과 나노 입자의 상호작용은 결합 강도에 영향을 미치는 전하 배치에 영향을 미친다. 기질에 평행한 입사광 편광은 s-극화(그림 1b)를 제공하므로 전하가 기질 표면에서 멀리 떨어져 있어 쉘과 코어 사이의 상호작용이 더 강하다. 그렇지 않으면 보다 강하게 이동된 플라스몬 에너지를 제공하여 상호작용과 결합이 약해진다.
디스커버리
나노셸의 발견은 2003년 라이스 대학교의 나오미 J. 할라스 교수와 그녀의 팀에 의해 이루어졌다. 그녀와 그녀의 팀이 나노셸을 발견했을 때, 그들은 처음에 그러한 나노셸이 어떤 잠재력을 가지고 있는지 확신하지 못했다. 할라스는 CNN과의 인터뷰에서 "우리는 '지, 그게 무슨 도움이 될까?'라고 말했다"고 말했다. 많은 제안이 있은 후, 암 치료는 다른 종류의 의약 용도를 찾는 생물공학자들과의 지속적인 협력에서 나왔다.[3] "우리의 비전 중 하나"라고 Halas는 말했다. "암에 대한 단 한 번의 방문 진단과 치료 못지 않게"[4] 2003년에 Halas는 나노테크놀로지 나우로부터 2003년 베스트 디스커버리 상을 받았다.[4]
생산
금 나노셸 합성을 위한 기술 방법의 상태는 마이크로유체 복합 폼의 사용이다. 이 방법은 플라스모닉 나노셸을 합성하는 표준 석판법을 대체할 가능성이 있다. 아래에 기술된 생산과정은 수한야 두라리스와미와 사이프 A가 수행한 실험이었다. 싱가포르 화학 및 생체 분자 공학부의 칸. 이 방법은 실험이었지만 나노셸 합성의 미래를 나타낸다.
The materials required for the production of the nanoshells are the following; Tetraethyl orthosilicate, ammonium hydroxide, hydroxylamine hydrochloride, 3-aminopropyl tris, hydrogentetrachloroaurate(III) trihydrate, tetrakis(hydroxymethyl) phosphonium chloride, sodium hydroxide, potassium carbonate, ethanol, Ultrapure water and glassware washed in 아쿠아 리지아, 그리고 물로 깨끗이 헹구었다.)[5]
이 방법으로 나노셸을 합성하는 첫 번째 단계는 내부에서 반응이 일어날 수 있는 장치를 만드는 것이다. 마이크로 유체 소자 패턴은 음의 광자극자 SU-8 2050을 이용한 표준 광석학술에 의해 실리콘 웨이퍼에 가공되었다. 이후 연질 석판기법을 이용해 폴리(디메틸실록산)(PDMS)로 기기를 성형했다.(40) 간단히 말하면 PDMS를 70℃에서 4시간 동안 SU-8 마스터에 성형해 껍질을 벗기고 잘라내고 세척했다. 인렛 및 아웃렛 구멍(1/16인치, O.D.)을 장치에 펀칭했다. 마이크로 채널은 35초의 짧은 공기 플라즈마 처리 후 PDMS의 얇은 층으로 미리 코팅된 유리 슬라이드에 불가역적으로 결합되었다. 마이크로 채널은 직사각형 단면을 가지며 가로 300μm, 깊이 155μm, 길이 0.45m이다.[5]
나노입자의 실제 생산은 '금실리카 입자와 금도금 용액이 혼합된 실리콘 오일'을 펌핑하고 질소 가스가 실린더에서 전달되는 동안 미세유체 장치에 대한 환원제 용액을 줄이는 것이다.[5] 그런 다음 도금 용액은 제어된 환경에서 24시간 이상 숙성되도록 방치했다. 노화 과정이 끝나면 미세유체장치에서 액체를 채취해 원심분리기에 넣는다. 그 결과로 생긴 액체는 표면에 기름 층을 가지고 있고 아래 용액은 나노셸을 함유하고 있다.
이 방법이 혁명적인 이유는 도금용액 농도뿐만 아니라 반응 허용 시간을 변경하여 금 나노셸의 크기와 상대적 두께를 조절할 수 있기 때문이다. 따라서 연구자들은 입자가 주어진 필요에 맞게 조절할 수 있다. 광학 치료나 암 치료는 그렇지만.
암치료
실리카 및/또는 지질 코어와[6] 금 껍질이 있는 구형 나노입자인 금박 나노입자는 암 치료와 생체 이미지 강화에 사용된다. 단일 치료에서 암을 검출하고 치료할 수 있는 항원성 탐침은 원하는 위치(일반적으로 암세포)에 부착할 수 있는 결합 부위가 있는 나노 입자로 이중 촬영장비 영상(x-ray 및 방사성핵종 영상을 사용하는 영상 전략)과 n을 통해 이미징할 수 있다.귀에 거슬리는 [7]형광 금 나노입자가 사용되는 이유는 크기와 기하학, 표면 플라스몬에 의해 제어되는 선명한 광학 특성 때문이다. 금 나노입자(AuNPs 등)는 생체적합성이 있고 여러 개의 다른 분자를 가질 수 있는 유연성, 그리고 껍질에 부착된 기본 물질(보통 금에 붙일 수 있는 거의 모든 것을 금 나노껍질에 부착할 수 있어 암을 확인하고 치료하는 데 도움을 줄 수 있다)이라는 장점이 있다. 암의 치료는 플라스모닉에 발생하는 산란과 흡수 때문에만 가능하다. 산란 상태에서 금 도금 나노 입자는 입자의 크기와 기하학적 구조에 따라 달라지는 정확한 파장에 맞춰진 영상 공정에서 볼 수 있게 된다. 흡수된 상태에서 광온절제가 일어나 나노입자와 그 주변부위를 암세포를 죽일 수 있는 온도로 가열한다. 이는 "물창" (800~1300nm의 스펙트럼 범위)의 활용으로 인해 체내 세포에 최소한의 손상을 입힌 상태에서 이루어진다.[1] 인간의 몸은 대부분 물이기 때문에, 이것은 사용된 빛과 영향을 최적화한다.
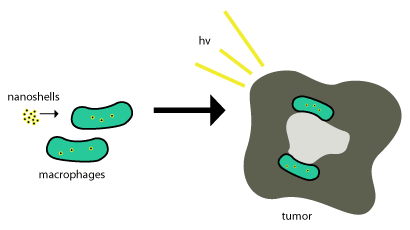
이 금 나노셸들은 세포막을 통해 나노셸을 집어삼켜서 내부 파고솜, 즉 대식세포가 형성되는 파고사이토시스(Pagosome)를 사용함으로써 종양으로 격리된다. 그 후에 그것은 세포로 폐쇄되고 효소는 보통 그것을 대사시키고 그것을 세포 밖으로 다시 순환시키는 데 사용된다. 이러한 나노셸은 대사되지 않기 때문에 효과적이기 위해서는 종양 세포 내에 있어야 하며, 종양 세포를 종식시키는 데 광 유도 세포 사망(위에서 설명한 바와 같이)이 사용된다. 이 계획은 그림 2에 나와 있다.
나노입자 기반 치료법은 나노 크기의 구조물을 항체의 도움 없이 수동적으로 종양으로 흡수할 수 있는 성질인 투과성 강화 및 보존 효과를 이용하여 종양에 성공적으로 전달되었다.[4] 종양의 중요한 부위에 나노셸을 전달하는 것은 매우 어려울 수 있다. 위 그림에서 보듯이 대부분의 나노셸이 종양의 자연적인 단세포 분만을 위해 모집하는 것을 이용하려고 하는 곳이다. 이 배달 체계는 "트로얀 말"이라고 불린다.[8]
이 과정은 종양이 ¾ 대식세포에 관한 것이고 일단 종양으로 단세포가 들어오면 대식세포로 구분되기 때문에 매우 잘 작동하는데, 이것은 또한 화물 나노입자를 유지해야 할 필요가 있을 것이다. 일단 나노셸이 괴사성 중심에 있게 되면 근적외선 조명을 사용하여 종양과 연관된 대식세포들을 파괴한다.
또한 이러한 나노입자는 광활성화 시 항이센스 DNA 올리고뉴클레오티드를 방출하기 위해 만들어질 수 있다. 이 올리고뉴클레오티드들은 유전자 치료를 수행하기 위해 광열 절제 치료와 함께 사용된다. 나노입자 콤플렉스가 세포 내부에서 전달된 뒤 표면에서 빛 유도 DNA 방출이 이뤄지기 때문이다. 이것은 세포의 내부 조작을 허용하고 그룹 세포가 평형으로 돌아가는 것을 감시하는 수단을 제공할 것이다.[9]
암 치료에서 나노셸 플라스모닉의 또 다른 예로는 나노입자 내부에 약물을 넣어 암 사이트에만 유독성 약물을 전달하는 차량으로 사용하는 것이 있다.[10] 이는 나노입자의 외부를 산화철(MRI 기계로 쉽게 추적할 수 있도록 허용)으로 코팅한 후, 일단 종양 부위가 약물이 채워진 나노입자로 코팅되면 공명 광파를 이용해 나노입자를 활성화해 약물을 방출할 수 있다.
참고 항목
참조
- ^ a b Loo, C; Lin, A; Hirsch, L; Lee, Mh; Barton, J; Halas, N; West, J; Drezek, R (February 2004). "Nanoshell-enabled photonics-based imaging and therapy of cancer". Technology in Cancer Research & Treatment. 3 (1): 33–40. doi:10.1177/153303460400300104. PMID 14750891. S2CID 17523671. Archived from the original (Free full text) on 23 October 2007. Retrieved 6 August 2009.
- ^ Brinson, Be; Lassiter, Jb; Levin, Cs; Bardhan, R; Mirin, N; Halas, Nj (November 2008). "Nanoshells Made Easy: Improving Au Layer Growth on Nanoparticle Surfaces". Langmuir. 24 (24): 14166–14171. doi:10.1021/la802049p. PMC 5922771. PMID 19360963.
- ^ CNN. "생물학: 나오미 할라스" CNN. 케이블 뉴스 네트워크, 2008년 3월 11일. 웹. 2012년 5월 7일. <http://edition.cnn.com/2007/TECH/science/06/11/halas.biog/>.
- ^ a b "최고의 발견" - 나노테크놀로지 최고 나노기술 지금 2008년 3월 29일. 웹. 2012년 5월 7일. <http://www.nanotech-now.com/2003-Awards/Best-Discoveries-2003.htm>.
- ^ a b c Duraiswamy, Suhanya; Khan, Saif (23 August 2010). "Plasmonic Nanoshell Synthesis in Microfluidic Composite Foams". Nano Letters. 9. 10 (9): 3757–3763. Bibcode:2010NanoL..10.3757D. doi:10.1021/nl102478q. PMID 20731386.
- ^ Abbasi, Akram; Park, Keunhan; Bose, Arijit; Bothun, Geoffrey D. (30 May 2017). "Near-Infrared Responsive Gold–Layersome Nanoshells". Langmuir. 33 (21): 5321–5327. doi:10.1021/acs.langmuir.7b01273. ISSN 0743-7463. PMID 28486807.
- ^ Bardhan, R; Grady, Nk; Halas, Nj (September 2008). "Nanoscale Control of Near-Infrared Fluorescence Enhancement Using Au Nanoshells". Nano Micro Small. 4 (10): 1716–1722. doi:10.1002/smll.200800405. PMID 18819167.
- ^ Choi, Mr; Stanton-Maxey, Kj; Stanley, Jk; Levin, Cs; Bardhan, R; Akin, D; Badve, S; Sturgis, J; Robinson, Jp; Bashir, R; Halas, Nj; Clare, Se (December 2007). "A cellular Trojan Horse for delivery of therapeutic nanoparticles into tumors". Nano Letters. 7 (12): 3759–65. Bibcode:2007NanoL...7.3759C. doi:10.1021/nl072209h. PMID 17979310.
- ^ Bardan, R; Lal, S; Joshi, A; Halas, Nj (May 2011). "Theranostic Nanoshells: From Probe Design to Imaging and Treatment of Cancer". Accounts of Chemical Research. 44 (10): 936–946. doi:10.1021/ar200023x. PMC 3888233. PMID 21612199.
- ^ "Nanoparticles Used To Target Brain Cancer -- ScienceDaily".