질산염 래디컬
Nitrate radical | |||
| | |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름 질산염 래디컬 | |||
| 체계적 IUPAC 이름 삼산화수소(•) | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 켐스파이더 | |||
| 1573 | |||
펍켐 CID | |||
| |||
| |||
| 특성. | |||
| NO3 | |||
| 어금질량 | 62.004 g·190−1 | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
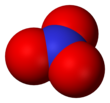
삼산화수소(•) 또는 질산염 라디칼은 질소 원자에 균일하게 결합된 세 개의 산소 원자로 구성된 공식 NO를
3 가진 질소의 산화물이다. 이 매우 불안정한 청색 화합물은 순수한 형태로 격리된 것이 아니라 기체, 액체 또는 고체 시스템의 단명 성분으로 생성되어 관측할 수 있다.[1]
이산화질소 NO처럼
2 과격(비장해된 발란스 전자를 가진 분자)으로 파라마그네틱으로 만든다. 질산 음이온 NO의−
3 무충전 상대물이며 과산화합물 과산화물 과산화물 과산화물 과산화물 과산화물 과산화물 과산화질소이다.[1]
삼산화질소는 오존 파괴를 포함한 대기 구성 요소들 간의 반응에서 중요한 매개물이다.[1][2]
역사
NO
3 라디컬의 존재는 1881년부터 1882년까지 하우트페유유와 채푸이스에 의해 가정되어 무성 전기 방전을 받는 공기의 흡수 스펙트럼을 설명하였다.[1]
구조 및 특성
중성 NO
3 분자는 3배 회전 대칭(대칭 그룹3h D) 또는 세 개의 Y자형 분자 사이의 공진일 가능성이 있는 평면 분자로 보인다.[1]
NO
3 래디컬은 물과 직접 반응하지 않으며, 고립된 원자와 다른 래디컬과는 반대로 닫힌 껍질 분자에 대해 상대적으로 반응하지 않는다. 특정 파장의 빛에 의해 산화질소 NO와 산소 O로
2 분해된다.[1]
NO의
3 흡수 스펙트럼은 약 500~680nm의 파장을 가진 광광대역을 가지며, 590, 662, 623nm에서 보이는 3개의 두드러진 피크가 있다. 640~680nm 범위에서 흡수는 분열을 유발하지 않고 형광(특히 604.4nm에서 흥분한 후 약 605~800nm, 661.8nm에서 흥분한 후 약 662~800nm에서 형광으로 이어진다.[1] 수용액에서는 약 330nm(초자외선)에서 또 다른 흡수대역이 나타난다. 흥분 상태 NO는*
3 595 nm 미만의 파장의 광자에 의해 달성될 수 있다.[1]
준비
삼산화질소는 이산화질소와 오존을 혼합하여 가스 단계에서 준비될 수 있다.[1]
- NO
2 + O
3 → NO
3 + O
2
이 반응은 고체상 또는 물 용액에서도 수행될 수 있으며, 냉동 가스 혼합물, 섬광 광분해 및 질산염과 질산 방사분해 및 기타 몇 가지 방법에 의해 수행될 수 있다.[1]
삼산화질소는 오산화질소인 오산화질소
2
5, 염소 질산 클로노
2, 과옥시니트산 호노와
2
2 그 염분의 광분해산물이다.[1]
- N2O5 → NO2 + NO3
- 2 ClOON2 → Cl2 + 2 NO3
참조
- ^ a b c d e f g h i j k R. P. 웨인, I. 반스, P. 빅스, J. P. 버로우스, C. 카노사-마스, J. Hjorth, G. Le Bras. G. K. Moortgat, D. 퍼너, G. 푸렛, G. 레스텔리, H. 사이드바텀(1991) : "질산염 과격파: 물리학, 화학, 그리고 대기"라고 말했다. 대기 환경. A부. 일반 주제. 제25권, 발행물 1, 1-203페이지. doi:10.1016/0960-1686(91)90192-A
- ^ 리처드 A. 그레이엄과 해롤드 S. 존스턴(1978년) : "질산염 과격의 광화학, 오산화질소-오존계통의 운동학" 물리 화학 저널, 제82권, 발행물 3, 254-268페이지. doi:10.1021/j100492a002