휴면전위
Resting potential상대적으로 정적인 멤브레인 전위로서, 일반적으로 전위 전압의 접지값이라고 한다.
대기 전지의 비교적 정적인 막 전위는 작용 전위와 등급이 매겨진 막 전위라고 불리는 특정한 동적 전기화학 현상에 반하여 휴식 막 전위(또는 정지 전압)라고 불린다.
흥분성 세포(신경, 근육 및 분비샘의 일부 분비 세포)에서 발생하는 후기 두 가지와는 별도로, 대부분의 비 흥분성 세포의 막 전압도 환경적 또는 세포 내 자극에 반응하여 변화를 겪을 수 있다. 휴면전위는 칼륨, 나트륨, 칼슘, 염화물의 막투과성 차이로 인해 존재하며, 이는 결국 다양한 이온 채널, 이온 전달기 및 교환기의 기능 활성에서 비롯된다. 일반적으로, 휴식막 전위는 동물과 식물 세포에서 비교적 안정된 투과전압의 접지값으로 정의될 수 있다.
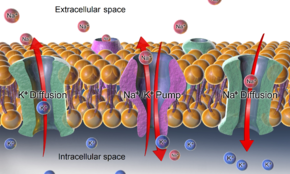
칼륨의 막 투과성은 다른 이온에 비해 훨씬 높기 때문에, 칼륨의 화학적 경사가 강하기 때문에, 칼륨 이온은 세포솔에서 양전하를 수행하는 세포외 공간으로 흘러들어, 막의 내부 표면에 음전하가 축적되어 움직임이 균형을 이루게 된다. 다시 말하지만, 칼륨에 대한 높은 상대적 투과성 때문에, 결과적인 막 전위는 거의 항상 칼륨 역전 전위에 가깝다. 그러나 이 과정이 일어나기 위해서는 먼저 칼륨 이온의 농도 구배를 설정해야 한다. 이 작업은 이온 펌프/트랜스포터 및/또는 교환기에 의해 수행되며 일반적으로 ATP에 의해 구동된다.
동물세포의 혈장막에 걸쳐 있는 휴식막 전위의 경우, 칼륨(및 나트륨) 그라데이션은 1 ATP 분자의 비용으로 칼륨 이온 2개와 나트륨 이온 3개를 외부로 운반하는 Na+/K-ATPase+(소듐-ATP)에 의해 확립된다. 다른 경우, 예를 들어, 막 전위는 막구획 내부의 산성화에 의해 확립될 수 있다(시냅스 베실막 전체에 걸쳐 막 전위를 생성하는 양성자 펌프 등).[citation needed]
일렉트로뉴탈리티
골드만 방정식의 도출과 같은 대부분의 멤브레인 전위 치료에서 전기적 우위성을 가정한다. 즉, 멤브레인 어느 쪽에서도 측정 가능한 전하 초과가 없다는 것이다. 따라서 전하 분리로 인해 막 전체에 걸쳐 전위가 존재하지만, 막 전체에 걸쳐 양과 음의 이온의 전지구적 농도에는 실제 측정 가능한 차이가 없다(아래로 추정한 바와 같이), 즉 어느 한 쪽에도 실제 측정 가능한 전하 초과가 없다. 그것은 전하의 전기화학 전위 효과가 농도의 효과보다 훨씬 크기 때문에 농도의 감지할 수 없는 변화는 전위성에 큰 변화를 일으키기 때문이다.[citation needed]
휴면전위 생성
세포막은 전형적으로 이온의 부분집합에만 침투할 수 있다. 여기에는 보통 칼륨 이온, 염화 이온, 중탄산염 이온 등이 포함된다. 휴식막 전위성의 이온적 기초에 대한 설명을 단순화하기 위해서는 처음에는 이온적 종을 하나만 고려하고, 나중에는 다른 종을 고려하는 것이 가장 유용하다. 전위 플라즈마-메브레인 전위는 거의 항상 칼륨 투과성에 의해 결정되기 때문에, 그것이 시작점이다.
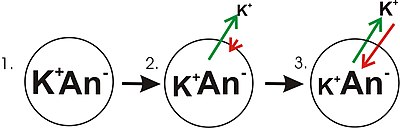
- 다이어그램의 패널 1은 농도 구배가 이미 설정된 단순 셀의 도표적 표현을 보여준다. 이 판넬은 마치 막이 어떤 이온에도 투과성이 없는 것처럼 그려진다. 칼륨의 농도 구배에도 불구하고 막 전체에 걸쳐 순전하 불균형이 없기 때문에 막전위가 없다. 만약 막이 막의 한쪽 면에 더 집중된 이온의 유형에 침투할 수 있게 된다면, 그 이온은 투과 이온의 그물 이동과 함께 막 사이를 가로질러 농도 구배를 따라 이동하기 때문에 막 전압에 기여할 것이다. 이온 농도가 높은 멤브레인 쪽에서 농도가 낮은 쪽으로 그물 이동이 있을 것이다. 이렇게 하나의 이온이 막 전체에 걸쳐 움직이면 막 전체에 걸친 순전하의 불균형과 막 전위가 발생할 수 있다. 이것은 많은 세포들이 막 전위를 설정하는 일반적인 메커니즘이다.
- 다이어그램의 2번 패널에서, 세포막은 칼륨 이온에 스며들 수 있도록 만들어졌지만, 세포 내부의 음이온(An−)은 그렇지 않다. 이러한 음이온은 대부분 단백질에 의해 기인한다. 칼륨 이온 농도 구배에는 저장된 에너지가 있어 칼륨(K+) 이온이 세포 밖으로 이동할 때 전기 구배로 변환할 수 있다. 칼륨 이온은 양방향으로 막을 가로질러 이동할 수 있지만, 셀 내부의 칼륨 이온의 농도가 높을수록 순수하게 통계적인 프로세스에 의해 셀 밖으로 더 많은 칼륨 이온이 이동하게 될 것이라는 점에 유의한다. 세포 내부에는 칼륨 이온의 농도가 높기 때문에 이들의 무작위 분자운동은 외부와 낮은 농도의 칼륨 이온에 해당하는 투과성 모공(이온 채널)에 부딪힐 가능성이 높다. 내부 K는+ 세포 밖의 K가+ 세포 안으로 들어가는 것보다 단순히 세포 밖으로 나갈 가능성이 더 높다. 농도 구배를 소멸시켜 일을 하는 것은 확산의 문제다. 칼륨이 세포에서 빠져나가면서 음이온을 남기고 있다. 따라서 K가+ 셀을 떠나면서 전하 분리가 발달하고 있다. 이 전하 분리는 투과전압(transembrane voltage를 생성한다. 이 투과전압은 막 전위다. 칼륨이 세포에서 계속 빠져나가면서 더 많은 전하를 분리하게 되면 막 전위는 계속 커질 것이다. 화살표의 길이(녹색은 농도 경사를, 적색은 전압을 나타냄)는 에너지의 각 형태로 인한 칼륨 이온 이동의 크기를 나타낸다. 화살표의 방향은 특정 힘이 가해지는 방향을 나타낸다. 그러므로 건물 막 전압은 칼륨 농도 구배를 따라 칼륨 이온의 순 이동 경향에 역행하는 증가하는 힘이다.
- 패널 3에서 멤브레인 전압은 "강도"가 이제 농도 구배와 일치할 정도로 커졌다. 이러한 힘(K에+ 적용되는 힘)은 이제 같은 강도로, 반대 방향으로 향하기 때문에, 시스템은 이제 평형 상태에 있다. 다른 방법으로 말하면, 칼륨이 농도 구배를 줄여서 세포를 떠나는 경향은 이제 칼륨 이온을 세포 안으로 다시 끌어당기려는 막전압의 경향과 일치한다. K는+ 계속해서 막을 가로질러 이동하지만, 세포에 들어가고 나오는 속도는 같기 때문에 순 칼륨 전류가 없다. K가+ 평형 상태기 때문에 막 전위는 안정적이거나 "휴식" (E)이다K.
휴면전압은 플라즈마 막에서 몇 개의 이온전송효소(유니퍼터, 코트랜스포터, 펌프)가 꾸준히 병렬로 작동한 결과로서, 각 이온전송기에 의해 a 내부의 특정 기질 농도에 따라 특징적인 기전력(=역전위 = '평형전위 전압')이 있다.nd 외부(일부 펌프의 경우 내부 ATP 포함). ATPase를 수출하는 H는+ 보다 광범위하게 조사된 동물 세포보다 식물과 곰팡이의 멤브레인 전압을 훨씬 더 음극으로 렌더링하며, 여기서 휴식 전압은 주로 선택적 이온 채널에 의해 결정된다.
대부분의 뉴런에서 휴식 전위는 약 -70mV의 값을 가진다. 휴식 전위는 대부분 세포막 양쪽에 있는 액체의 이온 농도와 세포막에 있는 이온 전달 단백질에 의해 결정된다. 이온의 농도와 막이 단백질을 운반하는 것이 휴식 전위의 값에 어떤 영향을 미치는지 아래에 요약되어 있다.
세포의 휴식 전위는 평형 전위라는 관점에서 생각해 보면 가장 철저하게 이해할 수 있다. 여기의 예시도를 보면, 모델 셀은 투과 이온(칼륨) 하나만 주어졌다. 이 경우, 이 세포의 휴식 전위는 칼륨의 평형 전위와 동일할 것이다.
그러나 실제 세포는 더 복잡하고, 많은 이온에 투과성을 가지며, 이온들은 각각 휴식 전위에 기여한다. 더 잘 이해하기 위해서는 투과성 이온, 칼륨, 나트륨이 두 개만 있는 세포를 생각해 보라. 이 두 이온이 반대 방향으로 향하는 농도 구배가 같고, 두 이온에 대한 막 투과도가 같은 경우를 생각해 보자. 세포에서 나오는 K는+ 막 전위를 E 쪽으로K 끌고 가는 경향이 있을 것이다. 세포에 들어가는 Na는+ 세포막 전위를Na E나트륨의 역전 전위 쪽으로 끌고 가는 경향이 있다. 두 이온에 대한 투과도가 같도록 설정되었기 때문에, 막 전위는 Na+/K+ 줄다리기가 끝날 때Na E와K E의 중간으로 끝나게 된다. E와Na E는K 같았지만 반대 기호의 절반은 0이므로 막이 0mV에서 정지한다는 뜻이다.
0mV에서 멤브레인 전위는 안정적이라 하더라도 기여 이온 중 어느 것도 평형 상태가 아니기 때문에 평형 상태가 아니라는 점에 유의한다. 이온은 이온 채널을 통해 전기화학적 그라데이션이 확산되지만, 이온 전달체를 통한 지속적인 K+ 유입과 Na+ 유출을 통해 막 전위가 유지된다. 동물 세포의 칼륨과 나트륨과 같이 반작용 이온에 대해 유사한 투과성을 가진 그러한 상황은 이온을 다시 펌프하는 데 많은 ATP 에너지가 필요하기 때문에 이러한 투과성이 상대적으로 크면 세포에 엄청난 비용이 들 수 있다. 어떤 실제 세포도 이와 동등하고 큰 이온 투과성을 휴식할 수 없기 때문에 동물 세포의 휴식 잠재력은 칼륨에 대한 높은 투과성을 지배적으로 고려하여 결정되며 나트륨 및 염화물 투과성과 구배를 변조하여 필요한 값으로 조정된다.
건강한 동물 세포에서 Na+ 투과성은 K 투과성의+ 약 5% 이하인 반면, 각각의 반전 잠재력은 나트륨(ENa)의 경우 +60mV이고 칼륨(EK)의 경우 -80mV이다. 따라서 막 전위는 E에서K 바로 나타나지 않고 E에서KK E와 E의Na 140mV 차이의 약 5%만큼 탈극화된다. 따라서, 셀의 휴식 잠재력은 약 -73mV가 될 것이다.
좀 더 형식적인 표기법에서 막 전위는 기여 이온의 평형 전위의 가중 평균이다. 각 무게의 크기는 각 이온의 상대 전도성이다. 정상적인 경우, 3개의 이온이 막 전위에 기여하는 경우:
- na^{}}}{^{+}}+{\ {
어디에
- E는m 막 전위(Volts)로 측정되는 막 전위
- E는X 이온 X의 평형 전위(볼트 단위)이다.
- gX/g는tot 치수가 없는 이온 X의 상대 전도성이다.
- g는tot 임의 단위로 모든 투과 이온의 총 전도율(예: 전기 전도율의 지멘스)이다. 이 경우 gK+ + gCl− + gNa+
막 전달 단백질
멤브레인 전위 결정을 위해 가장 중요한 두 가지 유형의 멤브레인 이온 전달 단백질은 이온 채널과 이온 전달 물질이다. 이온 채널 단백질은 이온이 대사 에너지의 직접적인 지출 없이 수동적으로 확산될 수 있는 세포막을 가로질러 경로를 만든다. 그들은 특정 이온에 대한 선택성을 가지고 있기 때문에 칼륨, 염화물, 나트륨 선택 이온 채널이 있다. 다른 세포와 한 세포의 다른 부분(덴드라이트, 세포체, 란비에의 노드)은 다양한 이온 전달 단백질의 양이 다를 것이다. 일반적으로 특정 칼륨 채널의 양은 휴식 전위 제어에 가장 중요하다(아래 참조). Na+/K+-ATPase와 같은 일부 이온 펌프는 전기유전성, 즉 세포막 전체에 걸쳐 전하 불균형을 생성하며 막 전위에도 직접 기여할 수 있다. 대부분의 펌프는 기능을 발휘하기 위해 대사 에너지(ATP)를 사용한다.
평형전위
대부분의 동물 세포에서 칼륨 이온(K+)은 휴식 전위에 가장 중요하다.[1] 칼륨 이온의 활발한 운반으로 인해 칼륨의 농도가 외부보다 세포 내부 농도가 높다. 대부분의 세포는 칼륨 선택 이온 채널 단백질을 가지고 있으며, 항상 열려 있다. 이러한 칼륨 채널을 통해 양전하 칼륨 이온의 순 이동으로 인해 셀 내부에 과도한 음전하가 축적될 것이다. 양전하 칼륨 이온의 바깥쪽 움직임은 무작위 분자 운동(디퓨전)에 기인하며 세포 내부에 충분한 양의 음전하가 축적되어 세포 내외부의 칼륨 농도 차이를 균형 있게 조절할 수 있는 막 전위를 형성할 때까지 계속된다. "균형"은 이온전하가 축적되어 외부 확산을 방해하는 전기력(잠재력)이 칼륨의 외부 확산 경향과 크기가 같을 때까지 증가하지만 반대 방향으로 증가하는 것을 의미한다. 이 균형점은 K의+ 순투과유속(또는 전류)이 0이기 때문에 평형전위다. 주어진 이온의 평형 전위에 대한 좋은 근사치는 막의 어느 한 쪽과 온도에서의 농도만 필요로 한다. 이 값은 네른스트 방정식을 사용하여 계산할 수 있다.
어디에
- E는eq,K+ 칼륨의 평형전위로서 볼트 단위로 측정된다.
- R은 8.314 줄·K−1·몰과−1 같은 범용 가스 상수다.
- T는 켈빈(=K = 섭씨 + 273) 단위로 측정한 절대 온도다.15)
- z는 반응에 관련된 해당 이온의 기본 전하 수입니다.
- F는 패러데이 상수로, 96,485 쿨롬브스·몰−1 또는 J·V−1·몰과−1 같다.
- [K+]o는 칼륨의 세포외 농도로, mol·mol−3·l로−1 측정한다.
- [K+]i도 마찬가지로 세포내 칼륨 농도다.
약 -80 밀리볼트(내부 음극)의 칼륨 평형 전위는 일반적이다. 차이점은 다른 종, 동일한 동물 내의 다른 조직, 그리고 다른 환경 조건 하에서 동일한 조직에서 관찰된다. 위의 네른스트 방정식을 적용하면 상대 K+ 농도 변화나 온도 차이로 이러한 차이를 설명할 수 있다.
일반적인 용도의 경우, 네른스트 방정식은 흔히 전형적인 인체 온도(37°C)를 가정하여 단순화된 형태로 주어지며, 상수를 줄이고 로그 베이스 10으로 전환한다.(농도에 사용되는 단위는 비율로 취소되기 때문에 중요하지 않다.) 정상 체온의 칼륨의 경우 밀리볼트 단위의 평형 전위를 다음과 같이 계산할 수 있다.
마찬가지로 정상 인체 온도에서 나트륨(Na+)에 대한 평형전위도 동일한 단순화된 상수를 사용하여 계산한다. 외부농도 [K+],o 10mM, 내부농도 [K+]i를 가정하여 E를 계산할 수 있다. 염화 이온(Cl−)의 경우 상수의 부호는 (-61.54mV) 반전되어야 한다. 칼슘(Ca2+)에 대한 평형전위를 계산할 경우 2+ 전하가 30.77mV로 단순 상수를 절반으로 나눈다. 상온에서 약 21 °C로 작업할 경우 계산된 상수는+ K와 Na의+ 경우 약 58 mV, Cl의− 경우 -58 mV, Ca의2+ 경우 29 mV이다. 생리적 온도 약 29.5°C와 생리학적 농도(이온마다 다름)에서 계산된 전위는 Na의+ 경우 약 67mV, K의+ 경우 -90mV, Cl의− 경우 -86mV, Ca의2+ 경우 123mV이다.
휴면전위
휴면막 전위는 유지보수를 위해 에너지의 지속적인 지출(위에서 언급한 이온 펌프에 대한)에 의존하기 때문에 평형 전위가 아니다. 이 메커니즘을 고려하는 것은 동적 확산 전위(균형 전위와는 달리)이다. 이는 고려 중인 시스템의 성격에 상관없이 사실이다. 휴면막 전위는 막을 가로지르는 전도성이 가장 큰 계통의 이온종이 지배한다. 대부분의 세포에서 이것은 칼륨이다. 칼륨은 또한 가장 음의 평형 전위를 가진 이온이기 때문에, 보통 휴식 전위는 칼륨 평형 전위보다 음이울 수 없다. 휴식 전위는 평형 전위에 대해 이온 농도를 사용하는 골드만-호지킨-카츠 전압 방정식으로 계산할 수 있으며, 각 이온종의 상대적 투과성도 포함할 수 있다. 정상 조건에서는 칼륨, 나트륨(Na+) 및 염화(Cl−) 이온만 휴식 전위에 큰 역할을 한다고 가정해도 무방하다.
이 방정식은 네른스트 방정식과 유사하지만, 각각의 투과 이온에 대한 항을 가지고 있다. 또한 z가 방정식에 삽입되어 K와+ Na에+ 비해 세포내 및 세포외 농도의 Cl이− 역전되어 염화물의 음전하가 로그항 내의 분수를 뒤집어서 처리되기 때문이다. *E는m 전위막이며, 전압 *R, T, F는 위와 같다 *P는s 이온s의 상대적 투과성 *[s]Y은 위와 같이 Y 구획의 이온s 농도다. 막의 투과성 대신 이온 채널의 전도성을 고려하여 막 전위를 보는 또 다른 방법은 밀만 방정식(현현행전도 방정식이라고도 함)을 사용하는 것이다.
또는 개조된
여기서 g는tot 임의 단위로 다시 모든 이온종의 결합된 전도성이다. 후자 방정식은 체중이 각 이온종(gX/gtot)의 상대 전도율인 시스템의 반전 전위에 대한 가중 평균으로 휴식막 전위를 나타낸다. 작용 가능성 동안, 이러한 무게는 변한다. Na와+ Cl의− 전도성이 0이면, 막 전위는 K에+ 대한 네른스트 전위(gK+ = gtot)까지 감소한다. 일반적으로 휴식 조건에서 g와Na+ g는Cl− 0이 아니지만, g보다K+ 훨씬 작아서m E가eq,K+ E에 가깝게 된다. 혈청 칼륨([K+]o을 지배하는 혈청 칼륨)이 변화되는 고칼륨과 같은 의학적 조건은 E를eq,K+ 상쇄하기 때문에 매우 위험하므로 E에m 영향을 미친다. 이것은 부정맥과 심장 마비를 일으킬 수 있다. 치사 주사에 의한 처형에 있어서 염화칼륨의 볼러스 주사를 사용하는 것은 휴식 전위를 보다 양의 값으로 이동시켜 심장을 멈추게 하는데, 이것은 심장 세포를 영구적으로 탈극화시키고 수축시켜 심장이 다시 분극화되지 못하게 하여 디아스톨로 들어가 혈액을 재충전하게 한다.
GHK 전압방정식과 밀먼의 방정식이 연관되어 있지만 등가성이 없다. 임계 차이는 밀만의 방정식이 전류 전압 관계를 허혈로 가정하는 반면, GHK 전압 방정식은 이온의 농도 구배에 의해 발생하는 GHK 플럭스 방정식에 의해 예측된 작고 순간적인 정류를 고려한다는 것이다. 따라서, 멤브레인 전위의 더 정확한 추정치는 밀먼 방정식보다 GHK 방정식을 사용하여 계산할 수 있다.[2]
휴면 전위 측정
일부 세포에서는 막 전위가 항상 변화하고 있다(심장박동조율기 세포 등). 그러한 세포에는 결코 "휴식"이 없으며 "휴식 잠재력"은 이론적인 개념이다. 시간에 따라 변하는 멤브레인 이동 기능의 방해가 거의 없는 다른 셀은 전극을 셀에 삽입하여 측정할 수 있는 휴식형 멤브레인 전위를 가지고 있다.[3] 투과 전위는 또한 막 전위에 따라 광학적 특성을 바꾸는 염료를 사용하여 광학적으로 측정할 수 있다.
다양한 유형의 셀에서 휴식 전위값 요약
| 세포유형 | 휴면전위 |
|---|---|
| 골격근세포 | -95mV[4] |
| 아스트로글리아 | -80 ~ -90mV |
| 뉴런 | -60 ~ -70mV[5] |
| 평활근세포 | -60mV |
| 대동맥 매끄러운 근육 조직 | -45mV[5] |
| 광수용체세포 | -40mV |
| 모발세포(코클레아) | -15 ~ -40mV[6] |
| 에리스트로시테스 | -8.4mV[7] |
| 콘드로시테스 | -8mV[5] |
역사
신경 속의 휴식 전류는 1902년 율리우스 번스타인이 측정해 설명했는데, 여기서 그는 신경과 근육의 휴식 잠재력을 확산 전위로 설명하는 '메브레인 이론'을 제안했다.[8]
참고 항목
참조
- ^ 휴식 잠재력에 대한 K의+ 중요성을 입증하기 위한 전기생리학적 실험의 예. K의+ 세포외 농도에 대한 잠재력의 의존성은 데일 퍼브스, 조지 J. 어거스틴, 데이비드 피츠패트릭, 로렌스 C에 의해 제2판 신경과학 그림 2.6에 나타나 있다. 캣츠, 앤서니-사무엘 라만티아, 제임스 O 맥나마라, S. 마크 윌리엄스 선덜랜드 (MA): 시나워 어소시에이트, 주식회사; 2001.
- ^ 힐, 버틸(2001) 흥분성 막의 이온 채널, 3 ed.
- ^ 전극으로 멤브레인 전위 측정의 예시는 데일 퍼브스(Dale Purves) 등의 Neurocience 그림 2.1에 있다(위의 참조 #1, 참조).
- ^ "Muscles". users.rcn.com. 2015-01-24. Archived from the original on 2015-11-07. Retrieved 2016-06-01.
- ^ a b c Lewis, Rebecca; Asplin, Katie E.; Bruce, Gareth; Dart, Caroline; Mobasheri, Ali; Barrett-Jolley, Richard (2011-11-01). "The role of the membrane potential in chondrocyte volume regulation". Journal of Cellular Physiology. 226 (11): 2979–2986. doi:10.1002/jcp.22646. ISSN 1097-4652. PMC 3229839. PMID 21328349.
- ^ Ashmore, J. F.; Meech, R. W. (1986-07-24). "Ionic basis of membrane potential in outer hair cells of guinea pig cochlea". Nature. 322 (6077): 368–371. Bibcode:1986Natur.322..368A. doi:10.1038/322368a0. PMID 2426595. S2CID 4371640.
- ^ Cheng, K; Haspel, HC; Vallano, ML; Osotimehin, B; Sonenberg, M (1980). "Measurement of membrane potentials (psi) of erythrocytes and white adipocytes by the accumulation of triphenylmethylphosphonium cation". J. Membr. Biol. 56 (3): 191–201. doi:10.1007/bf01869476. PMID 6779011. S2CID 19693916.
- ^ Seyfarth, Ernst-August (2006-01-01). "Julius Bernstein (1839-1917): pioneer neurobiologist and biophysicist". Biological Cybernetics. 94 (1): 2–8. doi:10.1007/s00422-005-0031-y. ISSN 0340-1200. PMID 16341542. S2CID 2842501.
외부 링크
- 신경과학 - Purves 등의 온라인 교과서
- 기본 신경 화학 분자, 세포 및 의학 측면 시겔 등.
- Bertil Hille Ion 채널의 흥분성 막, 3edd, Sinauer Associates, Sunderland, MA(2001). ISBN 0-87893-321-2
- Wright, SH (2004). "Generation of resting membrane potential". Adv Physiol Educ. 28 (1–4): 139–42. doi:10.1152/advan.00029.2004. PMID 15545342. S2CID 5009629.
- 휴면막 잠재력 - 휴면막 잠재력에 대한 온라인 강의 노트
- 휴면막전위 원점 - 온라인 대화형 튜토리얼

![E_{eq,K^+} = \frac{RT}{zF} \ln \frac{[K^+]_{o}}{[K^+]_{i}} ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7eb1afcc5d7a5032ff24be5c403b43b1307b01e)
![E_{{eq,K^{+}}}=61.54mV\log {\frac {[K^{+}]_{{o}}}{[K^{+}]_{{i}}}},](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d0b62ffda044574b1a52306113028c6a29c89f2)
![E_{{m}}={\frac {RT}{F}}\ln {\left({\frac {P_{{Na^{+}}}[Na^{+}]_{{o}}+P_{{K^{+}}}[K^{+}]_{{o}}+P_{{Cl^{-}}}[Cl^{-}]_{{i}}}{P_{{Na^{+}}}[Na^{+}]_{{i}}+P_{{K^{+}}}[K^{+}]_{{i}}+P_{{Cl^{-}}}[Cl^{-}]_{{o}}}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aef443116c02ee0a29c6f4d6f5a5fc571e530ec8)




