로빈슨 애닝
Robinson annulation
| 로빈슨 애닝 | |
|---|---|
| 이름을 따서 명명됨 | 로버트 로빈슨 |
| 반응형 | 링 형성 반응 |
| 식별자 | |
| 유기화학포털 | 로빈슨식 결혼 |
| RSC 온톨로지 ID | RXNO:0000380 |
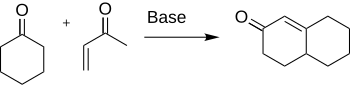
로빈슨 연고는 고리 형성을 위해 유기 화학에 사용되는 화학 반응이다. 1935년 로버트 로빈슨(Robert Robinson)에 의해 탄소-탄소 결합 3개를 새로 만들어 6개의 막으로 된 고리를 만드는 방법으로 발견되었다.[1] 이 방법은 케톤과 메틸비닐케톤을 사용하여 시클로헥산 링에서 마이클 추가에 따른 α,β-불포화 케톤을 형성한 뒤 알돌 응결한다. 이 절차는 퓨전 링 시스템을 형성하는 주요 방법 중 하나이다.
시클로헥세논과 파생상품의 형성은 많은 천연물과 항생제와 스테로이드와 같은 다른 흥미로운 유기 화합물의 합성에 적용하기 위해 화학에서 중요하다.[2] 구체적으로, 코티손 합성은 로빈슨 공정을 이용하여 완성된다.[3]
로빈슨 연감에 대한 초기 논문은 랍슨이 로빈슨 교수와 함께 옥스포드에서 공부하는 동안 윌리엄 랩슨과 로버트 로빈슨에 의해 발표되었다. 작업 전 사이클로헥세논 합성물은 α,β-불포화 케톤 성분에서 파생되지 않았다. 초기 접근법은 메틸비닐케톤과 나프톨을 결합시켜 나프톨라산화물을 주었지만, 이 절차로는 원하는 사이클로헥세논을 형성하기에는 역부족이었다. 이것은 반응의 부적합한 조건 때문이다.[1]
로빈슨과 랩슨은 1935년에 사이클로헥사논과 α, β-불포화 케톤 사이의 상호작용이 원하는 사이클로헥세논을 공급한다는 것을 발견했다. 그것은 6개의 멤브레인 링 화합물을 만드는 핵심 방법 중 하나로 남아 있다. 매우 널리 사용되고 있기 때문에, 범위와 변동 부분에서 논의한 기판 및 반응 조건의 변화 등, 지금까지 조사되어 온 반응의 많은 측면이 있다.[4] 로버트 로빈슨은 알칼로이드 연구에 기여한 공로로 1947년 노벨 화학상을 수상했다.[5]
반응 메커니즘
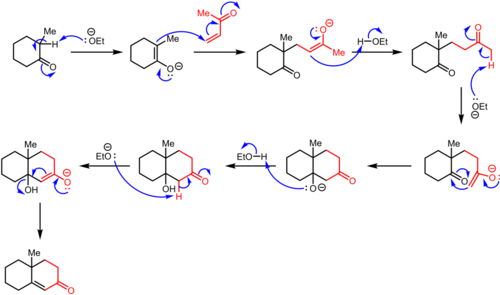
로빈슨 연조의 원래 절차는 중간 마이클 어덕트를 생산하기 위해 비닐 케톤에 대한 마이클 반응에서 케톤이 핵포화 공격을 하는 것으로 시작된다. 이후 알돌 타입의 링 클로저는 케토 알코올로 이어지며, 이후 탈수 작용이 일어나 연환 제품을 생산한다.
마이클 반응에서 케톤은 기지에 의해 감압되어 전자 수용체(빨간색)를 공격하는 에놀레이트 핵소자를 형성한다. 이 수용기는 일반적으로 α,β-불포화 케톤이지만 알데히드, 산성 유도체 및 유사한 화합물도 작동할 수 있다(범위 참조). 여기에 표시된 예에서, 섭열성은 열역학적 에놀레이트 형성에 의해 결정된다. 또는 카르보닐 그룹에 의해 측면에 있는 탄소에서의 감응이 강하게 선호되기 때문에 역행성은 에놀레이트 성분으로 β-디케톤 또는 β-케토에스터를 사용하여 제어되는 경우가 많다. 그리고 나서 근육내 알돌 응결은 6mb의 링을 설치하는 방식으로 일어난다. 최종 제품에서는 α,β-불포화계통의 탄소원자 3개와 그 카보닐 그룹에 대한 탄소 α가 새로 설치된 링의 4탄소 다리를 이룬다.
원래 에놀레이트(Enolate)와 사이클로헥세논(Cylochexenone) 제품 사이의 반응을 피하기 위해 초기 마이클 애덕트를 먼저 분리시킨 다음 사이클링하여 별도의 단계로 원하는 옥타널을 주는 경우가 많다.[6]
입체화학
로빈슨 연감 반응 체계에서 히드록시 케톤 형성에 관한 연구가 완료되었다. 트랜스 화합물은 운동학적 제어 반응에서 최종 알돌 응결로 인한 반페리플라나 효과 때문에 선호된다. 사이클화가 싱클리널 방향으로 진행될 수 있다는 사실도 밝혀졌다. 아래 그림은 의자 전환 상태를 가정하여 가능한 3가지 입체 화학적 경로를 보여준다.[7]
이러한 전환 상태와 그에 상응하는 제품의 형성의 차이는 용매 상호작용에 기인한다고 가정되어 왔다. Scanio는 위의 D단계에서 반응 용제를 다이옥산에서 DMSO로 변경하면 다른 입체화학이 나타난다는 것을 발견했다. 이는 양성 용제 또는 비독성 용제의 존재는 서로 다른 전환 상태를 발생시킨다는 것을 시사한다.[8]
기계론적 분류
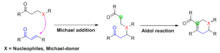
로빈슨 애널링은 마이클 덧셈과 알돌 반응을 순차적으로 하나의 반응으로 결합하는 탠덤 마이클돌 반응이라고 불리는 보다 광범위한 화학적 변형의 한 가지 주목할 만한 예다. 로빈슨 애닝의 경우와 마찬가지로, 마이클 추가는 보통 두 반응제를 함께 묶기 위해 먼저 발생하며, 그 후 알돌 반응이 분자 내 진행되어 제품에 링 시스템을 발생시킨다. 보통 5-6mb의 링이 생성된다.
범위 및 변동
반응 조건
로빈슨 연감은 일반적으로 기본적인 조건에서 행해지지만, 반응은 다양한 조건에서 행해져 왔다. 히스콕과 엘리스는 황산을 사용한 염기성 분석 방법과 유사한 결과를 보고한다.[2] 마이클 반응은 에나민을 통해 중립적인 조건에서 발생할 수 있다. 만니치 베이스는 케톤이 있는 곳에서 가열하여 마이클 어덕트를 생산할 수 있다.[6] 로빈슨 연산법을 이용한 화합물의 성공적인 준비가 보고되었다.[9]
마이클 수용자
전형적인 마이클 수용자는 α,β-불포화 케톤이지만 알데히드와 산성 유도체도 작용한다. 또한, 질산염, 니트로 화합물, 설폰, 특정 탄화수소와 같은 기증자를 수용자로 사용할 수 있다고 베르그만 등이 보고하고 있다.[10] 전반적으로 마이클 수용자는 EWG가 표시된 것처럼 사이아노, 케토 또는 에스테르와 같은 전자 인출 그룹을 가리키는 아래 표시된 것과 같이 일반적으로 활성화 올레핀이다.
위크테를 반응
위체렐 반응(Wichterle reaction)은 메틸 비닐케톤을 1,3-디클로로-cis-2-butene으로 대체하는 로빈슨 환락의 변형이다. 이것은 전형적인 α,β-불포화 케톤과는 다른 마이클 수용체를 사용하는 예를 제시한다. 1,3-디클로로-cis-2-부틴은 Michael 추가 시 바람직하지 않은 중합이나 응결을 피하기 위해 사용된다.[11]
하우저 어닝
관련 하우저 연산의 반응 순서는 Dieckmann 응축에 이은 Michael 덧셈이고 최종적으로 제거된다. 디크만 응결은 β-케토스터를 제공하기 위해 기저부를 가진 디에이터의 분자 내 화학반응을 닫는 것과 유사한 링이다. 하우저 기증자는 오르토 위치에 카복실릭 에스테르 그룹이 있는 방향족 황폰 또는 황산화메틸렌이다. 하우저 수용자는 마이클 수용자다. 원본 하우저 출판물에서 에틸 2-카복시벤질 페닐 황산화수소는 -78°C에서 THF의 베이스로서 LDA와 함께 펜트-3-ene-2-1과 반응한다.[12]
비대칭 로빈슨 어닝
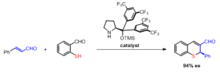
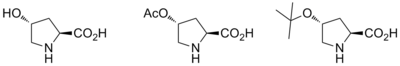
로빈슨 경매 제품의 비대칭 합성에는 대부분 프롤라인 촉매의 사용이 포함된다. 연구는 로빈슨 연소 반응의 두 단계 동안 촉매로 사용하기 위해 L-프로라인과 몇몇 다른 키랄 아민의 사용을 보고한다.[13] 광학 활성 프롤라인 카탈루션을 사용할 때의 이점은 항산화제 초과가 60~70%[14]인 입체적이라는 것이다.
왕 외 연구진은 그러한 조직 분석적인 로빈슨 연기에 의한 치랄 티오크로메네스의 원팟 합성을 보고했다.[15]
합성에 응용 프로그램
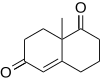
비엘랜드-미셔 케톤은 2메틸-사이클로헥산-1,3디온과 메틸비닐케톤이 함유된 로빈슨 애널링 제품이다. 이 화합물은 중요한 생물학적 성질을 가진 많은 스테로이드의 합성물에 사용되며 프롤라인 촉매제를 사용하여 항산화 작용을 일으킬 수 있다.[14]
F. Dean Toste와 동료들은[16] 아세틸콜린 에스테라아제를 억제하는 데 잠재적으로 응용할 수 있는 4회성 리코포듐 알칼로이드인 (+-fawcettimine)의 총합성에 로빈슨 연고를 사용하였다.
플라텐시마이신까지 항항체성 경로
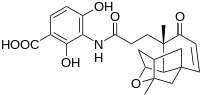
머크의 과학자들은 플라텐시마이신이라는 새로운 항생제 납 화합물을 발견했는데, 이 화합물은 인접한 사진에서 볼 수 있는 잠재적인 약용 응용이다.[17]
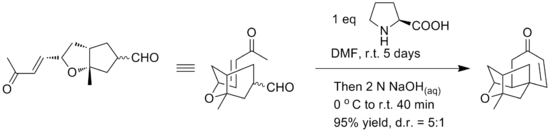
초기 합성은 알코올 모티브와 이중 결합의 분자 내 에스테리피케이션 반응을 이용한 경혈적 형태의 화합물을 제공했다. 야마모토와 동료들은 플라텐시마이신의 4회성 순환 코어의 직접적인 항저항적 합성을 제공하기 위해 대체 근육내 로빈슨 연고를 사용했다고 보고한다. 핵심 로빈슨 어닝 단계는 키랄 제어를 위한 L-프로라인을 이용하여 하나의 항아리에서 이루어진다고 보고되었다. 반응 조건은 아래에서 확인할 수 있다.[18]
참조
- ^ a b Rapson, William Sage; Robinson, Robert (1935). "307. Experiments on the synthesis of substances related to the sterols. Part II. A new general method for the synthesis of substituted cyclohexenones". Journal of the Chemical Society (Resumed): 1285. doi:10.1039/JR9350001285.
- ^ a b Heathcock, Clayton H.; Ellis, John E.; McMurry, John E.; Coppolino, Anthony (1971). "Acid-catalyzed Robinson Annelations". Tetrahedron Letters. 12 (52): 4995–96. doi:10.1016/s0040-4039(01)97609-9.
- ^ Acheson, R. M.; Robinson, Robert (1952). "198. Experiments bearing on the synthesis of cortisone. Part I. Some cyclopentenone derivatives". Journal of the Chemical Society (Resumed): 1127. doi:10.1039/JR9520001127.
- ^ Ho, Tse-Lok (1992). Tandem organic reactions. New York: Wiley. ISBN 978-0-471-57022-6.
- ^ McMurry, John (2008). Organic chemistry (7th ed.). Belmont, CA: Thomson Brooks/Cole. ISBN 978-0-495-11258-7.
- ^ a b Gawley, Robert E. (1976). "The Robinson Annelation and Related Reactions". Synthesis. 1976 (12): 777–794. doi:10.1055/s-1976-24200.
- ^ Nussbaumer, Cornelius (1990). "Stereochemistry of the Robinson Anellation: Studies on the Mode of Formation of the Intermediate Hydroxy Ketones". Helvetica Chimica Acta. 73 (6): 1621–1636. doi:10.1002/hlca.19900730607.
- ^ Scanio, Charles J. V.; Starrett, Richmond M. (1971). "Remarkably stereoselective Robinson annulation reaction". Journal of the American Chemical Society. 93 (6): 1539–1540. doi:10.1021/ja00735a059.
- ^ Buchschacher, Paul; A. Fürst; J. Gutzwiller (1985). "(S)-8a-Methyl-3,4,8,8a-Tetrahydro-1,6(2H, 7H)- Napthalenedione" (PDF). Organic Syntheses. 63: 37. doi:10.15227/orgsyn.063.0037. Archived from the original (PDF) on 24 April 2012.
- ^ Adams, Roger (1959). Organic Reactions. New York: John Wiley & Sons, Inc. pp. 179–555. ISBN 978-0471007593.
- ^ Wang, Zerong (2009). "Wichterle Reaction". Comprehensive organic name reactions and reagents. Hoboken, N.J.: John Wiley. doi:10.1002/9780470638859.conrr669. ISBN 978-0-470-63885-9.
- ^ Hauser, Frank M.; Rhee, Richard P. (1978). "New synthetic methods for the regioselective annelation of aromatic rings: 1-hydroxy-2,3-disubstituted naphthalenes and 1,4-dihydroxy-2,3-disubstituted naphthalenes". The Journal of Organic Chemistry. 43 (1): 178–180. doi:10.1021/jo00395a048.
- ^ Eder, Ulrich; Sauer, Gerhard; Wiechert, Rudolf (1971). "New Type of Asymmetric Cyclization to Optically Active Steroid CD Partial Structures". Angewandte Chemie International Edition in English. 10 (7): 496–497. doi:10.1002/anie.197104961.
- ^ a b Bui, Tommy; Barbas, Carlos F (2000). "A proline-catalyzed asymmetric Robinson annulation reaction". Tetrahedron Letters. 41 (36): 6951–6954. doi:10.1016/s0040-4039(00)01180-1.
- ^ 왕, 리, H; 왕, J; 주, L, J. 암. 화학, 2006년 128, 10354
- ^ Linghu, X.; Kenedy-Smith, J. J.; Toste, F. D. (2007). "Total Synthesis of (+)-Fawcettimine". Angew. Chem. Int. Ed. 46 (40): 7671–3. doi:10.1002/anie.200702695. PMID 17729226.
- ^ Wang, Jun; Soisson, Stephen M.; Singh, Sheo; et al. (2006). "Platensimycin is a selective FabF inhibitor with potent antibiotic properties". Nature. 441 (7091): 358–61. Bibcode:2006Natur.441..358W. doi:10.1038/nature04784. PMID 16710421. S2CID 4329677. Retrieved 9 September 2021.
- ^ Li, Pingfan; Payette, Joshua N.; Yamamoto, Hisashi (2007). "Enantioselective Route to Platensimycin: An Intramolecular Robinson Annulation Approach". Journal of the American Chemical Society. 129 (31): 9534–9535. doi:10.1021/ja073547n. PMC 2553032. PMID 17630748.