시냅스 태깅
Synaptic tagging시냅스 태깅 또는 시냅스 태깅 가설은 1997년 Uwe Frey와 Richard G. Morris에 의해 처음 제안되었다. 이것은 특정 시냅스에서의 신경 신호가 지속적인 LTP와 LTD에 필수적인 후속 가소성 관련 제품(PRP) 교통의 표적을 만드는 방법을 설명하고자 한다.태그의 분자 정체성은 아직 알려지지 않았지만, 고주파 또는 저주파 자극의 결과로 형성되고, 들어오는 PRP와 상호작용하며,[1] 제한된 수명을 갖는 것으로 확인되었다.
가소성 관련 제품에는 mRNA와 소마 및 수지상 샤프트의 단백질이 포함되며, 이는 영구적인 LTP 및 LTD를 달성하기 위해 수지상 척추 내의 분자에 의해 포착되어야 한다.이 생각은 시냅스 태그 앤 캡쳐 가설에서 명확하게 표현되었다.전반적으로, 시냅스 태깅은 L-LTP가 생성되는 방법의 분자적 토대를 정교하게 하고 기억 형성을 이끈다.
역사
라이프니츠 신경생물학 연구소의 프레이와 [2]에든버러 대학의 모리스는 시냅스 태깅 가설의 토대를 마련하며 다음과 같이 말했다.
"우리는 LTP가 LTP를 확립하기 위해 관련 단백질을 시퀀싱하는 증강 시냅스에서 단백질 합성에 의존하지 않는 단기간의 '시냅스 태그' 생성을 시작할 것을 제안한다.이 아이디어를 뒷받침하여, 우리는 반복적인 테타닉화가 동일한 뉴런 모집단에 이미 적용되었다면, 일반적으로 초기 LTP 또는 단백질 합성 억제제의 존재 하에서 반복적인 테타닉 자극이 각각 단백질 합성 의존적인 후기 LTP를 초래한다는 것을 보여준다.시냅스 태그는 3시간 이내에 소실됩니다.이러한 연구결과는 LTP의 지속성이 유도 과정에서의 국소적인 사건뿐만 아니라 [2]뉴런의 이전 활동에도 좌우된다는 것을 보여준다."
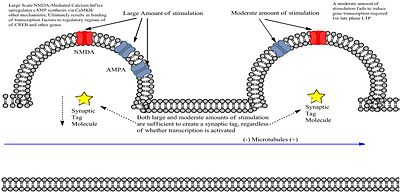
L-LTP 유도 자극은 시냅스를 자극받은 것으로 식별하는 수지상 생물학적 태그와 새로운 mRNA와 단백질(가소성 생성물)[3]을 생성하는 게놈 캐스케이드를 포함한 두 가지 독립적인 과정을 유도한다.약한 자극은 시냅스에도 태그를 붙이지만 캐스케이드를 생성하지는 않습니다.캐스케이드에서 생성된 단백질은 최근에 태그된 시냅스에 부착된다는 점에서 특징적으로 문란하다.하지만 프레이와 모리스가 발견했듯이, 이 태그는 일시적인 것이며 만약 포획을 위해 단백질이 나타나지 않는다면 사라질 것이다.따라서 고주파 자극에 의해 L-LTP가 유도되는 경우에는 태그와 단백질의 생산이 중복되어야 한다.
Frey와 Morris에 의해 수행된 실험은 CA1 [3]세포의 동일한 집단에서 합성된 두 세트의 다른 섀퍼 측부 섬유들의 자극을 포함했다.그런 다음 그들은 자극의 강도에 기초하여 동일한 뉴런 내의 다른 시냅스에서 E-LTP와 L-LTP를 생성하기 위해 S1 또는 S2 경로에서 각 자극과 관련된 필드 EPSP를 기록했다.그 결과 1) 약한 자극에 의해 생성된 E-LTP는 강한 S2 자극이 전달될 경우 L-LTP로 바뀔 수 있으며 2) 두 자극 사이의 간격이 증가함에 따라 E-LTP를 L-LTP로 변환하는 능력이 감소하여 시간 의존성을 생성하였다.강한 S2 자극을 전달하기 전에 단백질 합성을 차단하면 L-LTP로의 전환이 방지되어 게놈 캐스케이드에 의해 생성된 mRNA의 번역이 중요함을 보여주었다.
후속 연구는 후기 LTP와 LTD 사이의 연관성을 포함하는 시냅스 태깅의 추가 특성을 확인했다.이 현상은 2004년 사직쿠마르와 프레이에 의해 처음 확인되었으며 현재는 "크로스 태그"[4]라고 불립니다.그것은 독립적인 시냅스 입력 세트에서 유도된 LTP와 LTD 사이의 후기 연관 상호작용을 포함한다. 시냅스 입력 세트에서 유도된 후기 LTP는 다른 입력 세트에서 초기 LTD를 후기 LTD로 변환할 수 있다.반대의 효과도 발생한다.첫 번째 시냅스에서 유도된 초기 LTP는 독립 시냅스에서 LTD 유도 자극이 뒤따르면 후기 LTP로 변환될 수 있다.이러한 현상은 첫 번째 시냅스에서 후기 LTP 또는 -LTd에 의한 비특이적 가소성 관련 단백질(PRP)의 합성이 시냅스 태그가 설정된 후 두 번째 시냅스에서 초기 LTD/LTP를 후기 LTD/LTP로 변환하기에 충분하기 때문이다.
블리처와 그의 연구팀은 2005년에 시냅스 태그에 의해 포착된 단백질은 실제로 수상돌기에 [3]위치한 mRNA에서 번역된 국소 단백질이라고 말하면서 이 이론에 수정을 제안했다.이것은 mRNA가 강한 자극에 의해 시작된 게놈 캐스케이드의 산물이 아니라 지속적인 기초 전사의 결과로 전달된다는 것을 의미한다.그들은 약하게 자극된 태그 부착 시냅스조차도 게놈 캐스케이드가 부족함에도 불구하고 근처의 강한 자극에서 생성된 단백질을 받아들일 수 있다고 제안했다.
수상척추와 세포골격으로의 mRNA 수송
시냅스 태깅/태그 앤 캡쳐 이론은 후기 LTP 동안 mRNA, 단백질 및 기타 분자가 특정 수상돌기에 구체적으로 어떻게 전달될 수 있는지를 설명하는 중요한 문제를 잠재적으로 해결합니다.수지상 척추에 아니소마이신을 주입하고 그에 따른 LTP의 [5]부재를 관찰함으로써 입증되었듯이, LTP의 말기는 특정 수지상 척추 내의 단백질 합성에 의존한다고 오랫동안 알려져 왔다.수상척추 내에서의 변환을 달성하기 위해, 뉴런은 핵에서 mRNA를 합성하고, 그것을 리보핵단백질 복합체 내에 포장하고, 수송을 시작하고, 수송 중 번역을 방지하고, 궁극적으로 적절한 [6]수상척추에 RNP 복합체를 전달해야 한다.이러한 과정은 여러 분야에 걸쳐 있으며 시냅스 태깅/태그 앤 캡쳐는 모든 것을 설명할 수 없습니다. 그럼에도 불구하고 시냅스 태깅은 mRNA 트래픽을 적절한 수상척추로 유도하고 mRNA-RNP 복합체가 수상척추로 분리되어 들어가도록 신호를 보내는 데 중요한 역할을 할 수 있습니다.
세포의 동일성과 아세포 구조의 동일성은 주로 RNA 전사물에 의해 결정된다.이 전제를 고려하면 mRNA의 세포전사, 트래픽 및 번역은 여러 [7]다른 시점에서 수정된다.전사를 시작으로 mRNA 분자는 엑손과 인트론의 교대로 스플라이싱을 통해 잠재적으로 변형된다.대체 접합 메커니즘은 세포가 게놈 내의 단일 유전자로부터 다양한 단백질 세트를 생산하도록 합니다.차세대 염기서열 분석의 최근 발전은 진핵세포가 스플라이스 [8]변형을 통해 달성한 다양성을 더 잘 이해할 수 있게 해주었다.
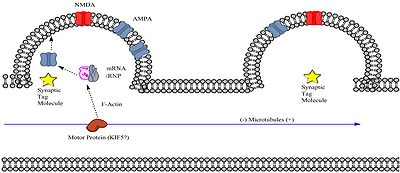
전사된 mRNA는 L-LTP를 발현하기 위해 척추의 수지상 척추에 도달해야 한다.뉴런은 운반 리보핵단백질(RNP) 복합체와 함께 패키지로 특정 수상돌기에 mRNA를 운반할 수 있다.수송 RNP 복합체는 RNA 과립의 아형이다.시냅스 가소성에 중요한 것으로 알려진 두 가지 단백질인 CaMKII(Calmodulin 의존성 Kinase II)와 즉시 초기 유전자 Arc를 포함하는 과립은 운동 단백질 키네신의 일종인 KIF5와 [9]관련이 있는 것으로 확인되었다.또한 폴리아데닐화 mRNA가 적어도 [10]체외에서 포유동물 뉴런의 미소관과 관련되어 있다는 증거가 있다.mRNA 전사물은 핵에서 내보내기 전에 폴리아덴화를 거치기 때문에, 이것은 후기 LTP에 필수적인 mRNA가 수상돌기에 도달하기 전에 수상돌기축 내의 미소관을 따라 이동할 수 있음을 시사한다.
일단 RNA/RNP 복합체가 운동 단백질을 통해 특정 수상돌기 척추 근처의 영역에 도착하면, 수상돌기 척추 내의 과정에 의해 어떻게든 "포착"되어야 합니다.이 과정은 충분한 강도의 시냅스 자극에 의해 생성된 시냅스 태그를 포함할 수 있습니다.시냅스 태깅은 다음과 같은 여러 가지 가능한 메커니즘을 통해 RNA/RNP 복합체를 포착할 수 있습니다.
- 시냅스 태그는 수상돌기 척추 안으로의 일시적인 미세관 진입을 트리거합니다.최근의 연구는 미소관이 활동 의존적인 방식으로 일시적으로 수상돌기에 들어갈 수 있다는 것을 보여준다.[[11] ]
- 시냅스 태그는 운동 단백질에서 화물의 해리를 유발하고 동적으로 형성된 미세 필라멘트로 유도합니다.
국소단백질합성
1980년대 이후, 수상돌기가 리보솜, 단백질, 그리고 RNA 성분을 포함하고 국소적이고 자율적인 단백질 번역을 달성한다는 것이 점점 더 분명해졌다.수상돌기에 국소적으로 나타나는 많은 mRNA는 AMPA 수용체와 CaMK를 포함한 LTP에 관여하는 것으로 알려진 단백질을 코드한다.II 서브유닛 및 세포골격 관련 단백질 MAP2 및 Arc.[12]
연구자들은[13] 해마 세포의 특정 시냅스를 선택적으로 자극한 후 Arc mRNA의 분포를 조사함으로써 국소 합성의 증거를 제공했다.그들은 Arc mRNA가 활성화된 시냅스에 국소화되었고 Arc 단백질이 동시에 그곳에 나타났다는 것을 발견했다.이는 mRNA가 로컬로 변환되었음을 나타냅니다.
이러한 mRNA 전사물은 캡 의존적인 방식으로 번역되며, 이는 리보솜이 5' 미번역 영역에 쉽게 부착되도록 "캡" 고정점을 사용한다는 것을 의미한다.진핵생물 개시인자 4군(eIF4) 구성원은 mRNA 말단에 리보솜 서브유닛을 모집하며, eIF4F 개시복합체의 조립은 번역 제어의 대상이다.eIF4F의 인산화로 신속한 재로드와 번역의 속도 제한 단계를 위한 캡이 노출된다.LTP 동안 국소 [12]변환을 증가시키기 위해 eIF4F 복합체 형성을 규제하는 것이 좋습니다.또한 과도한 eIF4F 콤플렉스는 LTP를 불안정하게 합니다.
연구진은 최종 목적지를 결정하는 mRNA 내 염기서열(LEs), 집코드 및 표적 요소(TEs)를 확인했다.이것들은 RNA 결합 단백질에 의해 인식되며,[14][15] 그 중 일부 잠재적 후보는 MARTA와 ZBP1이다.그들은 TE를 인식하고, 이 상호작용은 운동 단백질의 도움을 받아 세포 골격 필라멘트를 따라 척추로 이동하는 리보뉴클레오티드 단백질 복합체를 형성한다.수상돌기 TE는 MAP2 및 알파CaMK와 같은 여러 mRNA의 미번역 영역에서 확인되었다.Ⅱ.[16][17]
가능한 태그 모델
시냅스 태깅은 시냅스 변화를 [18]보존할 수 있는 시냅스에 의한 분자 유지 메커니즘의 획득을 포함할 가능성이 있다.시냅스 태깅이 [19]기능하는 몇 가지 제안된 프로세스가 있습니다.한 모델은 태그가 특정 시냅스에서 국소 단백질 합성을 허용하고 시냅스 강도의 변화를 가져온다는 것을 시사한다.이 제안된 메커니즘의 한 예는 PKMzeta mRNA를 태그된 시냅스에 고정하는 것이다.그러면 이 앵커는 중요한 가소성 관련 단백질인 번역된 PKMzeta의 활동을 이 위치에 제한합니다.다른 모델은 자극에 의해 유도되는 단기 시냅스 변화가 태그 그 자체라고 제안하며, 이후 전달되거나 번역된 단백질 제품은 이러한 변화를 강화하기 위해 작용한다.예를 들어 LTD로 이어지는 저주파 자극에 의한 AMPA 수용체 제거는 내부화가 일어나지 않은 시냅스에서 비활성화된 새로운 단백질 생성물에 의해 안정화된다.태그는 다른 모델에서 암시하듯이 잠재적인 메모리 트레이스일 수도 있습니다.단백질의 활동은 기억의 흔적이 시냅스 강도의 지속적인 변화를 이끌기 위해 요구될 것이다.이 모델에 따르면, 새로운 필리핀의 성장과 같은 잠재 기억의 추적에 의해 유발되는 변화 자체가 태그가 된다.이러한 태그는 안정화, 시냅스 형성 및 시냅스 안정화를 위해 단백질 생성물을 필요로 합니다.마지막으로, 다른 모델은 전압 게이트 Ca++ 채널을 [20]통해 Ca++ 마이크로 농도 구배를 추종함으로써 필요한 분자 생성물이 적절한 수지상 분지로 유도되고, 그 후 유효성 수정 하에서 특정 시냅스를 찾는 것을 제안한다.
동작 태깅
시냅스 태깅 가설의 개념은 주로 시냅스에 자극을 가하는 실험에서 비롯되었지만, 보다 넓은 의미의 [21]학습 과정을 고려할 때 유사한 모델을 확립할 수 있다.Fabricio Ballarini와 동료들은 약한 훈련을 받은 쥐의 공간 객체 인식, 상황별 조절 및 조건부 미각 혐오를 테스트하여 이 행동 태깅 모델을 개발했습니다.적용된 훈련은 일반적으로 단기 기억력의 변경만 초래합니다.그러나, 그들은 이 약한 훈련과 단백질 합성을 유도하는 것으로 추정되는 별도의 임의 행동 사건을 쌍으로 삼았다.두 행동 사건이 특정 기간 내에 결합되었을 때, 약한 훈련은 장기 기억에서 과제와 관련된 변화를 유도하기에 충분했다.연구원들은 약한 훈련이 "학습 태그"로 이어진다고 믿었다.후속 과제 동안, 단백질의 분열은 이 태그에 대한 장기 기억의 형성을 초래했다.동작 태그 지정 모델은 시냅스 태그 지정 모델에 해당합니다.약한 자극은 E-LTP를 확립하고 고강도 자극을 가하면 약한 전위화를 보다 강하고 지속적인 L-LTP로 변환하는 데 사용될 수 있다.
레퍼런스
- ^ Martin, Kelsey C.; Kosik, Kenneth S. (2002). "Synaptic tagging — who's it?". Nature Reviews Neuroscience. 3 (10): 813–820. doi:10.1038/nrn942. PMID 12360325. S2CID 15311997.
- ^ a b Frey, Uwe; Morris, Richard G. M. (1997). "Synaptic tagging and long-term potentiation". Nature. 385 (6616): 533–536. Bibcode:1997Natur.385..533F. doi:10.1038/385533a0. PMID 9020359. S2CID 4339789.
- ^ a b c Rudy, Jerry W. (2014-02-10). The Neurobiology of Learning and Memory. ISBN 978-1605352305.
- ^ Sajikumar, S.; Frey, J. U. (2004). "Late-associativity, synaptic tagging, and the role of dopamine during LTP and LTD". Neurobiology of Learning and Memory. 82 (1): 12–25. doi:10.1016/j.nlm.2004.03.003. PMID 15183167. S2CID 12746713.
- ^ Frey, Uwe; Krug, Manfred; Reymann, Klaus G.; Matthies, Hansjuergen (1988). "Anisomycin, an inhibitor of protein synthesis, blocks late phases of LTP phenomena in the hippocampal CA1 region in vitro". Brain Research. 452 (1–2): 57–65. doi:10.1016/0006-8993(88)90008-X. PMID 3401749. S2CID 39245231.
- ^ Bramham, Clive R.; Wells, David G. (2007). "Dendritic mRNA: Transport, translation and function". Nature Reviews Neuroscience. 8 (10): 776–789. doi:10.1038/nrn2150. PMID 17848965. S2CID 10131632.
- ^ Moore, M. J. (2005). "From Birth to Death: The Complex Lives of Eukaryotic mRNAs". Science. 309 (5740): 1514–1518. Bibcode:2005Sci...309.1514M. doi:10.1126/science.1111443. PMID 16141059. S2CID 35180502.
- ^ Sultan, M.; Schulz, M. H.; Richard, H.; Magen, A.; Klingenhoff, A.; Scherf, M.; Seifert, M.; Borodina, T.; Soldatov, A.; Parkhomchuk, D.; Schmidt, D.; O'Keeffe, S.; Haas, S.; Vingron, M.; Lehrach, H.; Yaspo, M.-L. (2008). "A Global View of Gene Activity and Alternative Splicing by Deep Sequencing of the Human Transcriptome". Science. 321 (5891): 956–960. Bibcode:2008Sci...321..956S. doi:10.1126/science.1160342. PMID 18599741. S2CID 10013179.
- ^ Kanai, Y.; Dohmae, N.; Hirokawa, N. (2004). "Kinesin transports RNA: Isolation and characterization of an RNA-transporting granule". Neuron. 43 (4): 513–25. doi:10.1016/j.neuron.2004.07.022. PMID 15312650.
- ^ Bassel, Gary J.; Singer, Robert H.; Kosik, Kenneth S. (1994). "Association of poly(A) mRNA with microtubules in cultured neurons". Neuron. 12 (3): 571–582. doi:10.1016/0896-6273(94)90213-5. PMID 8155320. S2CID 12762657.
- ^ Hu, X.; Viesselmann, C.; Nam, S.; Merriam, E.; Dent, E. W. (2008). "Activity-Dependent Dynamic Microtubule Invasion of Dendritic Spines". Journal of Neuroscience. 28 (49): 13094–13105. doi:10.1523/JNEUROSCI.3074-08.2008. PMC 6671621. PMID 19052200.
- ^ a b Banko, Jessica L.; Klann, Eric (2008). "Chapter 4 Cap-dependent translation initiation and memory". Essence of Memory. Progress in Brain Research. Vol. 169. pp. 59–80. doi:10.1016/S0079-6123(07)00004-0. ISBN 9780444531643. PMID 18394468.
- ^ Steward, Oswald; Wallace, Christopher S.; Lyford, Gregory L.; Worley, Paul F. (1998). "Synaptic Activation Causes the mRNA for the IEG Arc to Localize Selectively near Activated Postsynaptic Sites on Dendrites". Neuron. 21 (4): 741–751. doi:10.1016/s0896-6273(00)80591-7. PMID 9808461.
- ^ Rehbein, M.; Kindler, S.; Horke, S.; Richter, D. (2000). "Two trans-acting rat-brain proteins, MARTA1 and MARTA2, interact specifically with the dendritic targeting element in MAP2 mRNAs". Brain Research. Molecular Brain Research. 79 (1–2): 192–201. doi:10.1016/s0169-328x(00)00114-5. PMID 10925159.
- ^ Tiruchinapalli, Dhanrajan M.; Oleynikov, Yuri; Kelič, Sofija; Shenoy, Shailesh M.; Hartley, Adam; Stanton, Patric K.; Singer, Robert H.; Bassell, Gary J. (2003). "Activity-Dependent Trafficking and Dynamic Localization of Zipcode Binding Protein 1 and β-Actin mRNA in Dendrites and Spines of Hippocampal Neurons". The Journal of Neuroscience. 23 (8): 3251–3261. doi:10.1523/JNEUROSCI.23-08-03251.2003. PMC 6742306. PMID 12716932.
- ^ Mayford, M.; Baranes, D.; Podsypanina, K.; Kandel, E. R. (1996). "The 3'-untranslated region of CaMKII alpha is a cis-acting signal for the localization and translation of mRNA in dendrites". Proceedings of the National Academy of Sciences of the United States of America. 93 (23): 13250–5. Bibcode:1996PNAS...9313250M. doi:10.1073/pnas.93.23.13250. PMC 24079. PMID 8917577.
- ^ Mori, Yasutake; Imaizumi, Kazunori; Katayama, Taiichi; Yoneda, Takunari; Tohyama, Masaya (2000). "Two cis-acting elements in the 3′ untranslated region of α-CaMKII regulate its dendritic targeting". Nature Neuroscience. 3 (11): 1079–1084. doi:10.1038/80591. PMID 11036263. S2CID 22077895.
- ^ Sajikumar, S. (2005). "Synaptic Tagging and Cross-Tagging: The Role of Protein Kinase M in Maintaining Long-Term Potentiation but Not Long-Term Depression". Journal of Neuroscience. 25 (24): 5750–5756. doi:10.1523/JNEUROSCI.1104-05.2005. PMC 6724879. PMID 15958741.
- ^ Sossin, W. S. (2008). "Molecular memory traces". Progress in Brain Research. 169: 3–25. doi:10.1016/S0079-6123(07)00001-5. PMID 18394465.
- ^ Michmizos, D.; Koutsouraki, E.; Asprodini, E.; Baloyannis, S. (2011). "Synaptic plasticity: A unifying model to address some persisting questions". The International Journal of Neuroscience. 121 (6): 289–304. doi:10.3109/00207454.2011.556283. PMID 21348800. S2CID 24610392.
- ^ Ballarini, F.; Moncada, D.; Martinez, M. C.; Alen, N.; Viola, H. (2009). "Behavioral tagging is a general mechanism of long-term memory formation". Proceedings of the National Academy of Sciences. 106 (34): 14599–14604. Bibcode:2009PNAS..10614599B. doi:10.1073/pnas.0907078106. PMC 2732837. PMID 19706547.