삼중 공진 핵자기 공명 분광법
Triple-resonance nuclear magnetic resonance spectroscopy트리플 공명 실험은 세 가지 유형의 원자핵을 연결하는 다차원 핵자기공명분광학(NMR) 실험으로, 대부분 H, N, C로 구성되어1 있다.이러한 실험들은 종종 동위원소로 농축된 단백질의 특정 원자에 특정 공명 신호를 할당하기 위해 사용된다.이 기술은 1990년 [1][2]Ad Bax, Mitsuhiko Ikura, Lewis Kay의 논문에서 처음 기술되었고, 이후 일련의 실험에 추가되었다.이러한 실험의 대부분은 NMR에 의한 단백질 구조 결정에서 NMR 공명의 순차적 할당에 사용되는 표준 실험 세트가 되었다.그것들은 이제 단백질에 대한 용액 NMR 연구의 필수적인 부분이며, [3][4]고체 NMR에도 사용될 수 있다.
배경
원자 수준에서 단백질 구조를 결정하는 두 가지 주요 방법이 있습니다.첫 번째는 1958년 미오글로빈의 결정 구조가 결정되면서 시작된 X선 결정학이다.두 번째 방법은 1980년대에 Kurt Wüthrich가 단백질의 NMR 구조 결정을 위한 프레임워크를 개략적으로 설명하고 작은 구상 [5]단백질의 구조를 해결하면서 시작된 NMR에 의한 것이다.NMR에 의한 단백질의 구조 결정의 초기 방법은 결정될 수 있는 단백질의 크기가 최대 10KDa로 제한되는 양성자 기반 호모핵 NMR 분광법에 의존했다.이러한 제한은 단백질에서 많은 수의 핵으로부터 NMR 신호를 할당해야 하는 필요성 때문이다. 즉, 더 큰 단백질에서는 더 많은 핵이 공명 과밀을 초래하고, 단백질의 크기가 증가하면 신호가 확대되어 공명 할당이 어려워진다.이러한 문제는 N과 C의 화학적 이동에 대해 양성자 스펙트럼을 편집할 수 있는 이종핵 NMR 분광법을 사용하여 완화될 수 있으며 스펙트럼의 차원 수를 증가시켜 공명 중첩을 줄일 수 있다.1990년 Ad Bax와 동료들은 N과 [1]C로 동위원소적으로 라벨링된 단백질에 대한 삼중 공명 기술과 실험을 개발하였고, 그 결과 스펙트럼이 극적으로 단순화되어 공명 할당 과정을 크게 용이하게 하고 NMR에 의해 결정될 수 있는 단백질의 크기를 증가시켰다.
이러한 3중 공명 실험은 특정 원자핵 쌍들 사이의 비교적 큰 자기 결합을 이용하여 그들의 연결을 확립합니다.구체적으로는 J, JCH, JCC, JCN 커플링을 사용하여NH 핵 사이의 스칼라 연결 경로를 확립한다.자화 전송 프로세스는 작고 가변적인HH J 커플링의 단일 단계가 아니라 여러 효율적인 원본 자화 전송 단계를 통해 수행됩니다.원본드 커플링의 비교적 큰 크기와 양호한 균일성으로 [3]인해 특정 단백질에 걸쳐 거의 독립적인 효율적인 자화 전달 체계를 설계할 수 있었다.P를 포함한 삼중 공명 실험은 핵산 [6]연구에도 사용될 수 있다.
일련의 실험
이러한 실험은 일반적으로 실험에 관련된 핵(H, N 및 C)에 의해 명명됩니다.CO는 카르보닐 탄소를 의미하며, CA와 CB는 각각 Cα와 Cβ를 의미하며, 마찬가지로 Hα와 HB는 Hα와 Hβ를 의미한다(실험 예는 그림 참조).이름에 포함된 핵은 자화 전달 경로와 동일한 순서로 정렬되며 괄호 안에 있는 핵은 자화 전달 경로에 포함되지만 기록되지는 않습니다.민감도 때문에 이러한 실험은 일반적으로 INEPT 및 역 INEPT 단계를 통해 양성자에서 시작하여 양성자에서 종료된다.따라서 이러한 실험의 대부분은 이름에는 표시되지 않지만 신호 수집을 위해 자화가 시작 양성자로 다시 전달되는 "아웃 앤 백" 실험이라고 할 수 있습니다.
일부 실험은 단백질의 공진 할당을 위해 함께 사용된다. 예를 들어 HNCACB는 CBCA(CO)와 함께 사용될 수 있다.실험 쌍으로 NH를 사용한다.이러한 실험의 모든 것이 순차적 할당에 대해 기록될 필요는 없지만(적어도 2개까지 수행할 수 있음) 추가 실험 쌍은 할당의 정확성에 대한 독립적 평가에 유용하며, 할당에 모호성이 있을 때 정보의 중복성이 필요할 수 있습니다.사이드 체인 공명을 완전히 할당하기 위해서는 다른 실험도 필요합니다.
이러한 실험의 많은 TOSY 버전은 [7]민감도 개선을 위해 존재한다.삼중 공명 실험은 고체 [4][8]NMR에서 매직 앵글 회전 NMR 스펙트럼의 시퀀스별 백본 공명 할당에도 사용할 수 있다.
다수의 3중 공진 NMR 실험이 생성되었으며, 아래에 열거된 실험은 완전한 실험을 의미하지는 않습니다.
HNCO
이 실험은 잔류물의 아미드와 [2]이전 잔류물의 카르보닐 탄소 사이의 연결성을 제공합니다.그것은 3중 공명 실험 중 가장 민감하다.아스파라긴과 글루타민의 사이드체인 카르복사미드도 이 실험에서 볼 수 있다.또한 카르복사미드기와 유사한 결합 상수를 갖는 아르기닌의 구아니디노기도 이 스펙트럼에 나타날 수 있다.이 실험은 HN(CA)CO와 함께 사용되기도 합니다.
HN(CA) CO
여기서 잔류물의 아미드 공명은 상기 잔류물의 카르보닐 카본 및 상기 잔류물의 카보닐 카본과 상관된다.잔존 내 공명은 보통 잔존 간 [9]공명보다 강합니다.
HN(CO)CA
이 실험은 잔류물의 아미드 공명과 이전 잔류물의 Cα의 상관관계를 나타낸다.이 실험은 [10]종종 HNCA와 함께 사용됩니다.
HNCA
이 실험은 이전 [2]잔류물과 동일한 잔류물의 Cα 및 잔류물의 잔류물의 아미드 화학적 이동을 상관시킵니다.각 스트립은 2개의 피크를 제공합니다. 즉, 잔차간 및 잔차내 Cα 피크는 다음과 같습니다.이전 Cα의 피크는 잔류 간 Cα만 제공하는 HN(CO) CA 실험을 통해 확인할 수 있다.
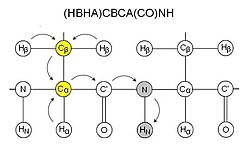
CBCA(CO)NH
CBCA(CO)NH, 또는 대체 HN(CO)CACB는 잔류물의 아미드 공진과 상기 [11]잔류물의 Cα 및 Cβ의 상관관계를 나타낸다.따라서 각 잔류물에 대해 Cα와 Cβ에 대응하는 두 개의 피크가 보인다.이 실험은 보통 HNCACB와 함께 사용됩니다.글루타민과 아스파라긴의 사이드체인 카르복사미드도 이 실험에서 이 스펙트럼에 나타난다.CBCA(CO)NH를 더 정확하게 (HBHA)CBCA(CO)라고 부르기도 한다.NH는 지방족 양성자에서 시작하여 아미드 양성자에서 끝나기 때문에 HN(CO) CACB와 같은 반복 실험이 아니다.
HNCACB
HNCACB 또는 CBCANH는 동일한 잔류물의 Cα와 Cβ 및 이전 [12]잔류물의 잔류물의 아미드의 화학적 이동과 상관관계를 갖는다.각 스트립에는 4개의 피크가 보일 수 있습니다. 즉, 동일한 잔류물에서 2개, 이전 잔류물에서 2개입니다.상기 잔류물로부터의 피크는 일반적으로 약하며 CBCA(CO)를 사용하여 식별할 수 있다.NH. 이 실험에서 Cα와 Cβ 피크는 반대 위상이다. 즉, Cα가 양의 피크로 나타나면 Cβ는 음이 되며, Cα와 Cβ의 식별이 간단해진다.CBCA(CO)NH/HNCACB 세트의 실험에서 Cβ의 추가 정보는 HN(CO)CA/HNCA보다 잔류물 유형을 식별하기 쉽지만, HNCACB는 덜 민감한 실험이며 일부 단백질에는 적합하지 않을 수 있다.
CBCANH 실험은 HNCACB보다 선폭 문제에 더 민감하기 때문에 더 큰 단백질에는 적합하지 않습니다.
CBCACO(CA)HA
이 실험은 동일한 [13]잔류물 내에서 Cα와 Cβ와 카르보닐 탄소 및 Hα 원자의 연결성을 제공합니다.아스파르트산 및 글루탐산염의 측쇄 카르복실기는 이 스펙트럼에서 약하게 나타날 수 있다.
CC(CO)NH
이 실험은 잔류물의 아미드와 이전 [14]잔류물의 지방족 탄소 원자 사이의 연결을 제공합니다.
H(CCO)NH
이 실험은 잔류물의 아미드와 이전 잔류물의 지방족 탄소에 부착된 수소 원자 사이의 연결을 제공합니다.
HBHA(CO)NH
이 실험은 아미드 공명을 이전 [15]잔류물의 Hα 및 Hβ와 연관시킨다.
순차 할당
실험 쌍은 보통 순차 할당에 사용됩니다. 예를 들어 HNCACB와 CBCA(CO)NH 쌍, 또는 HNC(CO) CA와 HNC(CO) CA.스펙트럼은 일반적으로 피크 스트립으로 분석되며, 실험 쌍의 스트립은 나란히 또는 두 스펙트럼의 오버레이로 표시될 수 있다.HNCACB 스펙트럼에서는 일반적으로 각 스트립에 4개의 피크가 존재하며, 1개의 잔류물의 Cα와 Cβ와 이전 잔류물의 피크가 존재한다.앞의 잔류물에서 나온 피크는 CBCA(CO)에서 확인할 수 있다.NH 실험.따라서 각 피크 스트립은 인접한 잔여물에서 다음 피크 스트립에 연결할 수 있으므로 스트립을 순차적으로 연결할 수 있습니다.잔류물 유형은 피크의 화학적 이동에서 확인할 수 있으며, 세린, 트레오닌, 글리신 및 알라닌과 같은 일부는 다른 것보다 훨씬 쉽게 식별할 수 있습니다.그리고 나서 공명은 피크의 시퀀스와 단백질의 아미노산 시퀀스를 비교함으로써 할당될 수 있다.
레퍼런스
- ^ a b Ikura M; Kay LE; Bax A (1990). "A novel approach for sequential assignment of 1H, 13C, and 15N spectra of proteins: heteronuclear triple-resonance three-dimensional NMR spectroscopy. Application to calmodulin". Biochemistry. 29 (19): 4659–67. doi:10.1021/bi00471a022. PMID 2372549.
- ^ a b c Lewis E Kay; Mitsuhiko Ikura; Rolf Tschudin, Ad Bax (1990). "Three-dimensional triple-resonance NMR spectroscopy of isotopically enriched proteins". Journal of Magnetic Resonance. 89 (3): 496–514. Bibcode:1990JMagR..89..496K. doi:10.1016/0022-2364(90)90333-5.
- ^ a b Ad Bax (2011). "Triple resonance three-dimensional protein NMR: before it became a black box". Journal of Magnetic Resonance. 213 (2): 442–5. Bibcode:2011JMagR.213..442B. doi:10.1016/j.jmr.2011.08.003. PMC 3235243. PMID 21885307.
- ^ a b Yongchao Su; Loren Andreas & Robert G. Griffin (2015). "Magic Angle Spinning NMR of Proteins: High-Frequency Dynamic Nuclear Polarization and 1H Detection". Annual Review of Biochemistry. 84: 485–497. doi:10.1146/annurev-biochem-060614-034206. PMID 25839340. – 연차 리뷰 (서브스크립션 필요)
- ^ Kurt Wüthrich (2001). "The way to NMR structures of proteins". Nature Structural Biology. 8 (11): 923–925. doi:10.1038/nsb1101-923. PMID 11685234. S2CID 26153265.
- ^ Gabriele Varani; Fareed Aboul-ela; Frederic Allain & Charles C. Gubser (1995). "Novel three-dimensional 1H−13C−31P triple resonance experiments for sequential backbone correlations in nucleic acids". Journal of Biomolecular NMR. 5 (3): 315–320. doi:10.1007/BF00211759. PMID 7540446. S2CID 31239207.
- ^ Michael Salzmann; Gerhard Wider; Konstantin Pervushin; Hans Senn & Kurt Wu1thrich (1999). "TROSY-type Triple-Resonance Experiments for Sequential NMR Assignments of Large Proteins" (PDF). Journal of the American Chemical Society. 121 (4): 844–848. doi:10.1021/ja9834226.
- ^ Barbet-Massin; et al. (2014). "Rapid Proton-Detected NMR Assignment for Proteins with Fast Magic Angle Spinning". Journal of the American Chemical Society. 136 (35): 12489–12497. doi:10.1021/ja507382j. PMC 4156866. PMID 25102442.
- ^ Robert T Clubb; V Thanabal; Gerhard Wagner (1992). "A constant-time three-dimensional triple-resonance pulse scheme to correlate intraresidue 1HN, 15N, and 13C′ chemical shifts in 15N/13C-labelled proteins". Journal of Magnetic Resonance. 97 (1): 213–217. Bibcode:1992JMagR..97..213C. doi:10.1016/0022-2364(92)90252-3. hdl:2027.42/30326.
- ^ Ad Bax & Mitsuhiko Ikura (1991). "An efficient 3D NMR technique for correlating the proton and 15N backbone amide resonances with the α-carbon of the preceding residue in uniformly 15N/13C enriched proteins". Journal of Biomolecular NMR. 1 (1): 99–104. doi:10.1007/BF01874573. PMID 1668719. S2CID 20037190.
- ^ Stephan Grzesiek, Ad Bax (1992). "Correlating backbone amide and side chain resonances in larger proteins by multiple relayed triple resonance NMR". Journal of the American Chemical Society. 114 (16): 6291–6293. doi:10.1021/ja00042a003.
- ^ Stephan Grzesiek, Ad Bax (1992). "An efficient experiment for sequential backbone assignment of medium-sized isotopically enriched proteins". Journal of Magnetic Resonance. 99 (1): 201–207. Bibcode:1992JMagR..99..201G. doi:10.1016/0022-2364(92)90169-8.
- ^ Kay, Lewis E. (1993). "Pulsed-field gradient-enhanced three-dimensional NMR experiment for correlating 13Cα/β, 13C', and 1Hα chemical shifts in uniformly carbon-13-labeled proteins dissolved in water". Journal of the American Chemical Society. 115 (5): 2055–2058. doi:10.1021/ja00058a072.
- ^ S. Grzesiek; J. Anglister; A. Bax (1993). "Correlation of Backbone Amide and Aliphatic Side-Chain Resonances in 13C/15N-Enriched Proteins by Isotropic Mixing of 13C Magnetization". Journal of Magnetic Resonance, Series B. 101 (1): 114–119. Bibcode:1993JMRB..101..114G. doi:10.1006/jmrb.1993.1019.
- ^ Stephan Grzesiek & Ad Bax (1993). "Amino acid type determination in the sequential assignment procedure of uniformly 13C/15N-enriched proteins". Journal of Biomolecular NMR. 3 (2): 185–204. doi:10.1007/BF00178261. PMID 8477186. S2CID 1324255.