퉁스테이트
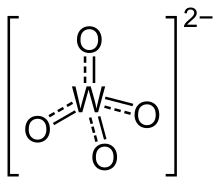
Tungstate화학에서 텅스테이트는 텅스텐의 옥소이온을 함유한 화합물이나 텅스텐을 함유한 혼합 산화물이다. 가장 단순한 텅스테이트 이온은 WO2−
4, "정통성 상태"[1]이다. 다른 많은 텅스타이트는 다산화수소("POM")라고 불리는 다원자 이온의 큰 그룹에 속하며, 특히 산소와 아마도 수소와 함께 이소폴리옥소메탈산염이라고 불리는 다른 원소들 중 오직 한 가지 다른 원소에 속한다. 거의 모든 유용한 텅스텐 광석은 텅스테인이다.[2]
구조물들
직교동물은 짧은 W–O 거리가 1.79 å인 사면체 W(VI) 센터를 특징으로 한다. 구조적으로 황산염과 유사하다. 6개의 좌표, 팔면 텅스텐이 다산화성분에서 지배한다. 이러한 화합물에서 W-O 거리는 길다.[1]
텅스테이트 이온의 몇 가지 예는 다음과 같다.[3]
- HWO−
4(유체전성주)[3] - NaWO227, LiWO227, Ag의2 다양한 구조물의 고분자 WO
22−
7 이온W2O7[4] - [WO724]6− (기동 상태 A)[3]
- [WO1032](4−텅스테이트 Y)[5]
- [HWO21242]10− (기생성 B)
- α-[HWO21240]6−[5] (금속 상태)
- β-[HWO21240](6−텅스테이트 X)[5]
텅스타이트 목록은 텅스타이트 범주를 참조하십시오.
발생
텅스타이트는 몰리브다이트와 함께 자연적으로 발생한다. 광물 칼슘 텅스테이트인 셸라이트는 종종 적은 양의 몰리브데일을 함유하고 있다. 울프라마이트는 망간과 철 텅스테이트로, 이 모든 것이 텅스텐의 귀중한 원천이다. 파월라이트(Powellite)는 소량의 텅스테이트를 함유하고 있는 칼슘 몰리브데일의 미네랄 형태다.
반응
몰리브다이트와 같은 텅스타이트의 용액은 대부분의 유기 물질에 의해 감소되었을 때 몰리브덴 블루스와 유사한 복잡한 텅스테이트(V,VI)의 강렬한 파란색 용액을 제공한다.[1]
크롬산염과는 달리 텅스테이트는 좋은 산화제는 아니지만, 크롬산염과 마찬가지로, 텅스테이트 용액은 산성화에 따라 이소폴리툰스타이트를 주는 응축제다.
참조
- ^ a b c Egon Wiberg, Arnold Frederick Holleman (2001). Inorganic Chemistry. Elsevier. ISBN 0-12-352651-5.
- ^ Lassner, Erik; Schubert, Wolf-Dieter; Lüderitz, Eberhard; Wolf, Hans Uwe (2005). "Tungsten, Tungsten Alloys, and Tungsten Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a27_229.
- ^ a b c d Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ 웰스 A.F. (1984) 구조 무기 화학 제5판 옥스퍼드 과학 간행물 ISBN 0-19-855370-6
- ^ a b c 존 A. 맥클레빈곤, N. G. 코넬리, 무기화학 명명법 II: 권고안 2000, 국제 무기화학 명명법 국제연합 및 응용화학위원회, 왕립화학회에서 발간, 2001, ISBN 0-85404-487-6