VI형 분비 시스템
Type VI secretion system타입 VI 분비계통(T6SS)은 광범위한 그램 음성 세균종이 세포 외피를 가로질러 박테리아 세포의 내부(사이토플라즘 또는 세포솔)에서 인접한 표적 세포로 이펙터를 운반하기 위해 사용하는 분자 기계다.흔히 2006년 콜레라의 원인물질인 비브리오콜레라에를 연구하는 연구자들에 의해 T6SS가 발견되었다고 보도되었지만, T6SS 유전자가 단백질 수출장비를 암호화하는 것을 보여주는 첫 번째 연구는 실제로 2004년에 어류 병원체 에드워드시엘라 타르다의 단백질 분비에 관한 연구에서 발표되었다.[1][2][3]
이후 동물, 식물, 인간의 병원균은 물론 토양, 환경 또는 해양세균까지 T6SS를 위해 최소 4분의 1의 병원성 및 비병원성 프로테오박테리아 유전체가 암호화된 것으로 추정된다.[4][5][6][7]T6SS를 위한 유전자 인코딩은 염색체에서 흔히 발견되지만, 이동 유전적 요소와 그들의 전달과 유전적 다양성의 증가를 매개하는 플라스미드에서도 발견될 수 있다.[8][9]초기 6형 분비에 대한 대부분의 연구가 상위 유기체의 병원체에서 그것의 역할에 초점을 맞췄지만, 현재는 주로 박테리아간 대항작용에서 기능하는 것으로 알려져 있다.[3]
구조 및 메커니즘
T6SS는 박테리아 세포 표면에서 바깥쪽으로 확장되는 역 페이지를 닮았다고 생각된다.그것은 3개의 하위 복합체로 조립되는 14개의 단백질로 구성되어 있다: 페이지 꼬리 같은 튜불, 페이지 베이스플레이트 같은 구조, 그리고 세포-엔벨로브 스패닝 막 복합체.이 세 개의 하위 복합체는 서로 협력하여 박테리아 세포 외피를 가로질러 수축기계를[10] 통해 대상 세포로 단백질을 운반한다.
페이지는 꼬리처럼 생겼다.
T6SS의 페이지 테일 유사 부품은 조립과 분해의 주기를 거치는 동적 관 구조물이다.최대 600nm 길이까지 가능하며, 전자 마이크로그래프에서 박테리아 세포질 전체로 확대된 것을 시각화했다.[11]관은 용혈신 공동조절단백질(Hcp)의 쌓인 육각고리로 만들어진 관 주위에 피복으로 배열된 TssA와 TssB(VipA/VipB) 단백질의 반복단위로 구성된다.[12][13]Hcp 튜브의 끝에는 뾰족한 PAAR 도메인 함유 단백질이 차례로 덮인 페이지 꼬리 스파이크 유사 단백질 VgrG의 트리머가 놓여 있다.[14]피복의 수축은 Hcp 튜브, VgrG 및 관련 기판을 박테리아 세포 바깥으로 밀어내는 것으로 생각되며, VgrG/PAAR 스파이크가 인접 세포의 막 침투에 용이하게 한다.Tubule 구조는 Tubule 베이스에 앉아 있는 ATP 분해 단백질 ClpV의 작용을 통해 분해된다.[13]
밑판
T6SS의 페이지 꼬리 모양의 관은 박테리오파지 염기판과 유사한 구조물에 조립된다.TssE, TssF, TssG, TssK라는 단백질로 구성되어 있다.밑판과 페이징 꼬리 같은 콤플렉스는 박테리아 세포질에서 상호작용을 한 다음 막 콤플렉스에 의해 세포 봉투에 포섭된다.[10]
막
T6SS 멤브레인 콤플렉스는 기구를 세포막에 고정시키는 역할을 하며, 페이징 꼬리와 같은 관의 수축에 의해 기판이 추진되는 채널을 제공한다.[10]이 대형(1.7 md) 콤플렉스는 TssJ, TssM, TssL을 포함하는 이단계의 10개 상호작용 유닛으로 형성된다.내막에서 그람 음성 박테리아 세포 외막까지 뻗어 있어 홍채와 같은 독특한 메커니즘으로 개폐하는 통로를 형성하고 있는 것으로 생각된다.[15]
기질인식
다른 분비계통의 기판(일반 분비 경로나 분비계통 III, IV 등)과는 달리 T6SS의 기판에는 보편적으로 식별되는 특징이 없는 것으로 알려져 있다.대신 기구의 두 가지 구조 요소 중 하나를 통해 분비를 인식하고 선택한다.한 등급의 기질들은 Hcp 헥사머의 모공 안에서 결합된다.[16]이러한 상호작용이 없을 때는 기판이 불안정하기 때문에 기판이 통과하는 수동적 관로 역할을 하는 Hcp가 아니라 기질-Hcp 복합체가 함께 분비된다고 생각된다.두 번째 기질 부류는 페이지 꼬리 스파이크 모양의 단백질 VgrG와 상호작용을 통해 분비를 목표로 한다.이러한 기질들은 종종 Rhs 독소와 같은 모듈형 단백질로서 한쪽 끝에서 VgrG와의 상호작용을 위한 PAAR 도메인을 가지고 있다.[5]또한 VgrG와 기질이 같은 단백질의 일부인 경우도 있다.[citation needed]
항우울제
T6SS의 조상 기능은 박테리아를 목표로 하는 것으로 보이지만 진핵세포를 목표로 진화한 소수의 시스템이 확인되었다.일반적으로 이러한 eukaryote-targeting 시스템은 질병을 일으키는 데 관여한다.예를 들어 세포내 병원체 프란시셀라 툴라렌시스(Francisella tularrenis)는 Pagosome으로부터 탈출하여 대식세포의 세포질에서 복제하기 위해 T6SS의 활동을 요구한다.[17]분비된 단백질이 F. tularenisis virulence를 촉진하는 메커니즘은 아직 알려져 있지 않다.비브리오콜레라의 T6SS는 박테리아와 진핵 세포 모두를 대상으로 할 수 있는 이중 역할을 한다.[18]그것이 분비하는 적어도 하나의 기질은 세포핵 세포 표적에 특화되며 세포골격 단백질 액틴을 교차 연결함으로써 기능한다.[19]Burkholderia philosomallei와 Edwardsiella tarda는 진핵 표적용 T6SS를 가지고 있는 다른 두 유기체들이다.식물의 병원체 크산토모나스 시트리(Xantomonas citri)의 T6SS는 약탈성 아메바 디스코스텔륨으로부터 보호한다.[20]
항균성
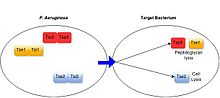
그람 음성 박테리아에는 녹농균 등 기회주의적인 병원균,[21] 인간의 내장에 서식하는 균류(박테로이드 spp)[22] 의무화, 아그로박테리움 투메파시엔스 등 식물 관련 세균 등 광범위한 항균 T6SS가 있는 것으로 나타났다.[23]이 시스템들은 분비된 기판의 기능을 통해 항균 활동을 한다.[3]모든 특징적인 박테리아 표적형 T6SS 단백질은 표적 세포의 성장을 죽이거나 막음으로써 독소 역할을 한다.T6SS 기질에 의해 나타나는 표적 세포에 대한 독성의 메커니즘은 다양하지만, 일반적으로 미드레아제나 글리코하이드롤라아제 활동을 통한 세포벽의 저하, 지질 활동이나 모공 형성을 통한 세포막의 붕괴, DNA의 갈라짐, 디그라디오 등 보존도가 높은 박테리아 구조를 목표로 하는 것을 포함한다.필수 대사물 NAD+의 n.[3][24]T6SS 양성 박테리아 종은 각각의 분비 독소에 특유한 면역 단백질을 생성하여 T6SS가 자기와 친족 세포에 대한 중독을 예방한다.면역 단백질은 종종 그들의 활성 부위에서 독소 단백질과 결합하여 기능하므로 그들의 활동을 차단한다.[25][3]
규정
GacS/RSM 시스템
일부 연구는 두 개의 부품 시스템에 의한 T6SS 규제에 들어갔다.P. 에어로기노사에서는 GacS/RSM 2성분 시스템이 VI형 분비 시스템 규제에 관여하는 것이 관찰되었다.이 시스템은 Rsm 소형 규제 RNA 분자의 발현을 조절하며, 바이오필름 형성에 관여하기도 했다.GacS/RSM 경로 자극에 따라 RSM 분자의 증가는 mRNA 결합 단백질 RsmA의 억제로 이어진다.RsmA는 T6SS 유전자 발현을 위해 리보솜 결합 부위 근처의 시퀀스에 결합하는 변환 억제제다.이 수준의 규제는 또한 P. 형광등과 P. 주사기에서도 관찰되었다.[26][27]
쿼럼 감지
쿼럼 감지가 T6SS를 조절하는 다양한 예가 있다.비브리오콜레라 T6SS 연구에서는 세로형 O37의 혈관 유전자 발현이 높은 것으로 관찰되었다.반면에 세로타입 O139와 O1은 정반대의 모습을 보이며 현저하게 낮은 vas 유전자 발현이다.표현의 차이는 정족수 감지 수준의 차이에서 기인한다는 의견이 분분하다.비브리오콜레라에서는 센서키나제인 럭스큐에 의해 자동유도기-1(AI-1) 신호가 검출된다.룩스큐는 룩스를 활성화하고, 룩소는 HapR 유전자 발현을 억제하는 DNA 결합 단백질인 룩소(LuxO)에 작용한다.HapR은 LuxO의 삭제로 인해 Vas 유전자 발현이 강하게 유도되어 T6SS 발현이 어떤 형태로든 정족수 감지에 의해 규제된다는 것을 증명한다고 생각된다.[28]그러나 룩소 삭제된 O1 변종은 O37 변종에 비해 여전히 상대적으로 대기 T6SS가 있어 추가 요소도 관여하고 있음을 시사했다.[29]
참고 항목
참조
- ^ Rao PS, Yamada Y, Tan YP, Leung KY (2004). "Use of proteomics to identify novel virulence determinants that are required for Edwardsiella tarda pathogenesis". Mol Microbiol. 53 (2): 573–86. doi:10.1111/j.1365-2958.2004.04123.x. PMID 15228535. S2CID 25901071.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Hood RD, Peterson SB, Mougous JD (March 2017). "From Striking Out to Striking Gold: Discovering that Type VI Secretion Targets Bacteria". Cell Host & Microbe. 21 (3): 286–289. doi:10.1016/j.chom.2017.02.001. PMC 6404758. PMID 28279332.
- ^ a b c d e Russell AB, Peterson SB, Mougous JD (February 2014). "Type VI secretion system effectors: poisons with a purpose". Nature Reviews. Microbiology. 12 (2): 137–48. doi:10.1038/nrmicro3185. PMC 4256078. PMID 24384601.
- ^ Boyer, Frédéric; Fichant, Gwennaële; Berthod, Jérémie; Vandenbrouck, Yves; Attree, Ina (December 2009). "Dissecting the bacterial type VI secretion system by a genome wide in silico analysis: what can be learned from available microbial genomic resources?". BMC Genomics. 10 (1): 104. doi:10.1186/1471-2164-10-104. ISSN 1471-2164. PMC 2660368. PMID 19284603.
- ^ a b Shneider MM, Buth SA, Ho BT, Basler M, Mekalanos JJ, Leiman PG (August 2013). "PAAR-repeat proteins sharpen and diversify the type VI secretion system spike". Nature. 500 (7462): 350–353. Bibcode:2013Natur.500..350S. doi:10.1038/nature12453. PMC 3792578. PMID 23925114.
- ^ Bingle, Lewis EH; Bailey, Christopher M; Pallen, Mark J (February 2008). "Type VI secretion: a beginner's guide". Current Opinion in Microbiology. 11 (1): 3–8. doi:10.1016/j.mib.2008.01.006. PMID 18289922.
- ^ Monjarás Feria, Julia; Valvano, Miguel A. (2020-10-19). "An Overview of Anti-Eukaryotic T6SS Effectors". Frontiers in Cellular and Infection Microbiology. 10: 584751. doi:10.3389/fcimb.2020.584751. ISSN 2235-2988. PMC 7641602. PMID 33194822.
- ^ Robinson, Luca; Liaw, Janie; Omole, Zahra; Xia, Dong; van Vliet, Arnoud H. M.; Corcionivoschi, Nicolae; Hachani, Abderrahman; Gundogdu, Ozan (29 June 2021). "Bioinformatic analysis of the Campylobacter jejuni Type VI secretion system and effector prediction". Frontiers in Microbiology. 12: 1751. doi:10.3389/fmicb.2021.694824. ISSN 1664-302X. PMC 8285248. PMID 34276628.
- ^ Filloux, Alain; Hachani, Abderrahman; Bleves, Sophia (June 2008). "The bacterial type VI secretion machine: yet another player for protein transport across membranes". Microbiology. 154: 1570-1583. doi:10.1099/mic.0.2008/016840-0. PMID 18524912.
- ^ a b c Cianfanelli FR, Monlezun L, Coulthurst SJ (January 2016). "Aim, Load, Fire: The Type VI Secretion System, a Bacterial Nanoweapon". Trends in Microbiology. 24 (1): 51–62. doi:10.1016/j.tim.2015.10.005. PMID 26549582.
- ^ Basler M, Pilhofer M, Henderson GP, Jensen GJ, Mekalanos JJ (February 2012). "Type VI secretion requires a dynamic contractile phage tail-like structure". Nature. 483 (7388): 182–6. Bibcode:2012Natur.483..182B. doi:10.1038/nature10846. PMC 3527127. PMID 22367545.
- ^ Brunet YR, Hénin J, Celia H, Cascales E (March 2014). "Type VI secretion and bacteriophage tail tubes share a common assembly pathway". EMBO Reports. 15 (3): 315–21. doi:10.1002/embr.201337936. PMC 3989698. PMID 24488256.
- ^ a b Bönemann G, Pietrosiuk A, Diemand A, Zentgraf H, Mogk A (February 2009). "Remodelling of VipA/VipB tubules by ClpV-mediated threading is crucial for type VI protein secretion". The EMBO Journal. 28 (4): 315–25. doi:10.1038/emboj.2008.269. PMC 2646146. PMID 19131969.
- ^ Bönemann G, Pietrosiuk A, Diemand A, Zentgraf H, Mogk A (February 2009). "Remodelling of VipA/VipB tubules by ClpV-mediated threading is crucial for type VI protein secretion". The EMBO Journal. 28 (4): 315–25. doi:10.1038/emboj.2008.269. PMC 2646146. PMID 19131969.
- ^ Durand E, Nguyen VS, Zoued A, Logger L, Péhau-Arnaudet G, Aschtgen MS, Spinelli S, Desmyter A, Bardiaux B, Dujeancourt A, Roussel A, Cambillau C, Cascales E, Fronzes R (July 2015). "Biogenesis and structure of a type VI secretion membrane core complex". Nature. 523 (7562): 555–60. Bibcode:2015Natur.523..555D. doi:10.1038/nature14667. PMID 26200339. S2CID 205244835.
- ^ Silverman JM, Agnello DM, Zheng H, Andrews BT, Li M, Catalano CE, Gonen T, Mougous JD (September 2013). "Haemolysin coregulated protein is an exported receptor and chaperone of type VI secretion substrates". Molecular Cell. 51 (5): 584–93. doi:10.1016/j.molcel.2013.07.025. PMC 3844553. PMID 23954347.
- ^ Nano FE, Schmerk C (June 2007). "The Francisella pathogenicity island". Annals of the New York Academy of Sciences. 1105 (1): 122–37. Bibcode:2007NYASA1105..122N. doi:10.1196/annals.1409.000. PMID 17395722. S2CID 35958075.
- ^ Dong TG, Ho BT, Yoder-Himes DR, Mekalanos JJ (February 2013). "Identification of T6SS-dependent effector and immunity proteins by Tn-seq in Vibrio cholerae". Proceedings of the National Academy of Sciences of the United States of America. 110 (7): 2623–8. Bibcode:2013PNAS..110.2623D. doi:10.1073/pnas.1222783110. PMC 3574944. PMID 23362380.,
- ^ Pukatzki S, 어머니 올 댓, 레벨 올 댓, Sturtevant또는 BarbaraHannify 와D, Mekalanos JJ(2007년 9월)."형식 VI분비 체계가 표적 세포로 어디 actin cross-links 파지 꼬리spike-like 단백질 translocates".미국 국립 과학 아카데미의 아메리카 미국의 회보. 104(39):15508–13.Bibcode:2007PNAS..10415508P. doi:10.1073/pnas.0706532104.PMC2000545.PMID 17873062.,
- ^ Bayer-Santos E, Lima LD, Ceseti LM, Ratagami CY, de Santana ES, da Silva AM, Farah CS, Alvarez-Martinez CE (April 2018). "Xanthomonas citri T6SS mediates resistance to Dictyostelium predation and is regulated by an ECF σ factor and cognate Ser/Thr kinase". Environmental Microbiology. 20 (4): 1562–1575. doi:10.1111/1462-2920.14085. PMID 29488354. S2CID 3579518.
- ^ Hood RD, Singh P, Hsu F, Güvener T, Carl MA, Trinidad RR, Silverman JM, Ohlson BB, Hicks KG, Plemel RL, Li M, Schwarz S, Wang WY, Merz AJ, Goodlett DR, Mougous JD (January 2010). "A type VI secretion system of Pseudomonas aeruginosa targets a toxin to bacteria". Cell Host & Microbe. 7 (1): 25–37. doi:10.1016/j.chom.2009.12.007. PMC 2831478. PMID 20114026.
- ^ Russell AB, Wexler AG, Harding BN, Whitney JC, Bohn AJ, Goo YA, Tran BQ, Barry NA, Zheng H, Peterson SB, Chou S, Gonen T, Goodlett DR, Goodman AL, Mougous JD (August 2014). "A type VI secretion-related pathway in Bacteroidetes mediates interbacterial antagonism". Cell Host & Microbe. 16 (2): 227–236. doi:10.1016/j.chom.2014.07.007. PMC 4136423. PMID 25070807.
- ^ Ma LS, Hachani A, Lin JS, Filloux A, Lai EM (July 2014). "Agrobacterium tumefaciens deploys a superfamily of type VI secretion DNase effectors as weapons for interbacterial competition in planta". Cell Host & Microbe. 16 (1): 94–104. doi:10.1016/j.chom.2014.06.002. PMC 4096383. PMID 24981331.
- ^ Whitney JC, Quentin D, Sawai S, LeRoux M, Harding BN, Ledvina HE, Tran BQ, Robinson H, Goo YA, Goodlett DR, Raunser S, Mougous JD (October 2015). "An interbacterial NAD(P)(+) glycohydrolase toxin requires elongation factor Tu for delivery to target cells". Cell. 163 (3): 607–19. doi:10.1016/j.cell.2015.09.027. PMC 4624332. PMID 26456113.
- ^ Ho BT, Dong TG, Mekalanos JJ (January 2014). "A view to a kill: the bacterial type VI secretion system". Cell Host & Microbe. 15 (1): 9–21. doi:10.1016/j.chom.2013.11.008. PMC 3936019. PMID 24332978.
- ^ Mougous JD, Cuff ME, Raunser S, Shen A, Zhou M, Gifford CA, Goodman AL, Joachimiak G, Ordoñez CL, Lory S, Walz T, Joachimiak A, Mekalanos JJ (June 2006). "A virulence locus of Pseudomonas aeruginosa encodes a protein secretion apparatus". Science. 312 (5779): 1526–30. Bibcode:2006Sci...312.1526M. doi:10.1126/science.1128393. PMC 2800167. PMID 16763151.
- ^ Records AR, Gross DC (July 2010). "Sensor kinases RetS and LadS regulate Pseudomonas syringae type VI secretion and virulence factors". Journal of Bacteriology. 192 (14): 3584–96. doi:10.1128/JB.00114-10. PMC 2897360. PMID 20472799.
- ^ Records AR, Gross DC (July 2010). "Sensor kinases RetS and LadS regulate Pseudomonas syringae type VI secretion and virulence factors". Journal of Bacteriology. 192 (14): 3584–96. doi:10.1128/JB.00114-10. PMC 2897360. PMID 20472799.
- ^ Silverman JM, Brunet YR, Cascales E, Mougous JD (2012). "Structure and regulation of the type VI secretion system". Annual Review of Microbiology. 66: 453–72. doi:10.1146/annurev-micro-121809-151619. PMC 3595004. PMID 22746332.




