볼트암메트리
Voltammetry전압 측정은 분석 화학 및 다양한 산업 공정에서 사용되는 전기 분석 방법의 범주다.전압 측정에서 분석 물질에 대한 정보는 전위가 변화함에 따라 전류를 측정하여 얻는다.[1][2]전압계 실험을 위한 분석 데이터는 분석 물질에 의해 생성되는 전류 대 작동 전극의 잠재력을 나타내는 전압 기록의 형태로 제공된다.[3]
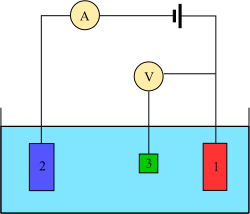
3 전극 시스템

전압측정 실험은 분석 물질의 반전지 반응도를 조사한다.Voltammetry는 적용된 전위의 함수로서 전류를 연구하는 학문이다.이러한 곡선 I = f(E)를 voltamogram(볼트암그램)이라고 한다.전위는 단계별 또는 연속적으로 임의로 변화하며, 실제 전류 값은 종속변수로 측정된다.그 반대, 즉 암페로메트릭도 가능하지만 흔하지는 않다.곡선의 모양은 잠재적 변동 속도(주행력의 특성)와 용액이 휘젓는지 또는 대기(대량 전달)에 따라 달라진다.대부분의 실험은 결과 전류(암페어)를 측정하면서 분석 물질과 접촉하는 전극의 전위(볼트)를 제어한다.[4]
그런 실험을 하기 위해서는 적어도 두 개의 전극이 필요하다.분석 물질과 접촉하는 작동 전극은 원하는 전위를 제어된 방식으로 적용하고 분석 물질과 전하를 쉽게 주고 받아야 한다.두 번째 전극은 세포의 다른 반쪽 역할을 한다.이 두 번째 전극은 작동 전극의 전위를 측정할 수 있는 알려진 전위를 가지고 있어야 하며, 나아가 작동 전극에 의해 추가되거나 제거된 전하의 균형을 맞춰야 한다.이것이 실행 가능한 설정이지만, 여러 가지 단점이 있다.가장 중요한 것은 전극이 작동 중인 전극에서 리독스 사건에 대항하기 위해 전류를 전달하면서 일정한 전위를 유지하는 것이 매우 어렵다.
이 문제를 해결하기 위해 전자를 공급하고 기준 전위를 제공하는 역할은 두 개의 분리된 전극으로 나뉜다.기준 전극은 알려진 감소 전위를 가진 반전지다.그것의 유일한 역할은 작동 전극의 전위를 측정하고 제어하는데 있어 참조 역할을 하는 것이며, 어느 지점에서도 전류를 통과하지 못한다.보조 전극은 작동 전극에서 관측된 전류의 균형을 맞추는 데 필요한 모든 전류를 통과시킨다.이 전류에 도달하기 위해 보조 장치는 용제 창 가장자리의 극한 전위로 회전하며 용제 또는 지지 전해질을 산화 또는 감소시킨다.이 전극, 작업, 참조, 보조는 현대식 3전극 시스템을 구성한다.
전극이 더 많은 시스템들이 있지만, 그 설계 원리는 일반적으로 3전극 시스템과 동일하다.예를 들어 회전하는 링-디스크 전극에는 두 개의 뚜렷하고 분리된 작동 전극인 디스크와 링이 있는데, 이 전극은 서로 독립적으로 전위를 스캔하거나 고정하는 데 사용될 수 있다.이 두 전극 모두 전체 4전극 설계를 위한 단일 기준 및 보조 조합으로 균형을 맞춘다.더 복잡한 실험은 필요에 따라 때로는 참조 전극 또는 보조 전극을 추가할 수 있다.
실제로 알려진 치수와 표면 특성을 가진 작동 전극을 갖는 것이 중요할 수 있다.그 결과 작동하는 전극을 정기적으로 청소하고 광택을 내는 것이 일반적이다.보조 전극은 분석 용액의 부피에 반응하지 않고 잘 작동하는 한 거의 모든 것이 될 수 있다.수은을 작동 전극(예: DME, HMDE)으로, 보조 전극으로도 사용하는 것이 일반적이며, 전압측정법을 극지방학(polarography)이라고 한다.참조는 세 개의 전극 중 가장 복잡하다. 다양한 표준이 사용되며 다른 곳에서 조사할 가치가 있다.비수성 작업의 경우 IUPAC는 페로센/페로센 커플을 내부 표준으로 사용할 것을 권장한다.[5]대부분의 voltammetry 실험에서는 용액 저항을 최소화하기 위해 대량 전해질(지원 전해질이라고도 함)을 사용한다.대량 전해질 없이 실험이 가능하지만, 저항이 더해지면 결과의 정확도가 크게 떨어진다.실온 이온성 액체로 용제는 전해액 역할을 할 수 있다.
이론
데이터 분석에는 전압 측정의 시간적 구성요소로 인해 열역학 외에 운동학적 고려가 필요하다.네른스트 방정식과 같은 이상화된 이론적 전기화학적 열역학적 관계는 시간 요소 없이 모델링된다.이러한 모델만으로는 voltammetry의 동적 측면을 설명하기에 충분하지 않지만, Tafel 방정식과 Butler-Volmer 방정식과 같은 모델들은 이론과 관측된 결과를 연결하는 수정된 voltammetry 관계를 위한 토대를 마련한다.[6]
전압 측정 유형
- 선형 스위프 전압계
- 계단 전압측정법
- 사각파 전압측정법
- 주기적 전압 측정 - 확산 계수 및 반전지 감소 전위를 결정하는 데 사용할 수 있는 전압 측정 방법.
- 양극성 박토 전압 측정 - 금속 양이온의 추적 분석을 위한 정량적 분석 방법.분석물은 증착 단계에서 작업 전극에 침전(전극)된 후 분해 단계에서 산화된다.전류가 박리 단계에서 측정된다.
- 음극 박리 전압 측정 - 음이온의 추적 분석을 위한 정량적 분석 방법.양전위를 적용하여 수은 전극을 산화시키고 음이온의 불용성 침전물을 형성한다.그러면 음전위가 침전된 필름을 용액으로 감소(스트라이핑)시킨다.
- 흡착성 박리 전압계 - 추적 분석을 위한 정량적 분석 방법.분석 물질은 전극 표면(즉, 전기분해 없음)의 흡착에 의해 침전된 다음, 분석 신호를 주기 위해 전해진다.화학적으로 변형된 전극이 자주 사용된다.
- 교류전류 전압측정법
- 극지방학 - 작동 전극이 낙하 수은 전극(DME)인 전압계 하위 등급으로 넓은 음극 범위와 재생 가능한 표면에 유용하다.
- 회전 전극 전압 측정 - 작동 전극, 보통 회전 디스크 전극(RDE) 또는 회전 링 디스크 전극(RRDE)이 매우 높은 속도로 회전하는 유체역학 기법이다.이 기술은 반작용을 위한 운동학 및 전기화학 반응 메커니즘을 연구하는 데 유용하다.
- 정상 펄스 전압측정법
- 차동 펄스 전압 측정
- 연대기암페어측정법
역사
voltammetry의 시작은 1922년 노벨상을 수상한 체코의 화학자 야로슬라프 헤이로프스키에 의해 극지방학이 발견됨으로써 촉진되었다.초기 전압계 기법에는 많은 문제가 있어 분석 화학에서 일상적으로 사용할 수 있는 생존 능력이 제한되었다.극지방학에서 이러한 문제들은 수은이 +0.2볼트보다 더 양적인 전위성으로 산화된다는 사실을 포함하였고, 이는 전위의 양적인 영역에 있는 분석 물질에 대한 결과를 분석하기 어렵게 한다.또 다른 문제는 전극 표면의 큰 캐패시턴스 충전을 통해 얻은 잔류 전류였다.[7]헤이로프스키는 1922년 처음으로 적용된 전위에 떨어지는 수은 전극을 통해 흐르는 전류에 대한 의존도를 기록했을 때, 포인트 단위로 측정하여 전류 전압 곡선을 그렸다.이것은 최초의 폴라로그램으로 여겨졌다.이 과정을 용이하게 하기 위해 그는 현재 폴라로그래프로 알려진 것을 M으로 구성했다.시카타와 함께 몇 시간 안에 같은 곡선을 사진처럼 기록할 수 있게 되었다.그는 잠재력과 그 통제의 중요성을 인식했고 제한 전류를 측정할 기회도 인식했다.그는 또한 현대의 도구로서 수은 전극을 떨어뜨리는 것을 도입하는 데 중요한 역할을 했다.[8]
1942년 영국의 전기 화학자 아치 히클링(레스터 대학)이 전기화학 분야의 진보였던 최초의 3개의 전극 전위차트를 만들었다.[9]그는 전극의 전압을 조절하기 위해 이 전위차트를 사용했다.그러던 중 1940년대 후반 미국의 생물 물리학자인 케네스 스튜어트 콜이 전압 클램프라고 부르는 전자 회로를 발명했다.전압 클램프는 신경의 이온 전도를 분석하는 데 사용되었다.[10]
1960년대와 1970년대는 이론, 계측, 컴퓨터 추가 및 제어 시스템의 도입에 있어서 많은 발전을 보았다.수은 전극에 대한 현대 폴라그래픽과 전압계 방법은 세 부분으로 나뉘었다.
첫 번째 섹션은 수은 전극의 개발을 포함한다.다음과 같은 전극이 생산되었다: 낙하 수은 전극, 매달려 있는 수은 드롭 전극, 정적 수은 드롭 전극, 수은 필름 전극, 수은 아말감 전극, 수은 마이크로 일렉트로이드, 화학적으로 변형된 수은 전극, 제어된 성장 수은 전극, 수축 가능한 수은 드롭 전기로데스의
사용된 측정 기법의 발전도 있었다.이러한 측정 기법에는 고전 DC 극지방법, 오실도폴로그래피, 쿨섹스 스위처, AC 극지방법, 맛 극지방법, 정상 펄스 극지방법, 차동 펄스 극지방법, 사각파 전압측정, 주기적 전압측정법, 양극 박리, 콘볼루션 기법 및 소거 방법이 포함된다.
마지막으로 수은 전극의 민감도를 높이는 선입견 기법의 발전도 있었다.이는 양극성 박토 전압측정법, 음극 박토 전압측정법 및 흡착성 박토 전압측정법의 개발을 통해 이루어졌다.[8]
이러한 발전은 감도를 향상시키고 새로운 분석 방법을 만들어냈으며, 이로 인해 산업계가 일상적인 분석 작업에 효과적으로 사용될 수 있는 값싼 전위차, 전극 및 세포의 생산으로 대응하게 되었다.
적용들
전압계 센서
산업과 연구에 관심이 있는 특정 종의 결정을 위해 상업적으로 많은 전압계통이 생산된다.이 장치들은 때때로 전극이라고 불리기도 하지만 사실 완전한 전압계 세포로 센서라고 더 잘 언급된다.이러한 센서는 다양한 매트릭스의 다양한 유기물 및 무기물 분석 물질 분석에 사용할 수 있다.[11]
산소 전극
해수, 혈액, 하수, 화학 공장의 유출물과 토양과 같은 다양한 수성 환경에서 용존 산소의 결정은 산업, 생물의학 및 환경 연구, 임상 의학에 매우 중요하다.그러한 측정을 위한 가장 보편적이고 편리한 방법 중 하나는 L.C.에서 특허를 얻은 클라크 산소 센서로 하는 것이다. 1956년 클라크 주니어
참고 항목
참조
- ^ Kissinger, Peter; William R. Heineman (1996-01-23). Laboratory Techniques in Electroanalytical Chemistry, Second Edition, Revised and Expanded (2 ed.). CRC. ISBN 0-8247-9445-1.
- ^ Zoski, Cynthia G. (2007-02-07). Handbook of Electrochemistry. Elsevier Science. ISBN 0-444-51958-0.
- ^ Harris, Daniel C. (2016-01-01). Quantitative Chemical Analysis, Ninth Edition (9 ed.). W.H. Freeman and Company. ISBN 978-1-4641-3538-5.
- ^ Bard, Allen J.; Larry R. Faulkner (2000-12-18). Electrochemical Methods: Fundamentals and Applications (2 ed.). Wiley. ISBN 0-471-04372-9.
- ^ Gritzner, G.; J. Kuta (1984). "Recommendations on reporting electrode potentials in nonaqueous solvents". Pure Appl. Chem. 56 (4): 461–466. doi:10.1351/pac198456040461. Retrieved 2009-04-17.
- ^ Nicholson, R. S.; Irving. Shain (1964-04-01). "Theory of Stationary Electrode Polarography. Single Scan and Cyclic Methods Applied to Reversible, Irreversible, and Kinetic Systems". Analytical Chemistry. 36 (4): 706–723. doi:10.1021/ac60210a007.
- ^ 코우나브스, 사무엘"Voltammetric Technologies".터프츠 대학교 화학과
- ^ a b Barek, J. (2003). "Eighty Years of Polarography - History and Future". Electroanalysis. 15: 467–472.
- ^ Hickling, A. (1942). "Studies in electrode polarisation. Part IV.-The automatic control of the potential of a working electrode". Transactions of the Faraday Society. 38: 27–33. doi:10.1039/TF9423800027.
- ^ Jackson E. Harrar (2013). "The potentiostat and the voltage clamp" (PDF). electrochem.org. Retrieved 2021-12-15.
- ^ Sanghavi, Bankim; Srivastava, Ashwini (2010). "Simultaneous voltammetric determination of acetaminophen, aspirin and caffeine using an in situ surfactant-modified multiwalled carbon nanotube paste electrode". Electrochimica Acta. 55: 8638–8648. doi:10.1016/j.electacta.2010.07.093.
추가 읽기
- Reinmuth, W. H. (1961-11-01). "Theory of Stationary Electrode Polarography". Analytical Chemistry. 33 (12): 1793–1794. doi:10.1021/ac60180a004.
- Skoog, Douglas A.; Donald M. West; F. James Holler (1995-08-25). Fundamentals of Analytical Chemistry (7th ed.). Harcourt Brace College Publishers. ISBN 0-03-005938-0.
- Zanello, P. (2003-10-01). Inorganic Electrochemistry: Theory, Practice, and Application (1 ed.). Royal Society of Chemistry. ISBN 0-85404-661-5.