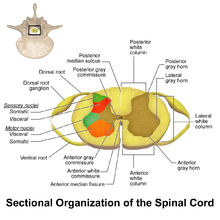
와이드 다이나믹 레인지 뉴런
Wide dynamic range neuron넓은 동적 범위(WDR) 뉴런은 1966년 멘델에 의해 처음 발견되었다.[1]이 뉴런에 대한 초기 연구는 통증의 관문 조절 이론이라고 알려진 것을 확립했다.기본 개념은 비통증 자극이 고통 자극의 경로를 차단해 가능한 고통 반응을 억제한다는 것이다.[2]이 이론은 WDR 뉴런이 고통스러운 자극과 고통스럽지 않은 자극에 대한 반응을 모두 담당한다는 사실과, 이 뉴런들이 이러한 반응들 중 하나 이상을 동시에 만들어낼 수 없다는 생각이 뒷받침했다.WDR 뉴런은 모든 종류의 섬모센서리 자극에 반응하며, 후회색 컬럼에서 발견되는 뉴런의 대부분을 차지하고, 통증과 가려움증을 일으키는 사람들을 포함한 장거리 반응을 만들어 내는 능력을 가지고 있다.
해부학과 생리학
WDR 뉴런은 척수의 후회색 기둥에서 발견된다.척수의 이 부위는 통증 과정에 관여하는 두 가지 다른 종류의 뉴런을 포함하고 있다: WDR 뉴런과 nociceptive 특정 뉴런(NS)이다.[3]이름에서 알 수 있듯이 NS 뉴런은 특정한 단거리 반응을 준다.[4]WDR 뉴런은 다양한 자극에 대해 장거리 반응을 제공할 수 있어 고통스러운 자극(감각적 차별)의 위치와 강도를 파악하는 데 도움을 줄 수 있다.[3][5]
WDR 뉴런은 소위 '윈드업'이라고 불리는 것을 경험하도록 이론화되었다는 점에서 대부분의 다른 뉴런들과 다르다.이것은 자극의 빈도가 증가함에 따라 반응의 강도가 증가하도록 허용한다.[6]대부분의 다른 뉴런들은 자극 강도의 증가에 대한 반응과 같은 규모의 반복적인 작용 전위를 발사한다.자극의 강도는 행동 전위의 빈도를 증가시킬 뿐 그 크기는 증가시키지 않을 것이다.그러나 WDR 뉴런은 자극의 더 많은 발현과 함께 작용 전위 강도를 나타낸다.[6]이것은 시냅스의[6] 가소성을 허용하고 뉴런 반응에 유연성을 발생시킨다.비록 이것이 유기체에 어느 정도 도움이 될 수 있지만, 뉴런의 과도한 흥분은 만성적인 고통을 초래할 수 있다.[3]
통증 반응의 역할
고통스러운 자극이 있을 때 취할 수 있는 길은 두 가지다.라미나 1의 nociceptive 뉴런이 손상되거나 WDR 뉴런이 손상된다.[7]WDR 뉴런은 전기, 기계, 열 자극에 반응할 수 있다.[8]등줄은 불완전한 가소성을 가지고 있어 신경손상 후 신경성 통증의 발달을 촉진한다.이렇게 하면 앞서 논의한 과잉 흥분으로 만성적인 통증을 유발할 수 있다.[9]WDR 뉴런의 독특한 통증 경로를 통해 자극에 대한 정보를 감각적 차별을 통해 고통의 강도를 파악할 수 있다.
우리가 우리 몸에서 경험하는 고통에는 크게 두 가지 유형이 있는데, 그것은 신체 조직의 손상에 의한 고통과 신경 손상에 의한 통증이다.난치성 통증은 조직 손상에 대한 경고나 신호 역할을 하며 신체의 평형과 기능성을 보존하는 작용을 한다.이 고통은 말초신경계와 중추신경계의 상호작용으로 신호된다.[10]신경성 통증으로 알려진 또 다른 형태의 통증은 중추신경계의 신경에 영향을 미치는 직접적인 문제나 질병에 의해 발생한다.[10]
만성 신경성 통증으로 알려진 이 신경성 통증의 부분집합은 오래 지속되고 높은 통증 강도로 특징지어진다.이 만성적인 고통의 직접적인 원인에 대해서는 아직 많이 알려져 있지 않지만, WDR 뉴런과 연결되어 있다.이러한 뉴런들은 교감 자극에 의해 상당한 활성화를 보이는 반면 NS 뉴런과 같은 뉴런들은 같은 수준의 활성화를 보이지 않는다.[11]교감 경로의 차단은 통증을 감소시키는 듯했고 일단 막히지 않으면 고통의 증상이 지속되었다.이는 이러한 신경병적 만성통증에 기여하는 여러 가지 복잡한 메커니즘 중 하나가 교감 자극에 의한 WDR 뉴런의 과잉 자극이라는 것을 나타낸다.[10]
신경병통에서 역할을 하는 또 다른 측면은 TRPA1이라고 불리는 과도수용체 채널이다.이 통로는 만성적인 통증 부상과 염증, 당뇨병, 섬유질, 기관지염, 폐기종 등의 질환에 영향을 미친 것으로 알려져 있다.[12]WDR 뉴런은 체내 감각 변화를 기반으로 신호를 주고받는 데 도움을 주는 섬모센서리 시스템의 큰 부분이다.TRPA1 채널은 일차적 감각 신경세포의 온도와 통증 감각과 밀접하게 연관되어 왔으며 등근성 신경세포의 nociceptive 감각 신경세포에서 주로 발견된다.[13]TRPA1의 억제는 통증 및 과민성을 증폭시켜 다른 염증성 질환과 신경성 질환의 원인이 되는 것으로 알려져 있다.[12]이는 WDR 뉴런이 역할을 하는 감각 반응에 관여하는 만성 염증성 질환과 신경성 질환의 대상화 및 통제 측면을 지속적으로 연구하고 학습하는 데 유익한 연구 분야다.
가려움 반응의 역할
또한 가려움과 통증 경로가 밀접하게 연관되어 있기 때문에 가려움 경로도 WDR 뉴런과 연결되어 있다.통증 경로에 과도 수용 채널이 존재하기 때문에 가려운 경로에도 존재한다.가려움 경로에서 과도 수용체 채널이 활성화되면 가려움 반응을 이끌어낼 수 있다.가려움 반응은 통증처럼 온도 변화(너무 높거나 너무 낮음)에 의해 조절될 수도 있다.이 조절 메커니즘은 자극이 극도로 낮거나 극도로 높은 온도에 있을 때 발생한다.자극에 대한 유기체의 민감성은 증가하는데, 이는 도출된 통증이나 가려움증이 상온보다 그 온도에서 더 크다는 것을 의미한다.[14]이러한 경로들은 많은 유사점을 나타내지만, 신경 성장 인자와 물질-P를 통한 것과 같이 가려운 감각을 조절할 수 있는 다른 메커니즘이 있다.[15]
뇌 영상촬영은 가려움과 통증 부위가 활성화되었을 때 전두엽, 보조 운동 부위, 전전두피질, 전두내피질 등 뇌의 많은 부분에서 유사한 활동을 나타낸다.[13]이 두 경로를 더 잘 이해하면 WDR 뉴런에 대한 이해도가 높아질 것이다.
참조
- ^ Mendell, L. M. (1966-11-01). "Physiological properties of unmyelinated fiber projection to the spinal cord". Experimental Neurology. 16 (3): 316–332. doi:10.1016/0014-4886(66)90068-9. ISSN 0014-4886. PMID 5928985.
- ^ Meyerson, Björn A.; Linderoth, Bengt (2006-04-01). "Mode of action of spinal cord stimulation in neuropathic pain". Journal of Pain and Symptom Management. 31 (4 Suppl): S6–12. doi:10.1016/j.jpainsymman.2005.12.009. ISSN 0885-3924. PMID 16647596.
- ^ a b c Zhang, Tianhe (June 20, 2014). "Mechanisms and Models of Spinal Cord Stimulation for the Treatment of Neuropathic Pain". Brain Research. 1569: 19–31. doi:10.1016/j.brainres.2014.04.039. PMID 24802658.
- ^ West, S.J. (August 6, 2015). "Circuitry and Plasticity of the Dorsal Horn - Toward a Better Understanding of Neuropathic Pain". Neuroscience. 300: 254–275. doi:10.1016/j.neuroscience.2015.05.020. PMID 25987204.
- ^ Craig, A.D. (March 6, 2017). "Pain Mechanisms: Labeled Lines Versus Convergence in Central Processing". Annual Review of Neuroscience. 26: 1–30. doi:10.1146/annurev.neuro.26.041002.131022. PMID 12651967.
- ^ a b c D'Mello, R.; Dickenson, A. H. (2008-07-01). "Spinal cord mechanisms of pain". British Journal of Anaesthesia. 101 (1): 8–16. doi:10.1093/bja/aen088. ISSN 0007-0912. PMID 18417503.
- ^ Inui, Koji (2012-11-01). "[Pain pathway]". Brain and Nerve = Shinkei Kenkyu No Shinpo. 64 (11): 1215–1224. ISSN 1881-6096. PMID 23131731.
- ^ Lynn, R. B. (1992-05-27). "Mechanisms of esophageal pain". The American Journal of Medicine. 92 (5A): 11S–19S. doi:10.1016/0002-9343(92)80051-z. ISSN 0002-9343. PMID 1595755.
- ^ West, S. J.; Bannister, K.; Dickenson, A. H.; Bennett, D. L. (2015-08-06). "Circuitry and plasticity of the dorsal horn--toward a better understanding of neuropathic pain". Neuroscience. 300: 254–275. doi:10.1016/j.neuroscience.2015.05.020. ISSN 1873-7544. PMID 25987204.
- ^ a b c Nickel, Florian T.; Seifert, Frank; Lanz, Stefan; Maihöfner, Christian (2012-02-01). "Mechanisms of neuropathic pain". European Neuropsychopharmacology. 22 (2): 81–91. doi:10.1016/j.euroneuro.2011.05.005. ISSN 0924-977X. PMID 21672666.
- ^ Roberts, W. J.; Foglesong, M. E. (1988-09-01). "Spinal recordings suggest that wide-dynamic-range neurons mediate sympathetically maintained pain". Pain. 34 (3): 289–304. doi:10.1016/0304-3959(88)90125-x. ISSN 0304-3959. PMID 3186277.
- ^ a b Garrison, Sheldon R.; Stucky, Cheryl L. (2017-04-09). "The Dynamic TRPA1 Channel: A Suitable Pharmacological Pain Target?". Current Pharmaceutical Biotechnology. 12 (10): 1689–1697. doi:10.2174/138920111798357302. ISSN 1389-2010. PMC 3884818. PMID 21466445.
- ^ a b Akiyama, Tasuku; Carstens, E. (2013-10-10). "Neural processing of itch". Neuroscience. 250: 697–714. doi:10.1016/j.neuroscience.2013.07.035. ISSN 0306-4522. PMC 3772667. PMID 23891755.
- ^ Patapoutain, Ardem (January 8, 2009). "Transient Receptor Potential Channels: Targeting Pain at the Source". Nat Rev Drug Discov. 8 (1): 55–68. doi:10.1038/nrd2757. PMC 2755576. PMID 19116627.
- ^ Lucaciu, Octavian C.; Connell, Gaelan P. (2013-07-01). "Itch sensation through transient receptor potential channels: a systematic review and relevance to manual therapy". Journal of Manipulative and Physiological Therapeutics. 36 (6): 385–393. doi:10.1016/j.jmpt.2013.05.018. ISSN 1532-6586. PMID 23896168.