4+4 포토 사이클 로드
4+4 Photocycloaddition[4+4] 광시클로디션은 두 개의 불포화 분자가 각 분자의 4개의 원자를 통해 연결되어 8개의 원소로 이루어진 고리를 만드는 순환 로드디션 반응이다.광화학 반응으로서, 이것은 열처리가 아닌 어떤 형태의 빛에 의해 촉진된다.
서론
[4+4] 광환산 치환의 가장 초기 [1]예는 1936년에 발견된 안트라센의 광다이머화였다.이 반응은 가장 신뢰할 수 있는 광환산 상태 중 하나로 남아 있으며 지속적인 [2]조사의 기초가 되고 있습니다.
다른 다환방향족제는 아크리지늄염과 같은 안트라센 유사 광환산 치환을 겪는다.생물학적으로 활성화된 천연물은 플리우로무틸린, 칼마놀, 크레눌라이드 및 롱지페놀을 포함한다.
사이클로옥타노이드 시스템 생성에 대한 [4+4] 광사이클로드 디케이션 접근방식은 비교적 단순한 4개의 탄소 조각에서 8원 링의 수렴 조립, 2개의 새로운 탄소-탄소 결합의 형성, 최대 4개의 새로운 스테레오 센터를 [3]한 번에 도입할 수 있는 가능성을 포함한 여러 가지 매력적인 특징을 제공한다.
메커니즘 및 입체화학
일반적인 메커니즘
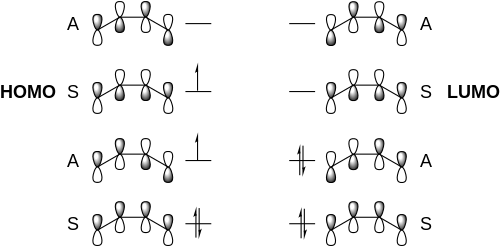
[4+4] 반응은 지면 상태에서 금지되며 종종 흥분 [4]상태에서 장내적으로 거부된다.[4+4] 광사이클로드 디케이션의 메커니즘은 1,3-디엔 시스템을 들뜬 상태로 광 들뜸하는 것부터 시작할 것을 제안한다.들뜬 디엔 중 가장 높은 점유율 분자궤도(HOMO)의 궤도대칭은 다른 지면 상태 디엔의 가장 낮은 점유율 분자궤도(LUMO)의 궤도대칭과 같기 때문에 이들은 붕괴하여 닫힌 시클로옥탄 고리 구조를 형성할 수 있다.아래는 디엔의 두 분자 사이의 상호작용을 나타내는 프런티어 분자 궤도도이다.
입체화학
[4+4] 반응 내 입체화학적 제어는 일반적이지 않지만 존재한다.에놀-엑소 입체선택성은 특정 가교 기술을 사용하여 가능하며 중간 정도의 [5]성공을 거두었다.
기존의 스테레오 센터를 사용하여 새롭게 확립된 브릿지 헤드 센터에서의 구성을 제어하는 것은 하나의 특수한 [6]예를 제외하고 대부분 성공하지 못했습니다.
모의 응용 프로그램
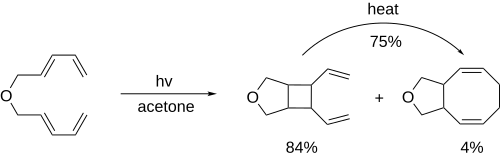
[4+4] 광사이클로드디지션은 [2+2] 사이클로드디지션과의 경쟁으로 인해 적용하기 어렵습니다.그러나 접근 가능한 경우, 이 방법은 Taxol[7] 및 후시코신 계열의 [8]분자에 대한 제안된 합성에서 볼 수 있듯이 복잡한 스테레오 센터와 구조를 가진 8원환을 한 번에 구축하는 데 사용될 수 있다.또한, 이 반응이 먼저 융합 고리를 형성하지만, 후속 분열은 매크로 [9]사이클을 제공할 수 있습니다.
Taxol의 BC 고리의 이 부분 합성에서 프레임워크 구축은 비교적 선형적이고 단순한 2-피리돈 유도체의 분자 내 [4+4] 광사이클로드디션을 사용하여 C3, C8 및 C15에서 정확한 입체 화학로 원하는 융합 고리(오른쪽의 Taxol과 비교)와 AC 고리의 두 개의 이중 결합으로 접었다.셉트 트랜스포머결과적으로 락탐-링 개방과 기능화가 Taxol을 제공할 것으로 기대되었다.
마찬가지로, 5-8-5 고리 시스템을 특징으로 하는 푸시코신 계열의 분자는 이 반응을 사용하여 빠르게 구성될 수 있다.트랜스 이성질체를 형성하기 위한 이 반응의 높은 입체선택성으로 인해 특정 표적 분자에 적합하지 않지만, 4개의 3차 키랄 중심을 만드는 일반적인 용이성은 여전히 주목할 만하다.
[4+4] 광원환의 사용은 8원링의 생성에 한정될 필요는 없다.링 네트워크를 연결하고 공유 본드를 끊음으로써 스테레오 센터가 내장된 단일 매크로 사이클을 달성할 수 있었습니다.
제한 사항
필연적으로 [4+4] 광환산 상태는 [2+2] 광환산 조건의 부작용을 수반한다.그러나 이러한 반응은 가역적이기 때문에 열역학적 [10]제어를 통해 가장 안정적인 생성물이 형성될 수 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ Fieser, Louis F.; Lothrop, Warren C. (1936). "The Structure of Anthracene". J. Am. Chem. Soc. 58: 749–753. doi:10.1021/ja01296a016.
- ^ Heiko, I.; Luo, J. (2008). "The reversible [4 + 4] photocycloaddition of acridizinium derivatives". J. Photochem. Photobiol. A. 200: 3–9. doi:10.1016/j.jphotochem.2008.04.008.
- ^ Zhu, M.; Qiu, Z.; Hiel, G.; Sieburth, S. (2002). "Photocycloaddition of Four-Carbon-Tethered Pyridones. Intramolecular Hydrogen Bonding and Facilitated Amide Hydrolysis by a Proximal Secondary Alcohol". J. Org. Chem. 67: 3487–3493. doi:10.1021/jo025565n.
- ^ Wender, P.; Smith, T. (1998). "Transition Metal-Catalyzed Intramolecular [4+2] Cycloadditions: Mechanistic and Synthetic Investigations". Tetrahedron. 54: 1255–1275. doi:10.1016/S0040-4020(97)10223-X.
- ^ Lei, L.; Benderb, J.; West F. G. (2009). "Diastereocontrol in [4+4]-photocycloadditions of pyran-2-ones: effect of ring substituents and chiral ketal". Tetrahedron Lett. 50: 1188–1192. doi:10.1016/j.tetlet.2008.12.117.
- ^ Song, D.; McDonald, R.; West, F. G. (2006). "Diastereoselective [4 + 4]-photocycloaddition reactions of pyran-2-ones: rapid access to functionalized 5-8-5 skeletons". Org. Lett. 8: 4075–4078. doi:10.1021/ol061576h.
- ^ Lee, Y.-G.; McGee, K. F.; Chen, J.; Rucando, D.; Sieburth, S. McN. (2000). "A [4 + 4] 2-Pyridone Approach to Taxol. 3. Stereocontrol during Elaboration of the Cyclooctane". J. Org. Chem. 65: 6676–6681. doi:10.1021/jo005532c.
- ^ McGee, K. F.; Al-Tel, T. H.; Sieburth, S. McN. (2001). "Fusicoccin Synthesis by Intramolecular [4+4] Photocycloaddition of 2-Pyridones: Stereocontrol of the Cycloaddition and Elaboration of the Pentacyclic Product". Synthesis. 112: 1185–1196. doi:10.1055/s-2001-15066.
- ^ Sieburth, S. McN.; Al-Tel, T. H.; Rucando, D. (1997). "Beyond the medium ring: A [4 + 4] Cycloaddition/Fragmentation Synthesis of Eleven-membered Rings". Tetrahedron Lett. 38: 8433–8434. doi:10.1016/S0040-4039(97)10272-6.
- ^ Sieburth, S. McN.; Cunard, N. T. (1996). "The [4 + 4] cycloaddition and its strategic application in natural product synthesis". Tetrahedron. 52: 6251–6282. doi:10.1016/0040-4020(95)01077-7.