부신종양
Adrenal tumor| 부신종양 | |
|---|---|
 | |
| 부신종양의 발병 및 예후.[1] | |
| 전문 | 종양학 |
부신종양 또는 부신질량은[2] 부신의 양성 또는 악성 종양이며, 그 중 몇 가지는 내분비 호르몬을 과다 분비하는 경향으로 두드러진다.부신암은 악성 부신종양의 존재로 신경블라스토마, 부신피질암, 일부 부신피로모세포종을 포함한다.대부분의 부신 페오크로모사이토마스와 모든 부신피질 아데노마스는 양성종양인데, 양성종양은 전이되거나 인근 조직을 침범하지는 않지만, 균형이 맞지 않는 호르몬으로 상당한 건강 문제를 일으킬 수 있다.
부신측 전이
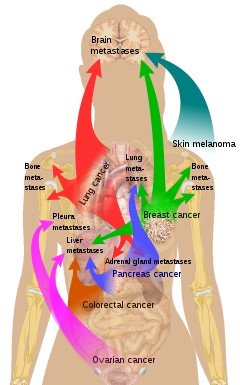
한 부신 또는 두 부신 모두에 대한 전이(metastasis)는 악성 부신 병변의 가장 흔한 형태이며, 양성 아데노마 다음으로 두 번째로 흔한 부신종양이다.[4]이 경우 1차 종양은 폐암(39%), 유방암(35%), 악성 흑색종, 위장암, 췌장암, 신장암 등이 가장 흔하다.[4]
부신피질의 종양
부신 피질은 중요한 스테로이드 호르몬을 생성하는 세 개의 뚜렷한 내분비 세포 층으로 구성되어 있다.여기에는 혈당과 면역계통 조절에 중요한 글루코코르티코이드와 생리학적 스트레스에 대한 반응, 혈압과 신장 기능을 조절하는 미네랄코르티코이드 알도스테론, 특정 성호르몬 등이 포함된다.부신피질의 양성종양과 악성종양 모두 스테로이드 호르몬을 생성해 중요한 임상적 결과를 초래할 수 있다.[citation needed]
부조류성 선종
부신성 아데노마(adrenocortic adenomas)는 부신피질의 양성종양으로 극히 일반적이다(부검시 사람의 1-10%에 존재한다).그들은 진정한 신엽이 아닌 부신피질적"결절"과 혼동해서는 안 된다.부신성 아데노마(adrenocortic adenomas)는 30세 미만의 환자에게서는 드물게 나타나며, 남녀 모두 동일한 발병률을 보인다.[citation needed]이 신엽의 임상적 의미는 두 가지다.첫째, 다양한 의학적 환경에서 CT 스캔과 자기공명영상 사용이 증가함에 따라 최근 몇 년간 빈도가 증가하면서 부수적인 발견으로 감지되고 있다.이는 초기 부신암 발생 가능성을 약간 배제하기 위한 값비싼 추가 검사 및 침습적 절차로 이어질 수 있다.둘째, 부신성 아데노마 중 소수(약 15%)는 '기능적'으로, 이는 글루코코르티코이드, 미네랄코르티코이드 및/또는 성 스테로이드를 생산하여 쿠싱증후군, 콘증후군(하이페랄도스테론증후군), 여성의 남성화, 남성의 여성화 등의 내분비장애를 일으킨다는 것을 의미한다.기능 부신성 아데노마는 수술로 치료할 수 있다.[citation needed]
대부분의 부신성 아데노마들은 최대 치수가 2cm 미만이고 무게는 50g 미만이다.그러나 부신 피질 종양의 크기와 무게는 더 이상 양성이거나 악성인 것으로 믿을 만한 징후로 간주되지 않는다.심각하게, 부신성 아데노마들은 단단하고 동질적인 노란색으로 잘 깎인 표면을 가진, 잘 둘러싸인, 독방종양이다.괴사와 출혈은 흔치 않은 발견이다.[citation needed]
부항암
부신피질암(ACC)은 희귀하고 매우 공격적인 부신피질세포의 암으로, 어린이나 성인에게서 발생할 수 있다.ACC는 스테로이드 호르몬과 그에 따른 내분비 기능 장애를 일으키는 "기능적"일 수도 있지만, 많은 것들은 그렇지 않다.복막 깊숙한 곳에 위치하기 때문에 대부분의 부신성 발암들은 꽤 크게 자랄 때까지 진단되지 않는다.그들은 종종 신정맥과 하대정맥과 같은 큰 혈관을 침범하고 림프계를 통해 혈액을 통해 폐와 다른 장기로 전이한다.비록 이것이 많은 환자에게는 실현 가능하지 않고, 병의 전반적인 예후가 좋지 않지만 가장 효과적인 치료법은 수술이다.화학요법, 방사선요법, 호르몬요법도 이 질환의 치료에 이용될 수 있다.[citation needed]
부신질서의 종양
부신 메둘라는 각 부신의 중심에 해부학적으로 위치하며, 교감신경계의 활성화에 대응하여 에피네프린(아드레날린)을 생성하여 혈류로 방출하는 신경내분비(크로마핀) 세포로 구성되어 있다.신경블라스토마와 페로크로모시토마는 부신성질에서 발생하는 가장 중요한 두 종양이다.두 종양 모두 특히 교감 사슬의 파라간글리아에서 외부 아드레날린 부위에서 발생할 수도 있다.[citation needed]
신경블라스토마
신경블라스토마는 미성숙 신경탄성세포(신경세포의 전구)의 공격성 암으로 진단시 중위연령이 2년으로 가장 흔한 소아암 중 하나이다.[5]부신신경블라스토마는 전형적으로 복부 덩어리가 급격하게 커진다.진단 당시 종양이 신체의 먼 부위까지 전이된 경우가 많았지만, 간, 피부, 골수(IVS기)로 전이될 때 치료 가능성이 높은 경우가 많다는 점에서 이 암은 이례적이다.관련성이 있지만 보다 성숙된 신경세포로 구성된 덜 공격적인 종양에는 갱년기 유러블라스토마, 갱년기 등이 있다.신경성 종양은 바닐리만델산(VMA)이나 호모바닐산 등 카테콜아민 호르몬 대사물의 수치가 높아지는 경우가 많으며, 혈관활성 장 펩타이드 생산을 통해 심한 물설사를 일으킬 수 있다.신경블라스토마 치료는 국소성 질환에 대한 수술과 방사선 치료, 전이성 질환에 대한 화학요법 등이 있다.[6]
페로크로모시토마
페로크로모시토마(Pherochromocytoma)는 성숙한 부신 메둘라의 크로마핀 세포와 유사한 세포로 구성된 신엽종이다.페로크로모시토마스는 모든 연령의 환자에게서 발생하며 산발적이거나 다발성 내분비신종양(MEN) 타입 IIA 및 IIB, 신경섬유화증 타입 I, 폰 히펠 린다우 증후군 등 유전성 암 증후군과 관련이 있을 수 있다.부신 페로모사이토마 중 10%만이 악성종양인 반면 나머지는 양성종양이다.페로크로모시토마스의 임상적으로 가장 중요한 특징은 카테콜아민 호르몬 에피네프린(아드레날린)과 노르에피네프린(Norepinephrine)을 다량 생산하는 경향이다.이로 인해 잠재적으로 생명을 위협하는 고혈압, 즉 심근경색, 두통, 두근거림, 불안감, 땀, 체중감량, 떨림 등의 수많은 증상이 나타날 수 있다.진단은 VMA, 메타네프린 등 카테콜아민 대사물의 비뇨기 측정을 통해 가장 쉽게 확인된다.대부분의 페로크로모사이토마스는 초기에 카테콜아민 과부하로부터 보호하기 위해 항아드레날린 약물로 치료되는데, 일단 환자가 의학적으로 안정되면 종양을 제거하기 위해 수술을 한다.[7]
부차적인 동물
부신부전종은 임상 증상이나 의심 없이 우연에 의해 발견되는 부신종양이다.컴퓨터단층촬영(CT)이나 자기공명영상(MRI) 또는 초음파 검사에서 흔히 발견되는 예상치 못한 발견 중 하나이다.[8]
이 경우 덱사메타손 억제 테스트는 코티솔 과다 검출에, 메타네페린이나 카테콜아민 과다 검출에 자주 사용된다.일반적으로 3cm 미만의 종양은 양성종양으로 간주되며 쿠싱 증후군이나 페로크로모시토마 진단 근거가 있는 경우에만 치료된다.[9]방사선확대성은 악성종양 위험을 추정하는데 실마리를 제공하는데, 강화되지 않은 CT에서 10 Hounsfield 유닛 이하가 있는 종양은 아마도 지질 함량이 높은 선종일 것이다.[10]호르몬 평가는 다음을 포함한다.[11]
CT 스캔에서 양성 아데노마는 일반적으로 방사선 밀도가 낮으며(지방 함량 때문에) 조영제가 빠르게 배출되는 것으로 나타났다(대조도 매체의 50% 이상이 10분 동안 세척됨).호르몬 평가가 부정적이고 영상촬영에서 양성 반응이 나온다면 6, 12, 24개월의 영상촬영으로 사후관리를 고려하고 4년간[11] 매년 호르몬 평가를 반복해야 한다.
참조
- ^ 파이 차트에 대한 데이터와 참조는 Wikimedia Commons의 파일 설명 페이지에 있다.
- ^ Perappadan, Bindu Shajan. "Doctors remove 'world's largest adrenal tumour'". The Hindu. Retrieved 2017-02-23.
- ^ 포함된 항목 및 참조 목록은 Commons의 기본 이미지 페이지에서 찾을 수 있다.파일:일반 암에 대한 전이 사이트.svg
- ^ a b Shashank R. Cingam; Harsha Karanchi. "Cancer, Adrenal Metastasis". StatPearls at National Center for Biotechnology Information. Last Update : 2019년 1월 20일.
- ^ "Neuroblastoma". The Lecturio Medical Concept Library. Retrieved 11 August 2021.
- ^ Saab, S.T.; MacLennan, G.T. (2015). "Adrenal Cortical Neoplasms: Perspectives in Pediatric Patients". In Santulli, Gaetano (ed.). Adrenal Glands: From Pathophysiology to Clinical Evidence. Nova Science. ISBN 978-1-63483-550-3.
- ^ Lenders JW, Eisenhofer G, Mannelli M, Pacak K (20–26 August 2005). "Phaeochromocytoma". Lancet. 366 (9486): 665–75. doi:10.1016/S0140-6736(05)67139-5. PMID 16112304. S2CID 208788653.
- ^ Arnold DT, Reed JB, Burt K (January 2003). "Evaluation and management of the incidental adrenal mass". Proc (Bayl Univ Med Cent). 16 (1): 7–12. doi:10.1080/08998280.2003.11927882. PMC 1200803. PMID 16278716.
- ^ Grumbach MM, Biller BM, Braunstein GD, et al. (2003). "Management of the clinically inapparent adrenal mass ("incidentaloma")". Ann. Intern. Med. 138 (5): 424–9. doi:10.7326/0003-4819-138-5-200303040-00013. PMID 12614096. S2CID 23454526.
- ^ Willatt, Jonathon M.; Francis, Isaac R. (2010). "Radiologic Evaluation of Incidentally Discovered Adrenal Masses". Am Fam Physician. 81 (11): 1361–6. PMID 20521756.
- ^ a b Young WF (2007). "Clinical practice. The incidentally discovered adrenal mass". N. Engl. J. Med. 356 (6): 601–10. doi:10.1056/NEJMcp065470. PMID 17287480.
추가 읽기
- Adrenal Glands: From Pathophysiology to Clinical Evidence. New York, NY: Nova Science. 2015. ISBN 978-1-63483-570-1.
- Ramzi Cotran; Vinay Kumar; Tucker Collins (1999). Robbins Pathologic Basis of Disease (Sixth ed.). W.B. Saunders. ISBN 978-0-7216-7335-6.
- Richard Cote; Saul Suster; Lawrence Weiss (2003). Noel Weidner (ed.). Modern Surgical Pathology (2 Volume Set). London: W B Saunders. ISBN 978-0-7216-7253-3.


