알칼리 금속 질산염
Alkali metal nitrate알칼리 금속 질산염은 알칼리 금속(리튬, 나트륨, 칼륨, 루비듐, 세슘)과 질산 이온으로 구성된 화학 화합물이다. 나트륨과 칼륨 염 등 상업적 가치가 큰 두 가지밖에 없다.[1] 159°C의 비교적 좁은 범위에 한해 255°C(LiNO
3)에서 414°C(CsNO
3)까지의 용해점을 가진 백색 수용성 소금이다.[2]
| 화합물 | 케미컬 포뮬러 | 어금니 질량 | 멜팅 포인트 | 구조 |
|---|---|---|---|---|
| 질산 리튬 | 리노3 | 68.946 g/190 | 255°C(491°F, 528K) |  |
| 질산나트륨 | NANO3 | 84.9947 g/190 | 308°C(586°F, 581°K ) | 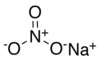 |
| 질산칼륨 | 크노3 | 101.1032 g/190 | 334°C(633°F, 607K) |  |
| 질산 루비듐 | RbNO3 | 147.473 g/1973 g/1973 | 310°C(590°F, 583K) |  |
| 질산 세슘 | CsNO3 | 194.91 g/190 | 414°C(777°F, 687K) |  |
알칼리 금속 질산염의 용해점은 알칼리 금속의 원자 질량과 이온 반지름(나체 양이온)이 증가하여 기둥으로 내려가면서 255 °C에서 414 °C로 증가하는 경향이 있다. 마찬가지로, 그러나 여기 표에 제시되지 않은, 물 속의 이러한 염의 용해성은 또한 금속의 원자 질량에 따라 감소한다.
적용들
나트륨과 질산칼륨은 일반적으로 비료로 사용된다. 또한 강한 산화제인 만큼 폭약 성분과 폭발물 제조에 들어간다.[1]
작은 용도는 불꽃놀이에서 방출되는 빛을 색칠하는 데 사용된다.[3]
일반적으로 멘델레예프의 주기율표에 있는 알칼리성 금속 기둥에 내려갈 때 방출된 색은 가시광선 스펙트럼에서 붉은색에서 보라색으로 점진적으로 변한다. 고온에서 가져온 원자의 전자 분해 단계에서 방출되는 빛의 파장 감소에 해당한다. 세슘이 방출하는 광자는 리튬의 이들보다 더 활력이 있다.
참고 항목
참조
- ^ a b Laue, Wolfgang; Thiemann, Michael; Scheibler, Erich; Wiegand, Karl (2000). "Nitrates and Nitrites". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_265.
- ^ "Thermodynamic properties of molten nitrate salts" (PDF).
- ^ "Phantom Fireworks : Fireworks University : Pyrotechnic Compounds". Phantom Fireworks. Archived from the original on 2020-08-06. Retrieved 2016-10-16.



