아쿠아레지아
Aqua regia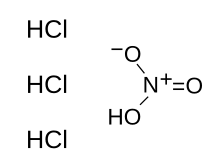 | |
| 이름 | |
|---|---|
| IUPAC 이름 염산질산 | |
기타 이름
| |
| 식별자 | |
3D 모델(JSmol) | |
PubChem CID | |
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| 특성. | |
| HNO3 + 3 HCl | |
| 외모 | 펄펄 끓는 액체.갓 만든 아쿠아레지아는 무색이지만 몇 초 안에 노란색, 오렌지색, 빨간색으로 변한다. |
| 밀도 | 1.01~1.21g/cm3 |
| 녹는점 | -42 °C (-44 °F, 231 K) |
| 비등점 | 108 °C (226 °F, 381 K) |
| 혼재 | |
| 증기압 | 21 mbar |
| 위험 요소 | |
| NFPA 704(파이어 다이아몬드) | |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |

아쿠아레지아(/ɪreəi,, ːriʒdəi;/, 라틴어로 "레갈 워터" 또는 "로열 워터")는 질산과 염산의 혼합물로, 최적의 몰비는 1:[note 2]3이다.아쿠아레지아는 발연성 액체입니다.새로 준비된 아쿠아 레지아는 무색이지만, 몇 초 안에 노란색, 오렌지색 또는 빨간색으로 변합니다. 연금술사들은 이것이 모든 금속은 아니지만 귀금속인 금과 백금을 녹일 수 있기 때문에 이런 이름을 붙였습니다.
준비 및 분해
농축염산과 농축질산을 혼합하면 화학반응이 일어난다.이러한 반응으로 인해 휘발성 생성물인 염화 니트로실 및 염소 가스가 발생합니다.
- HNO3 + 3 HCl → NOCl + Cl2 + 2 HO2
아쿠아레지아의 특징적인 노란색과 발연성으로부터 증명된다.휘발성 물질이 용액에서 빠져나가면서 아쿠아 레지아는 그 효력을 잃는다.염화니트로실(NOCl)은 산화질소(NO)와 원소염소(Cl2)로 분해될 수 있습니다.
- 2 NOCl → 2 NO + Cl2
이 해리는 균형에 제한이 있다.따라서 염화 니트로실 및 염소 외에도 아쿠아 레지아 위의 매연에는 일산화질소(NO)가 포함되어 있습니다.산화질소는 대기 산소와 쉽게 반응하기 때문에 생성되는 가스에는 이산화질소, NO2(적색 증기)도 포함되어 있습니다.
- 2 NO + O2 → 2 NO2
적용들
아쿠아 레지아는 주로 최고 품질의 금(99.999%)을 정제하기 위한 월윌 공정의 전해질인 클로로아우르산을 생산하는 데 사용됩니다.
Aqua Regia는 식각 및 특정 분석 절차에도 사용됩니다.또한 일부 실험실에서 유기 화합물 및 금속 입자의 유리 그릇을 청소하는 데 사용됩니다.스펙트럼을 손상시킬 [1]수 있는 상사성 크롬의 흔적이 남아 있지 않기 때문에 이 방법은 NMR 튜브 세척을 위한 전통적인 크롬산 욕조보다 대부분 선호된다.크롬의 높은 독성과 폭발 가능성 때문에 크롬산 욕조가 권장되지[according to whom?] 않는 반면, 아쿠아 레지아는 그 자체로 매우 부식성이 강하며 [2]취급 부주의로 인해 여러 번 폭발에 연루되었다.
아쿠아레지아는 성분 간의 반응으로 인해 분해가 일어나면서 효과가 급격히 떨어지기 때문에(강산인 채로 남아 있음) 성분들은 일반적으로 사용 직전에만 혼합된다.
지역 규정은 다를 수 있지만, 아쿠아 레지아는 싱크대에 쏟아지기 전에 신중하게 중화 처리하여 폐기할 수 있습니다.용해된 금속에 의한 오염이 있는 경우 중성화 용액을 수거하여 [3][4]폐기해야 합니다.
화학
녹는 금

아쿠아 레기아는 금을 분해하지만 두 성분 모두 단독으로 분해하지는 않습니다.질산은 강력한 산화제로, 사실상 검출할 수 없는 양의 금을 녹여 금 이온(Au)을3+ 형성합니다.염산은 금 이온과 반응하여 테트라클로로아우레이트(III) 음이온4([−AuCl])을 생성하는− 염화 이온(Cl)을 즉시 공급합니다.염산과의 반응은 테트라클로로아우레이트(II) 음이온 형성을 선호하는 평형 반응이다.그 결과 용액에서 금 이온이 제거되고 금의 산화가 더욱 진행됩니다.그 금은 녹아서 클로로아우르산이 된다.또한 금은 아쿠아 레지아에 존재하는 염소에 의해 용해되어도 된다.적절한 공식은 다음과 같습니다.
- Au + 3 HNO
3 + 4 HCl - ( { { < > }) [ AuCl
4 −
]+ 3 NO
2 + HO
3+
+ 2
2 HO
또는
- Au + HNO
3 + 4 HCl - ( { { < > }) [ AuCl
4 −
]+ [ NO
3+
+ HO
2 + HO ]
여분의 아쿠아레지아를 증발시켜 잔류질산을 추가 염산으로 반복 가열하여 분해함으로써 고체테트라클로로아우산을 분리할 수 있다.이 단계는 질산을 감소시킨다(아쿠아 레지아의 분해 참조).원소금이 바람직한 경우에는 이산화황, 히드라진, 옥살산 [5]등의 환원제로 선택적으로 환원해도 된다.이산화황(SO2)에 의한 산화금(Au3+)의 환원식은 다음과 같다.
- 2 [AuCl4](−aq) + 3 SO2(g) + 62 HO(l) → 2 Au(aq) + 12+ H(aq) + 3 SO2-4(aq) + 8 Cl−(aq)
용해 백금
백금에도 비슷한 방정식을 쓸 수 있다.금과 마찬가지로 산화반응은 질소산화물 생성물로 질소산화물 또는 이산화질소를 사용하여 작성할 수 있다.
- Pt(s) + NO-3(aq) 4 + H(aq) 8+ → Pt4+(aq) + NO2(g) 4 + HO2(l)
- 3Pt + 4NO-3(aq) + 16H+(aq) → 3Pt4+(aq) + 4NO(g) + 8HO2(l)
그러면 산화 백금 이온이 염화 이온과 반응하여 클로로플라틴산 이온을 생성합니다.
- Pt4+(aq) + 6 Cl−(aq) → [PtCl6](2−aq)
실험 증거는 백금과 아쿠아 레지아의 반응이 상당히 복잡하다는 것을 보여준다.초기 반응은 클로로플라틴산(H2[PtCl4])과 니트로소플라틴산 염화물([NO][2PtCl4])의 혼합물을 생성한다.염화니트로소플라틴산은 고체 제품이다.백금을 완전히 용해시키려면 농축 염산을 사용하여 잔류 고형물을 반복적으로 추출해야 한다.
- 2Pt(s) + 2HNO3(aq) + 8HCl(aq) → [NO][2PtCl4](s) + H2[PtCl4](aq) + 4HO2(l)
그리고.
- [NO]2 [PtCl4](s) + 2 HCl(aq) h2 H[PtCl4](aq) + 2 NOCl(g)
클로로플라틴산은 가열 중에 용액에 분자염소(Cl2)를 포화시키면 클로로플라틴산으로 산화될 수 있다.
- H2[PtCl4](aq) + Cl2(g) → H2[PtCl6](aq)
백금 고형물을 아쿠아 레지아에 녹이는 것은 백금 광석에서 발견되고 아쿠아 레지아에 의해 녹지 않는 가장 밀도가 높은 금속인 이리듐과 오스뮴의 발견 방식이었다. 대신, 두 금속 모두 용기 바닥에 불용성 금속 분말(원소 Ir, Os)로 수집되었다.
(4일 후).
용존 백금 침전
실용적으로 백금족 금속을 아쿠아레지아에서 용해시켜 정제할 때 철분처리에 의해 금(일반적으로 PGM과 관련됨)이 침전된다.II) 염화물여과액 중의 백금은 헥사클로로플라틴산염(IV)으로서 염화암모늄의 첨가에 의해 헥사클로로플라틴산암모늄으로 변환된다.이 암모늄 소금은 녹지 않아 걸러낼 수 있다.점화(강력 가열)하면 백금 [6]금속으로 변환됩니다.
- 34 [NH]2 [PtCl6] → 3 Pt + 22 N + 2 [NH4]Cl + 16 HCl
미흡입 육염소화물(IV)는 원소 아연과 함께 환원되며, 실험실 [7]잔류물에서 백금을 소규모로 회수하는 경우에도 동일한 방법이 적합하다.
주석과의 반응
아쿠아 레기아는 주석과 반응하여 염화 주석(IV)을 형성하며, 주석의 산화율이 가장 높습니다.
- 4 HCl + 2 HNO3 + Sn → SnCl4 + NO2 + 32 HO
다른 물질과의 반응
황철광과 반응하여 염화철(II)을 형성할 수 있습니다.
- FeS2 + 5 HNO3 + 3 HCl → FeCl3 + 2 HSO24 + 5 NO + 2 HO2
역사
아쿠아 레기아는 [8]질산에 살암모니아(염화암모늄)를 첨가하여 만든 의사 게버(c.100 이후)에 의해 De inventione veritatis (진실의 발견에 대하여)에 처음 등장했다.염산과 질산을 직접 혼합하여 아쿠아레지아를 만드는 것은 유리염산을 생산할 [9]수 있는 공정의 16세기 후반에야 가능해졌다.
바질 발렌타인의 세 번째 열쇠 (1600년경)는 전경에 용이, 뒤에 여우가 수탉을 먹는 모습을 보여준다.수탉은 금을 상징하고, 여우는 아쿠아레지아를 상징한다.분해, 가열, 재분해(닭이 여우를 잡아먹는 것)가 반복되면 플라스크에 염소 가스가 축적된다.그 후, 금은 염화 금(III)의 형태로 결정되는데, 바질은 그 붉은 결정을 "우리 주인의 장미"와 "붉은 용의 피"[10]라고 불렀습니다.이 반응은 [11]1895년까지 화학 문헌에 다시 보고되지 않았다.
앙투안 라부아지에가 [12]1789년에 아쿠아레지아 니트로-마리아산이라고 불렀습니다.
제2차 세계대전 당시 독일이 덴마크를 침공하자 헝가리 화학자 조지 드 헤베시는 나치의 몰수를 막기 위해 독일 물리학자 막스 폰 라우에(1914년)와 제임스 프랑크(1925년)의 노벨상 금상을 아쿠아 레지아에 해체했다.독일 정부는 1935년 수감된 평화운동가 칼 폰 오시에츠키가 노벨 평화상을 받은 이후 독일인들이 노벨상을 받거나 보유하는 것을 금지했었다.De Hevesy는 Niels Bohr Institute의 자신의 연구실 선반에 결과물을 설치했습니다.선반에 있는 수백 개의 항아리 중 하나에 흔한 화학물질이 들어 있다고 생각한 나치들은 그 후 이를 무시했다.전쟁이 끝난 후, 드 헤베시는 다시 돌아와서 그 해결책을 찾고 산 속의 금을 침전시켰다.이 금은 스웨덴 왕립 과학 아카데미와 노벨 재단에 반환되었다.그들은 메달을 다시 주조하여 라우와 [13][14]프랑크에게 다시 수여했다.
「 」를 참조해 주세요.
메모들
레퍼런스
- ^ Hoffman, R. (2005년 3월 10일) NMR 샘플 제작 방법, 히브리 대학교.2006년 10월 31일에 액세스.
- ^ 미국 산업 위생 협회, 실험실 안전 사고: 폭발.2010년 9월 8일에 액세스.
- ^ Committee on Prudent Practices for Handling, Storage, and Disposal of Chemicals in Laboratories, National Research Council (1995). Prudent Practices in the Laboratory: Handling and Disposal of Chemicals (free fulltext). National Academies Press. pp. 160–161. doi:10.17226/4911. ISBN 978-0-309-05229-0.
{{cite book}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ "Aqua Regia". Laboratory Safety Manual. Princeton University. Archived from the original on 27 December 2012.
- ^ Renner, Hermann; Schlamp, Günther; Hollmann, Dieter; Lüschow, Hans Martin; Tews, Peter; Rothaut, Josef; Dermann, Klaus; Knödler, Alfons; et al. "Gold, Gold Alloys, and Gold Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a12_499.
- ^ Hunt, L. B.; Lever, F. M. (1969). "Platinum Metals: A Survey of Productive Resources to industrial Uses" (PDF). Platinum Metals Review. 13 (4): 126–138.
- ^ Kauffman, George B.; Teter, Larry A.; Rhoda, Richard N. (1963). Recovery of Platinum from Laboratory Residues. Inorg. Synth. Inorganic Syntheses. Vol. 7. p. 232. doi:10.1002/9780470132388.ch61. ISBN 9780470132388.
- ^ Karpenko, Vladimír; Norris, John A. (2002). "Vitriol in the History of Chemistry". Chemické listy. 96 (12): 997–1005. 페이지 1002Karpenko & Norris가 지적했듯이, (아마도 한 명 이상의 저자에 의해 쓰여진) 의사-게버 말뭉치의 불확실한 연대는 아쿠아 레기아의 연대를 똑같이 불확실하게 만든다.
- ^ Multhauf, Robert P. (1966). The Origins of Chemistry. London: Oldbourne. 페이지 208, 주 29, 참조 페이지 142, 주 79.
- ^ Principe, Lawrence M. (2013). The Secrets of Alchemy. Chicago: University of Chicago Press. ISBN 978-0226682952. 페이지 149-1989.
- ^ Rose, Thomas Kirke (1895). "The Dissociation of Chloride of Gold". Journal of the Chemical Society. 67: 881–904. doi:10.1039/CT8956700881. 참조: Principe 2013, 페이지 152
- ^ 를 클릭합니다Lavoisier, Antoine (1790). Elements of Chemistry,. in a New Systematic Order, Containing All the Modern Discoveries. Edinburgh: William Creech. p. 116. ISBN 978-0486646244..
- ^ "방사성 동위원소 연구의 모험", 조지 헤베시
- ^ Birgitta Lemmel (2006). "The Nobel Prize Medals and the Medal for the Prize in Economics". The Nobel Foundation.
외부 링크
- 케미스트리가 살아나다!아쿠아 레지아
- Aqua Regia at the Periodic Table of Videos (노팅엄 대학교)
- 금화가 산에 녹는 시연(아쿠아 레지아)












