영역 후술
Area postrema| 영역 후술 | |
|---|---|
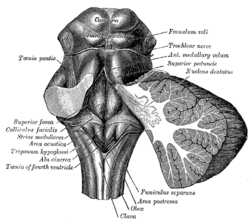 마름모꼴 fossa.(하단 중앙에 라벨이 붙은 영역 후). | |
 인간 꼬리 뇌간 후경 설명(영역 후는 #8) | |
| 세부 사항 | |
| 일부 | 메둘라 |
| 식별자 | |
| 약어 | 액세스 포인트 |
| 메쉬 | D031608 |
| 신경명 | 772 |
| NeuroLex ID | birnlex_2636 |
| TA98 | A14.1.04.258 |
| TA2 | 6009 |
| FMA | 72607 |
| 신경해부술의 해부학적 용어 | |
뇌간수질에 있는 한 쌍의 구조인 후뇌막은 투과성 모세혈관과 감각 뉴런을 가진 심실주위 기관으로 혈액 [1]내 순환하는 화학 전달자를 감지하고 신경 신호와 [2][3][4]네트워크로 변환하는 이중 역할을 한다.독도의 양쪽 핵에 인접한 위치 및 감각 변환기 역할을 통해 혈액 대 뇌 자율 기능을 통합할 수 있습니다.이러한 사후 영역의 역할은 구토, 갈증, 배고픔, 혈압 [1][5]조절과 관련된 순환 호르몬의 검출을 포함한다.
구조.
제4심실의 [1][5]후방 한계에서 볼 수 있는 한 쌍의 돌출부입니다.특수한 후막세포가 발견됩니다.이들 세포는 대부분의 상피세포(상피세포)와 약간 다르며, 심실과 중앙관의 단세포 상피 라이닝을 형성한다.후두엽은 얇은 반투명 [1][5]능선인 음낭 분리대에 의해 질트리곤에서 분리된다.미주신경은 배측 미주신핵 위에 있으며 마름모꼴 포사의 꼬리 끝 또는 제4심실의 '바닥'에 위치합니다.후두개 부위는 심실 바닥의 하정점인 오벡스 바로 앞에 위치한다.후두엽 세퍼란과 영역 후두엽은 모두 유사한 두꺼운 후두엽을 함유하는 타니세포 피복을 가진다.상피세포와 타니사이트는 뇌척수액 또는 인접한 뉴런, 교모세포 또는 혈관에서 뇌척수액으로 또는 뇌척수액 밖으로 신경화학물질을 운반하는 데 참여할 수 있다.상피세포와 타니사이트도 화학수용에 [1][5]참여할 수 있다.
후막 [2]부위는 심실 시스템과 가깝기 때문에 심실 주변 기관으로 간주됩니다.형태학적 연구에서, 후뇌 영역의 복부 하위 영역에 있는 후뇌 모세혈관은 뇌의 그것들과 같이 비교적 투과성이 없는 것으로 나타난 반면, 내측 및 등쪽 영역의 후뇌 모세혈관은 높은 투과성의 미시적 특징인 [6]사인파라고 불리는 특징을 가지고 있었다.뇌실 계면 부근에서 영역 내 모세혈관 밀도는 가장 높았고, 인접한 단독핵(SN) 및 [6]미주 신경의 등운동핵의 모세혈관 밀도보다 거의 두 배 더 밀도가 높았다.타니사이트 장벽은 리마 [7]후 영역의 높은 모세관 투과성을 부분적으로 보상한다.
혈류 후 영역의 생리학적 하위 영역 연구에서는 혈류량이 상대적으로 크고 혈액 마커의 혈류 및 통과 시간이 상대적으로 느리다는 것을 알 수 있으며, 따라서 호르몬이나 [8]전달 물질과 같은 순환 화합물의 감지 능력이 증폭되었다.
접속
후두엽은 고립된 핵, 즉 NTS(nuclear tractus solitari)와 뇌간의 다른 자율 제어 중추와 연결됩니다.위장관 및 기타 말초 트리거 구역에서 발생하는 내장 구심성 자극(공감 및 미주)과 체액성 요인에 [2]의해 흥분됩니다.후두엽은 미주신경 및 NTS의 등운동핵과 함께 미주신경 구심성 신경섬유의 중요한 종단 부위인 등미주신경복합체의 일부를 구성한다.
메스꺼움은 NTS와의 연결을 통해 원기후 부위의 자극을 통해 유발될 가능성이 높으며, 이는 다양한 구토 입력에 대한 반응으로 구토를 유발하는 경로의 시작 역할을 할 수 있다.그러나 이 구조는 미주신경섬유의 활성화 또는 동작에 의해 유발되는 메스꺼움에는 중요한 역할을 하지 않으며 방사선에 의해 유발되는 구토에서의 기능은 불분명하다.[9]
NTS의 전문영역 및 사후영역은 투과성 모세혈관을 [2]가지고 있기 때문에 혈액 중의 펩타이드 및 기타 호르몬 신호는 신체의 자율 [2][6]제어에 중요한 역할을 하는 뇌영역의 뉴런에 직접 접근한다.그 결과, [2][3]중추신경계에 들어갈 때 혈액 내 다양한 생리신호의 집적 부위로 간주됩니다.
기능.
케모레셉션
심실 주위 [10]기관 중 하나인 후두장은 혈액 속의 독소를 검출하여 구토 유도 중추 역할을 합니다.구토제에 반응하여 구토를 위한 화학 수용체 트리거 구역으로서의 기능을 통해 체액 및 신경 신호를 위한 중요한 항상성 통합 센터이다.혈액신호를 순환시키기 위한 높은 투과성을 위해 하위 영역의 모세혈관 전문화를 가진 촘촘한 혈관구조로 혈액 및 [4][6]뇌척수액 내의 다양한 화학적 전달물질을 검출할 수 있습니다.모세혈관의 혈류 흐름은 특이하게 혈류 후 영역에서 느린 것으로 보여 혈압, 체액 및 구토 [4][8]반응 조절에 관여하는 신경 수용체와 혈액 매개 호르몬이 상호작용하는 접촉 시간을 연장한다.
자율 조절
NTS의 전문화된 영역과 그 영역의 펜스트레이션된 정현파 모세혈관은 이 수질의 특정 영역을 심혈관계 시스템 및 섭식과 [2][6]신진대사를 제어하는 시스템을 포함한 다양한 생리 시스템의 자율 제어에 매우 중요합니다.앤지오텐신II는 심박수에서 상당한 변화를 일으키지 않고 용량 의존적인 동맥 혈압 상승을 유발하며, 이는 종양 [11]후 영역에 의해 매개된다.
임상적 의의
손상
주로 병변 또는 절제술로 인해 사후 영역이 손상되면 사후 영역의 정상적인 기능이 수행되지 않습니다.이 절제술은 보통 수술로 이루어지며 신체의 나머지 부분에 대한 종양 후 부위의 정확한 영향을 발견하기 위한 목적으로 이루어집니다.후유증은 위, 장, 간, 신장, 심장 및 다른 내부 장기의 감각 뉴런으로부터 정보를 얻는 데 뇌의 진입점 역할을 하기 때문에, 다양한 생리 반사가 후유증에 의존하여 정보를 전달한다.후유증은 유기체의 화학적 상태를 직접 모니터링하는 역할을 한다.미주신경을 [12]통해 신체의 생리 상태를 감시하는 뇌의 능력을 없애기 때문에 후두엽의 병변은 때때로 '중추 미주신경절제술'이라고 불립니다.따라서 이러한 병변은 독의 검출을 막고 결과적으로 신체의 자연적인 방어 기능이 작동하지 않도록 하는 역할을 한다.한 예로, Bernstein 등이 랫드를 대상으로 한 실험에 따르면 리마 후 부위가 고농도에서 독성이 될 수 있는 염화리튬의 검출을 방해했다.쥐들은 이 화학물질을 검출할 수 없었기 때문에, 미각 혐오 조절이라고 알려진 심리적인 방법을 사용할 수 없었고, 쥐는 리튬과 짝을 이룬 사카린 용액을 지속적으로 섭취하게 되었다.이러한 연구 결과는 염화리튬을 조건 없는 자극으로 사용할 때 리마 후 병변이 있는 쥐는 정상적인 조건화된 미각 반전을 얻지 못한다는 것을 나타냅니다.단순한 미각 거부감 외에도, 리마 후 병변을 가진 쥐들은 독소의 도입과 관련된 다른 행동적, 생리학적 반응을 하지 못했고, 대조군에 있는 그들의 배를 드러누운 상태, 지연된 위 공복,[13] 그리고 저체온증과 같은 반응을 하지 못했다.이러한 실험은 체내 독성물질의 확인뿐만 아니라 독소에 대한 많은 물리적 반응에서 리마 후 부위의 중요성을 강조한다.
도파민의 영향
파킨슨병에 대한 논의에서도 후유증은 중요한 역할을 한다.도파민으로 파킨슨병을 치료하는 약은 뇌종양 후 부위에 강한 영향을 미친다.이 약들은 도파민 전달을 자극하고 파킨슨병에 영향을 받는 운동 기능을 정상화하려고 시도한다.이것은 특히 운동 조절에 중요한 역할을 하고 파킨슨병의 주요 병리 부위인 기저신경절의 신경세포가 그들의 신경전달물질로 도파민을 사용하고 도파민 농도를 증가시키거나 도파민 수용체를 자극하는 약물에 의해 활성화되기 때문이다.도파민은 또한 뇌의 이 부분이 높은 밀도의 도파민 수용체를 포함하고 있기 때문에 뇌 후부를 자극한다.혈중 독성의 변화에 매우 민감하고 혈액에 독성이 있거나 위험한 물질이 있는지 감지합니다.방어기구로서 구토를 유도하여 더 이상의 중독을 방지한다.도파민 수용체의 고밀도는 도파민 강화 약물에 매우 민감하게 만든다.리마 후 영역에 있는 도파민 수용체의 자극은 뇌의 구토중추를 활성화시킨다; 이것이 메스꺼움이 항파킨슨제의 [14]가장 흔한 부작용 중 하나인 이유이다.
역사
후유증은 스웨덴의 해부학자이자 인류학자이자 조직학 교수인 마그누스 구스타프 레치우스에 의해 뇌의 전체적인 해부학에서 처음 이름이 붙여졌고 그 위치에 있었다.1896년, 그는 후유증이 언급된 [citation needed]인간 뇌의 총 해부학에 관한 두 권의 논문을 출판했습니다.1975년, 몇몇 포유동물 종들의 후두엽에서 뉴런의 증거가 발표되었다.[15]
과학자들은 1950년대에 구토 연구에 점점 더 많은 관심을 갖게 되었는데, 아마도 방사능 피폭 후 많은 환자들이 구토를 하는 방사선 질환에 대한 사회의 높은 경각심 때문인 것 같다.연구에 따르면 뇌에서 구토와 관련된 두 영역이 존재한다고 한다. 하나는 조정 기능이 없는 구토를 위한 화학 센서이며, 다른 하나는 화학 감각 기능이 없는 구토를 위한 코디네이터이며, 다른 하나는 수문 타원체의 [citation needed]외측 망상 형성에 위치하고 있다.
1953년, Borison과 Wang은 화학센서 영역이 뇌간에서 구토 유발 구역으로 작용한다는 것을 알아냈고, 그들은 그것을 구토를 위한 화학 수용체 트리거 구역(CTZ)이라고 이름 붙였다.고양이와 개를 모범 유기체로 사용하여, 뇌에서 이 트리거 영역을 제거하면 특정 화학 물질을 혈액에 직접 주입한 후 동물에서 구토를 방지할 수 있다는 것을 알아냈고, 트리거 영역과 구토 행위 사이의 관계가 있음을 보여주었다.CTZ는 해부학적으로 수문 후방에 위치해 있었다.후두개 부위는 해부학적으로 확인되었고 거의 60년 전에 이름이 붙여졌지만, 나중에 구토에서 그것의 역할이 [16]확인되기 전까지 그 기능은 알려지지 않았다.
현재의 연구
오늘날 전 세계적으로 그 지역의 기능에 대한 연구가 계속되고 있다.구토에 대한 역할 외에도 1900년대 중반의 연구자들에 의해 집중적으로 연구된 바와 같이, 구토 후의 활동은 행동 연구와 전기생리학 연구를 통한 음식 섭취 조절, 체액 항상성, 심혈관 조절과 같은 다른 자율 기능과 밀접하게 연관되어 있다.2007년 일본에서는 세포외 ATP에 의한 리마 후 뉴런의 흥분성 메커니즘에 대한 연구가 실시되었다.쥐의 뇌 슬라이스에 전압 클램프 전세포 기록 기술이 사용되었습니다.그 결과 ATP에 대한 대부분의 반응은 흥분성이며, 그것들은 리마 [17]후 영역에서 발견되는 특정 P2 순수 수용체에 의해 매개된다는 것을 보여주었다.풍미 조건의 혐오와 선호에서 이 지역 포스트레마의 역할은 2001년 뉴욕 시립 대학의 브루클린 대학의 연구자들에 의해 연구되었다.실험은 독극물 치료제와 짝을 이룬 맛에 대한 풍미 조건의 혐오감을 학습하는 능력에 대한 쥐의 구역질 후 병변의 영향을 실험했는데, 이것은 실제로 구역의 병변이 맛 혐오 [18]학습 장애로 이어진다는 것을 보여주었다.2009년 연구는 연구 전반에서 현저한 불일치를 해결하기 위해 마카크 원숭이 모델을 사용하여 이 지역의 신경 전달을 식별하고 특징짓기 위해 영역 후기의 개발을 뒤따랐다.이 과학자들은 이전 연구들이 카테콜아민 작동성 또는 아민에서 파생되어 신경전달물질이나 호르몬 또는 둘 다로 기능하는 노아드레날린과/또는 도파민이 리마 마카크-CA 후 영역에 CA 형광을 유발한다는 것을 발견했다.그러나 이 연구는 소포에서 분비되는 대신 신경전달물질의 분비 증거를 발견했다.또한 그들의 연구결과는 GABA가 글루타메이트가 아닌 리마 후 부위의 주요 신경전달물질이라는 결론을 내렸다.현재 진행 중인 연구는 다양한 쥐, 고양이, 그리고 현재 마카크 원숭이의 연구 [19]모델들 사이의 불일치를 계속해서 밝혀내고 있다.
잠재적인 치료법
2002년 일본의 한 연구는 도파민 농도를 증가시키는 약물에 대한 구토 반응을 억제하는 데 도움이 될 수 있는 약물을 실험했다.연구는 페렛의 모르핀 유도 구토를 조사하면서, 모르핀 노출이 아편 수용체를 활성화함으로써 수막과 후두부에서 도파민 분비를 유발했고, 이는 페렛에 의한 구토를 유발했다고 설명했다.그러나 도파민 작동성 신경독인 6-히드록시도파민을 사용한 전처리는 모르핀 노출 후 페레트 내 구토 발작 횟수를 유의미하게 감소시켰다.이 신경독은 도파민, 노르아드레날린, 도파민 대사물인 호모바닐산의 수치를 감소시켜 노르아드레날린과 도파민 신경세포를 파괴하는 것으로 알려져 있다.여기서, 6-히드록시도파민은 뇌의 다른 부분에는 주입되지 않고 수질에 직접 주입되었다.이 연구는 많은 도파민 증가 [20]약물과 관련된 메스꺼운 부작용을 줄이기 위해 어떻게 수질의 도파민 작용 경로를 조작할 수 있는지를 보여준다.
병리학적 연구를 계속하다
제1형과 제2형 당뇨병에 대한 인슐린 치료에서도 후유증이 나타난다.약물 프램린티드에 의해 사용되는 특정 메커니즘은 주로 용두 후 부위에 작용하여 글루카곤 분비를 감소시키고, 결과적으로 위 비우기 및 포만감을 늦추게 한다.이러한 리마 후 부위의 타겟팅은 체중 증가를 유발하지 않고 혈당 조절을 개선할 수 있습니다.약물은 용혈 후 부위에 작용하므로 환자에게 [21]메스꺼움을 유발하지 않도록 천천히 용량을 적정해야 합니다.
고혈압과 심혈관 기능에 대한 리마 후 부위 절제 효과를 결정하기 위한 연구도 현재 진행 중이다.예를 들어, 랫드와 토끼를 대상으로 한 연구에 따르면 앤지오텐신 II 의존성 고혈압은 [22][23]리마 후 영역의 병변에 의해 폐지된다.이 생리적 반응에 대한 메커니즘은 아직 완전히 이해되지 않았지만, 심혈관 기능을 조절하는 영역의 능력은 신경 내분비학에서 매우 흥미로운 방향을 제시합니다.
레퍼런스
- ^ a b c d e Mirza M, M Das J (8 July 2019). Neuroanatomy, Area Postrema. StatPearls; Treasure Island (FL): StatPearls Publishing. PMID 31334969. Retrieved 4 December 2019.
{{cite book}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ a b c d e f g Gross, P. M; Wall, K. M; Pang, J. J; Shaver, S. W; Wainman, D. S (1990). "Microvascular specializations promoting rapid interstitial solute dispersion in nucleus tractus solitarius". American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 259 (6 Pt 2): R1131–8. doi:10.1152/ajpregu.1990.259.6.R1131. PMID 2260724.
- ^ a b Price, C. J.; Hoyda, T. D.; Ferguson, A. V. (2007). "The area postrema: A brain monitor and integrator of systemic autonomic state". The Neuroscientist. 14 (2): 182–194. doi:10.1177/1073858407311100. PMID 18079557.
- ^ a b c Gross, P. M (1991). "Morphology and physiology of capillary systems in subregions of the subfornical organ and area postrema". Canadian Journal of Physiology and Pharmacology. 69 (7): 1010–25. doi:10.1139/y91-152. PMID 1954559.
- ^ a b c d McKinley, Michael J.; Denton, Derek A.; Ryan, Philip J.; Yao, Song T.; Stefanidis, Aneta; Oldfield, Brian J. (14 March 2019). "From sensory circumventricular organs to cerebral cortex: Neural pathways controlling thirst and hunger". Journal of Neuroendocrinology. 31 (3): e12689. doi:10.1111/jne.12689. ISSN 0953-8194. PMID 30672620.
- ^ a b c d e Shaver, Steven W.; Pang, Judy J.; Wall, Katharine M.; Sposito, Nadine M.; Gross, Paul M. (1 March 1991). "Subregional topography of capillaries in the dorsal vagal complex of rats: I. Morphometric properties". The Journal of Comparative Neurology. 306 (1): 73–82. doi:10.1002/cne.903060106. ISSN 0021-9967. PMID 2040730.
- ^ Williams, Chairman of the editorial board, Peter L., ed. (1995). Gray's anatomy: the anatomical basis of medicine and surgery (38th ed.). New York: Churchill Livingstone. ISBN 978-0-443-04560-8.
- ^ a b Gross, Paul M.; Wall, Katharine M.; Wainman, Dan S.; Shaver, Steven W. (1 March 1991). "Subregional topography of capillaries in the dorsal vagal complex of rats: II. Physiological properties". The Journal of Comparative Neurology. 306 (1): 83–94. doi:10.1002/cne.903060107. ISSN 0021-9967. PMID 2040731.
- ^ Miller, A. D.; Leslie, R. A. (1994). "The Area Postrema and Vomiting". Frontiers in Neuroendocrinology. 15 (4): 301–320. doi:10.1006/frne.1994.1012. PMID 7895890.
- ^ Ganong, W. F. (2000). "Circumventricular organs: Definition and role in the regulation of endocrine and autonomic function". Clinical and Experimental Pharmacology & Physiology. 27 (5–6): 422–427. doi:10.1046/j.1440-1681.2000.03259.x. PMID 10831247.
- ^ Veljković, S.; Jovanović-Mićić, D.; Japundzić, N.; Samardzić, R.; Beleslin, D. B. (1989). "The area postrema and the hypertensive effect of angiotensin". Metabolic Brain Disease. 4 (1): 61–65. doi:10.1007/BF00999495. PMID 2704347.
- ^ 필립 윈(2001) 루트리지의 생물심리학 사전
- ^ Bernstein, I. L.; Chavez, M.; Allen, D.; Taylor, E. M. (1992). "Area postrema mediation of physiological and behavioral effects of lithium chloride in the rat". Brain Research. 575 (1): 132–137. doi:10.1016/0006-8993(92)90432-9. PMID 1324085.
- ^ 데이비드 E.골란과 아르메니아 H.타시젠 "약리학의 원리: 약물치료의 병태생리학적 기초"
- ^ Klara, P. M.; Brizzee, K. (1975). "The ultrastructural morphology of the squirrel monkey area postrema". Cell and Tissue Research. 160 (3): 315–26. doi:10.1007/BF00222042. PMID 807331.
- ^ John Kucharczyk, David J. Stewart, Alan D. Miller (1991). Nausea and vomiting : recent research and clinical advances. Boca Raton: CRC Press. ISBN 0-8493-6781-6. OCLC 24066772.
{{cite book}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Kodama, N.; Funahashi, M.; Mitoh, Y.; Minagi, S.; Matsuo, R. (2007). "Purinergic modulation of area postrema neuronal excitability in rat brain slices". Brain Research. 1165: 50–59. doi:10.1016/j.brainres.2007.06.003. PMID 17658494.
- ^ Touzani, K.; Sclafani, A. (2002). "Area postrema lesions impair flavor-toxin aversion learning but not flavor-nutrient preference learning". Behavioral Neuroscience. 116 (2): 256–266. doi:10.1037/0735-7044.116.2.256. PMID 11996311.
- ^ Pangestiningsih, T. W.; Hendrickson, A.; Sigit, K.; Sajuthi, D.; Nurhidayat; Bowden, D. M. (2009). "Development of the area postrema: An immunohistochemical study in the macaque". Brain Research. 1280: 23–32. doi:10.1016/j.brainres.2009.05.028. PMID 19460361.
- ^ Yoshikawa, T.; Yoshida, N. (2002). "Effect of 6-hydroxydopamine treatment in the area postrema on morphine-induced emesis in ferrets". Japanese Journal of Pharmacology. 89 (4): 422–425. doi:10.1254/jjp.89.422. PMID 12233822.
- ^ Day, C. (2005). "Amylin analogue as an antidiabetic agent". The British Journal of Diabetes & Vascular Disease. 5 (3): 151–154. doi:10.1177/14746514050050030701.
- ^ Averill, D. B.; Matsumura, K.; Ganten, D.; Ferrario, C. M. (1996). "Role of area postrema in transgene hypertension". Hypertension. 27 (3 Pt 2): 591–597. doi:10.1161/01.HYP.27.3.591. PMID 8613209.
- ^ Bishop, V. S.; Hay, M. (1993). "Involvement of the Area Postrema in the Regulation of Sympathetic Outflow to the Cardiovascular System". Frontiers in Neuroendocrinology. 14 (2): 57–75. doi:10.1006/frne.1993.1003. PMID 8486207.


