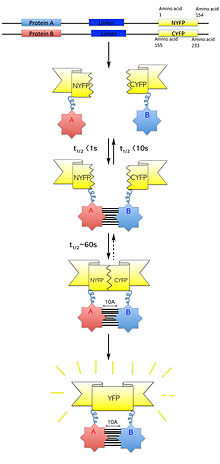
쌍분자 형광상보
Bimolecular fluorescence complementation쌍분자 형광 보완(BiFC라고도 함)은 일반적으로 단백질 상호작용을 검증하는 데 사용되는 기술입니다.이는 동일한 고분자 복합체의 구성요소에 부착된 형광 단백질 조각의 연관성에 기초한다.상호작용하는 것으로 가정된 단백질은 형광 리포터 단백질의 펼쳐진 상보적 단편에 융합되어 살아있는 세포에서 발현된다.이러한 단백질의 상호작용은 형광 조각들을 근접하게 하여 리포터 단백질이 본래의 3차원 구조에서 변형되고 형광 [1]신호를 방출할 수 있게 할 것이다.이 형광 신호는 세포 내 형광의 이미징을 가능하게 하는 역형광 현미경을 사용하여 검출되고 세포 내에 위치할 수 있습니다.또한 방출되는 형광의 강도는 상호작용의 강도에 비례하며, 더 강한 형광 수준은 근접 또는 직접 상호작용을 나타내며, 더 [2]낮은 형광 수준은 복합체 내의 상호작용을 나타낸다.따라서 이러한 세포에서 형광의 강도와 분포의 시각화 및 분석을 통해 관심 단백질의 위치와 상호작용 파트너를 식별할 수 있다.
역사
생화학적 보완은 먼저 서브틸리신 분해 소 췌장 리보핵산가수분해효소(subtilisin-cleaved bowin 췌장 리보핵산가수분해효소)에서 보고되었고,[3][4][5] 그 후 유당에서 세포가 성장할 수 있도록 하는 β-갈락토시드가수분해효소 돌연변이를 사용하여 확장되었다.
많은 단백질이 기능적 복합체로 자발적으로 조립되는 능력뿐만 아니라 단백질 조각이 융합된 상호작용 파트너의 자발적 기능적 복합체 집합의 결과로 조립되는 능력의 인식은 효모 [6]단백질 상호작용의 유비퀴틴 조각에 대해 나중에 보고되었다.
2000년 고쉬 외 연구진은 대장균 세포에서 [7]항병렬 류신 지퍼를 사용하여 녹색 형광 단백질(GFP)을 재조립할 수 있는 시스템을 개발했다.이는 GFP를 C 및 N 단자 GFP fragment로 분해함으로써 실현되었습니다.링커에 의해 GFP 단편이 각 류신 지퍼에 부착되었을 때, 반병렬 류신 지퍼의 헤테로다이머화는 시각화할 수 있는 GFP 단백질을 재구성 또는 재형성하는 결과를 낳았다.성공적인 형광 신호는 분리된 GFP 펩타이드 조각이 올바르게 재조립되고 3차 접힘을 달성할 수 있음을 나타냅니다.따라서 이 기술을 사용하여 단편화된 GFP를 사용하여 N-C 흰자리가 근접한 단백질-단백질 쌍의 상호작용을 연구할 수 있다고 가정했다.
포유동물 세포에서 형광 단백질 단편 재구성이 성공한 후, Hu 등은 bZIP 및 Rel 패밀리 전사 인자 [8]상호작용 조사에 단편화된 황색 형광 단백질(YFP)의 사용을 설명했다.이는 bZIP 도메인 외 영역에 의한 bZIP 단백질 상호작용 조절, 서로 다른 상호작용 파트너에 의한 bZIP 도메인 Fos와 Jun의 핵하 국재화 조절, 상호 상호작용을 통한 bZIP 및 Rel 단백질의 전사 활성화 조절을 최초로 보고한 것이다.게다가에서 vivo 기술, 이제는 이분자 형광 상보성(BiFC)분석으로 알려진 형광 형광 기자 단백질 조각의 어셈블리 반응 단백질과 연결했다로 인한 검출을 통해 단지 조성 protein의 구조적 근거를 파악하기 위해, 이 연구 결과 그 첫번째 보고서다.[8][9]
형광 라벨
불소 세포 활성화는 단백질이 올바르게 [10]접힌 후에 발생하는 자기 촉매 순환 반응을 통해 발생합니다.이는 [8]2002년 트랜스펙션 후 8시간 이내에 단백질 조각에서 상호작용 단백질로 융합된 YFP 불소 포자의 성공적인 재구성과 함께 진전되었다.
워크플로우
융합단백질 생산체계 선정
생성된 융합 단백질에 사용할 수 있는 다양한 생산 시스템이 있습니다.과도 유전자 발현은 BiFC 복합체의 세포 내 국소화뿐만 아니라 생체 내 단백질-단백질 상호작용을 식별하기 위해 사용된다.그러나 단백질 과다 발현은 선호 국소화와 형성된 주요 단백질 복합체 모두를 왜곡시킬 수 있으므로 주의해야 한다.대신, 약한 촉진제, 트랜스펙션에서의 낮은 수준의 플라스미드 DNA의 사용, 그리고 포유류의 세포에서 복제되지 않는 플라스미드 벡터는 생리적 [11]세포 환경을 모방하기 위해 그들의 내생적 수준에서 또는 가까운 수준에서 단백질을 발현하기 위해 사용되어야 한다.또한 형광단백질마다 세포환경이 다르기 때문에 형광단백질의 신중한 선택이 중요하다.예를 들어, GFP는 대장균 세포에서 사용될 수 있고 YFP는 포유동물 [12]세포에서 사용될 수 있습니다.
발현 벡터가 게놈에 통합된 안정된 세포주는 세포 집단에서 보다 안정적인 유전자 발현을 가능하게 하여 보다 일관된 결과를 [1]낳는다.
핵융합 부위의 결정
단백질 표면에서 링커 융합 부위를 결정할 때 세 가지 주요 고려 사항이 있습니다.첫째, 형광 단백질 조각들은 사슬에 묶인 단백질이 [11]상호작용할 때 서로 연관될 수 있어야 한다.복수의 조합과 배열을 [11]스크리닝 할 수 있기 때문에 링커에 대한 융접 부위를 결정할 때 구조 정보와 상호작용 표면의 위치가 유용할 수 있다.둘째, 융합단백질의 생성은 내인성 야생형 [11]단백질과 비교하여 단편들이 연결되어 있는 단백질의 국소화, 안정성 또는 발현을 크게 변화시켜서는 안 된다.마지막으로, 형광 단편 융합의 첨가는 단백질의 생물학적 기능에 영향을 미쳐서는 안 되며, 바람직하게는 단백질의 알려진 모든 [11]기능을 평가하는 분석법을 사용하여 검증된다.
링커 설계
링커는 형광 리포터 단백질 단편을 관심 단백질에 묶어 융합 단백질을 형성하는 짧은 아미노산 배열입니다.링커 배열을 설계할 때는 링커가 충분히 용해되고 길어서 형광 단백질 조각에 유연성과 이동의 자유를 제공함으로써 단편과 그 파트너 조각이 각각의 융합 [1]단백질의 상호작용 중에 재구성할 수 있을 만큼 자주 충돌하도록 해야 한다.비록 문서화되어 있지는 않지만, 링커의 길이 또는 배열이 [11]일부 단백질의 보완에 영향을 미칠 수 있다.보고된 링커 시퀀스 RSIAT 및 RPACKQKVMNH(단일 아미노산 코드) 및 AAANSIDLISVPVDSR(Sigma)는 BiFC [8][13]실험에서 정상적으로 사용되었습니다.
적절한 플라스미드 표현식 벡터 생성
관심 단백질을 표현하기 위해 플라스미드 벡터를 설계할 때, 그 구조는 단백질의 기능을 방해하지 않고 형광 단백질 조각과 융합 단백질을 형성할 수 있는 단백질을 발현할 수 있어야 한다.또한 예상되는 단백질 복합체는 단백질 복합체 기능이나 연구 대상 세포에 영향을 미치지 않고 형광 단백질 단편 상호작용의 안정화를 받아들일 수 있어야 한다.여러 가지 방법으로 결합된 많은 형광 단백질 조각들이 [8][13]BiFC에 사용될 수 있습니다.일반적으로 YFP는 리포터 단백질로서 기능하는 것이 권장되며, 특히 잔류물 155(잔기 1~154 및 잔류물 155~238로 구성된 C-말단으로 구성된 N-말단) 또는 잔류물 173에서 절단된다. 이러한 단편 세트는 많은 상호작용 단백질과 융합되어 낮은 수준의 독감을 생성하기 때문이다.비융해성 단백질과 융합할 때 발생하는 광석.각 표적 단백질은 형광 리포터 단백질의 N-말단 및 C-말단 단편에 차례로 융합되고 해당 단편은 표적 단백질의 N-말단 및 C 말단 각각에서 융합되는 것이 권장된다.이렇게 하면 총 8개의 서로 다른 순열을 사용할 수 있으며 교호작용을 [1]검정할 수 있습니다.
N 말단 단백질 1에서 용융된 N 말단 단편 + N 말단 단백질 2에서 용융된 C 말단 단편
N 말단 단백질 1에서 용융된 N 말단 단편 + C 말단 단백질 2에서 용융된 C 말단 단편
C 말단 단백질 1에서 융합된 N 말단 단편 + N 말단 단백질 2에서 융합된 C 말단 단편
C 말단 단백질 1에서 융합된 N 말단 단편 + C 말단 단백질 2에서 융합된 C 말단 단편
N 말단 단백질 1에서 융합된 C 말단 단편 + N 말단 단백질 2에서 융합된 N 말단 단편
N말단 단백질 1에서 융합된 C말단 단편 + C말단 단백질 2에서 융합된 N말단 단편
C 말단 단백질 1에서 융합된 C 말단 단편 + N 말단 단백질 2에서 융합된 N 말단 단편
C 말단 단백질 1에서 융합된 C 말단 단편 + C 말단 단백질 2에서 융합된 N 말단 단편
적절한 세포 배양 시스템 선정
앞에서 설명한 바와 같이 모든 리포터 단백질이 모든 모델 시스템에서 형광을 발생시키거나 시각화할 수 있는 것은 아니기 때문에 BiFC에서 사용되는 형광 리포터 단백질이 적절하고 선택된 세포 배양 시스템에서 발현될 수 있는지 확인하는 것이 중요하다.
적절한 제어의 선택
형광단백질 조각은 특정 상호작용이 없을 때 저효율로 결합 및 형광을 발생시킬 수 있다.따라서 형광 리포터 단백질 재구성의 형광이 불특정 [14]접촉에 의한 것이 아님을 보증하는 대조군을 포함하는 것이 중요하다.
일부 대조군에는 비상호화 단백질과 연결된 불소단편이 포함되는데, 이러한 융합의 존재는 비특이적 보완성과 잘못된 양성 [7]결과를 감소시키는 경향이 있기 때문이다.
또 다른 제어는 형광단백질 단편과 돌연변이된 [8][13]상호작용면을 가진 단백질을 연결함으로써 만들어진다.형광단백질이 야생형 단백질과 동일한 방식으로 돌연변이 단백질에 융합되어 유전자 발현 수준 및 국소화가 돌연변이의 영향을 받지 않는 한, 이는 돌연변이 단백질, 즉 형광단백질이 상호작용할 수 없기 때문에 강력한 음성통제로 작용한다.
서로 다른 세포에서 전달 효율과 유전자 발현의 차이를 정상화하기 위해서는 내부 통제도 필요하다.이것은 형광 리포터 단백질과 다른 파장에서 형광을 내는 전체(비조각) 단백질뿐만 아니라 관심 융합 단백질을 코드하는 플라스미드와 세포를 공동 감염시킴으로써 달성된다.시각화 중에 BiFC 복합체의 형광 강도 및 배경 신호를 감산한 후 비율이 되는 내부 제어를 결정한다.이 비율은 BiFC 효율을 나타내며 다른 비율과 비교하여 서로 다른 [11]복합체 형성의 상대적 효율성을 결정할 수 있습니다.
세포전달
일단 융합 단백질과 대조군이 그들의 적절한 발현 시스템에서 설계되고 생성되면, 플라스미드는 연구 대상 세포에 전달되어야 한다.감염 후, 융합 단백질이 상호작용하고 그들의 연결된 형광 리포터 단백질 조각이 결합하고 [8]형광을 일으킬 때까지 일반적으로 약 8시간을 기다려야 한다.
시각화 및 분석
융합 단백질과 그 연결된 형광 조각이 상호작용하고 형광을 일으키는 데 충분한 시간이 지난 후, 세포에서 형광을 시각화할 수 있는 역형광 현미경으로 세포를 관찰할 수 있다.BiFC 복합체의 형광 강도는 보통 온전한 형광 단백질의 발현에 의해 생성되는 형광 강도의 10% 미만이지만, 가시 범위 내의 극히 낮은 자기 형광은 종종 BiFC 신호 순서를 백그라운드 [15]형광보다 높게 만든다.
융합단백질이 발현될 때 형광이 검출되지만, 돌연변이 음성대조군의 발현 후에 결핍되거나 현저하게 감소하는 경우에는 두 대상단백질 사이에 특정 상호작용이 발생할 가능성이 높다.단, 변이된 음성 대조군 융합단백질과 야생형 융합단백질 간에 형광 강도가 유의하게 다르지 않은 경우 형광은 비특이적 단백질 상호작용에 의해 발생할 가능성이 높으므로 융합단백질 배치의 다른 조합을 시험해야 한다.
형광이 검출되지 않으면 융합단백질의 생성에 의해 표적단백질의 구조 또는 상호작용면이 변화하거나 형광단편이 물리적으로 관련지을 수 없기 때문에 관심단백질 사이에 상호작용이 여전히 존재할 수 있다.이 결과가 잘못된 음성이 아니며 상호작용이 없음을 확인하기 위해 형광보완과 활성화가 외부 신호를 필요로 하는 상황에서 단백질 상호작용을 테스트해야 한다.이 경우, 외부 신호가 형광 단편 어소시에이션을 일으키지 못하면, 단백질이 상호작용하지 않거나 형광 [11]상보성에 물리적인 장애가 있을 가능성이 높다.
힘
관련 생물학적 맥락
단백질은 유기체의 생존을 지원하는 세포에서 다른 기능을 지원하는 기능을 달성하기 위해 다른 단백질 파트너 및 다른 고분자와 상호작용합니다.이러한 상호작용을 식별하면 세포 프로세스에 미치는 영향에 대한 단서를 제공할 수 있습니다.이러한 상호작용은 내부 환경과 외부 자극 모두에 의해 영향을 받을 수 있으므로, BiFC에서 권장되는 생체 내 및 내인성 수준에서 이러한 상호작용을 연구하는 것은 단백질 상호작용에 대한 결론을 도출하기 위한 생리적으로 관련된 맥락을 제공한다.
직접 시각화
BiFC는 균등하게 분포하지 못할 [1]수 있는 2차 효과에 의존하거나 외생 분자에 의해 염색되는 대신 세포 섭동이 제한된 살아있는 세포에서 단백질 상호작용을 직접 시각화할 수 있게 한다.이것은, 그리고 살아있는 세포를 장기간 관찰하는 능력은, 재구성 리포터 단백질의 강한 내인성 형광에 의해서, 단백질 분리 [1][16]프로세스와 관련된 부정확한 판독치의 가능성을 감소시킴으로써 가능하게 된다.
감도
많은 생체 내 단백질 상호작용 분석과 달리, BiFC는 단백질의 큰 비율 또는 화학량학적 비율로 단백질 복합체를 형성할 필요가 없다.대신, BiFC는 형광 리포터 [12][17]단백질의 안정적인 상보성으로 인해 단백질 하위 집단, 약한 상호작용 및 저발현 단백질 사이의 상호작용을 검출할 수 있다.또한 형광단백질 재구성은 대상 단백질에 불소단백질을 결합하는 링커가 대응하는 [14]단편과 관련짓는 데 필요한 유연성을 갖는 한 7nm 이상의 단백질 파트너에 대해 성공적으로 보고되었다.또한 형광신호 [2]강도의 변화에 의해 단백질 상호작용의 강도를 정량적으로 결정할 수 있다.
공간 해상도
BiFC는 약물 및 아세포 활성화 및 억제 반응에도 단백질 복합체의 공간적 및 시간적 변화를 측정할 수 있도록 하여 생체 내 단백질-단백질 상호작용 분석의 [8][18][19]가장 높은 공간적 분해능을 제공한다.
특수 장비 없음
BiFC는 [14]세포에서 형광을 검출할 수 있는 역형광 현미경으로 시각화가 가능하기 때문에 특수 장비가 필요하지 않다.또한 [8]분석에는 다른 형광원에 대한 복잡한 데이터 처리나 보정이 필요하지 않습니다.
구조 정보가 필요 없음
BiFC는 형광 리포터 단백질 조각이 복합체 내에서 결합할 수 있는 한 상호작용 파트너에 대한 구조적 정보 없이 수행될 수 있으며, 융합 단백질의 여러 조합을 선별할 수 있다.이는 단백질 기능이 체내 맥락에서 반복되기 때문에 복잡한 구조가 [15]생리적으로 보이는 온전한 단백질의 구조와 유사할 것이라는 가정에 기인한다.
여러 응용 프로그램
BiFC 기술은 유전자 변환 경로의 변화를 빠르게 감지하고 약물의 숨겨진 표현형을 보여주기 위해 동일한 세포에서 여러 단백질 복합체를 동시에 시각화하는 능력을 포함하도록 개선되고 확장되었다(즉, 세포 사망, 분화, 형태).논리적 변화)는 생체 내에서 보이지 않으며, 다른 세포 구획에서 복합 형성을 연구하고, 단백질 상호작용[13][19][20][21][22] 표면을 매핑한다.
제한 사항
실시간 검출
형광 신호는 단백질이 상호작용한 후에만 생성되며, 이는 일반적으로 몇 시간 정도 걸립니다.따라서 BiFC는 단백질 상호작용의 실시간 검출을 제공할 수 없다.불소 포자를 생성하기 위한 화학 반응의 지연은 또한 복잡한 해리 및 [1][7][8][23]파트너 교환의 역학에 영향을 미칠 수 있습니다.
불가역 BiFC 생성
BiFC 복합체 형성은 형광 리포터 단백질 재조립의 초기 단계(일반적으로 밀리초) 동안만 가역적입니다.일단 형광색이 재구성되면 기본적으로 체외에서 되돌릴 수 없습니다.이는 단백질이 다른 단백질과 상호작용하는 것을 방지하고 동적 [1]평형에서 단백질 복합체의 연관성/분리를 방해할 수 있다.
독립형광단백질단백질단편결합
형광 단백질 조각은 융합된 단백질과 독립적으로 결합하는 제한된 능력을 가지고 있다.비록 단백질 비의존적 연관성은 융합 단백질의 정체성과 그들의 발현 수준에 따라 다르겠지만, 사람들은 진실과 거짓 양성 단백질 상호작용을 구별하기 위해 필요하고 많은 통제들을 제공해야 한다.일반적으로 이 제한은 관심 있는 융합단백질이 내인성 [1]농도로 발현되도록 함으로써 완화된다.
단백질 구조 변경 및 입체 장애
형광성 단편 결합은 관심 단백질의 접힘 또는 구조를 변화시켜 상호작용하는 단백질의 표면 결합 부위를 제거할 수 있다.또한 형광단편이 결합할 수 있는 충분한 유연성을 가진 링커 배열을 사용함으로써 입체장애를 통한 불소포자 재구성을 방지할 수 있다.따라서 형광보완의 부재는 잘못된 음성일 수 있으며, 반드시 해당 상호작용이 발생하지 않음을 증명하지는 않는다.
의무 혐기성
불소포자 형성을 위해 분자산소가 필요하기 때문에 BiFC는 산소 존재 하에서 생존할 수 없는 필수 혐기성 물질에 사용할 수 없다.이것은 BiFC의 사용을 호기성 [1]유기체로 제한한다.
자기 형광
BiFC 신호가 [24][25]백그라운드보다 훨씬 높기 때문에 자동 형광은 보통 문제가 되지 않습니다.그러나 특정 유기체, 특히 아피콤플렉스는 [26]BiFC를 적용하기 어렵게 만드는 더 높은 자기 형광을 가지고 있다.칸디다 알비칸과 같은 특정 곰팡이 또한 높은 자기 형광 배경을 가지고 있지만, BiFC는 적절한 통제와 균주를 사용할 [27][28]때 여전히 수행될 수 있습니다.
융합단백질 사용
내인성 야생형 단백질은 생체 내에서 시각화될 수 없기 때문에, 융합 단백질이 생성되어야 하고 그들의 플라스미드가 연구된 세포로 전달되어야 한다.이러한 융합 단백질은 야생형 단백질에 공통되는 기능, 국소화 및 상호작용을 반복하지 않을 수 있으며, 문제의 단백질에 대한 부정확한 그림을 제공한다.이 문제는 대상 단백질의 결합 부위를 합리적으로 식별하기 위해 구조 정보와 상호작용 부위의 위치를 사용하고, 적절한 제어를 사용하고, 웨스턴 블롯과 기능 [1]분석을 통해 융합 및 야생형 단백질의 발현 수준과 기능을 비교함으로써 완화될 수 있다.
온도 의존성
비록 저온이 단편들이 근접한 거리에 있을 때 형광의 재구성을 선호하지만, 이것은 표적 단백질의 행동에 영향을 미쳐 단백질 상호작용의 본질과 그들의 상호작용 [17]파트너에 대한 부정확한 결론을 초래할 수 있다.
정확한 상호 작용 관계를 알 수 없습니다.
형광구 재구성은 7nm 이상의 거리에서 발생할 수 있기 때문에 형광보완은 형광단편의 융합단백질 [16]사이의 직접적 또는 간접적(즉, 동일한 복합체 내) 상호작용을 나타낼 수 있다.
어플
위에서 설명한 단백질-단백질 상호작용의 검증 외에도 BiFC는 다른 용도로 확장 및 조정되었습니다.
세균 리보솜 조립
BiFC 시스템은 E.coli에서 [29]리보솜 생물 발생 이벤트를 기록하기 위해 적용되었습니다.리보솜 조립 과정은 리보솜 단백질의 적절한 순서와 방향의 핵 형성을 포함한다.조립의 섭동은 결과적으로 완전히 기능적인 리보솜을 형성하기 위해 올바른 방향으로 결합할 수 없는 리보솜 서브유닛의 구조적 결함을 초래할 수 있다.따라서 BiFC의 출현에 의해 시그널링되는 서브유닛 결합의 이벤트는 힘든 폴리섬 프로파일링 방법과는 대조적으로 리보솜 생물 형성을 감시하는 쉬운 방법이다.
다색 형광
BiFC에 사용된 형광 단백질 조각은 파란색, 청록색, 녹색, 노란색, 빨간색, 체리색, [8][13][30][31]금성을 포함하도록 확장되었습니다.이 색상 범위는 다색 형광 보완 분석의 개발을 [13]가능하게 했다.이 기술은 동일한 세포에서 여러 단백질 복합체를 동시에 시각화할 수 있도록 한다.또한, 단백질은 전형적으로 많은 수의 대체 상호작용 파트너를 가지고 있다.따라서 후보 단백질에 다른 형광 단백질의 단편들을 융합함으로써, 다른 형광색 [13]단편들의 상보성을 통해 복잡한 형성을 위한 대체 상호작용 파트너들 간의 경쟁을 연구할 수 있다.
RNA결합단백질상호작용
BiFC는 Rackham 및 Brown 방법에서 RNA 결합 단백질 상호작용에 대한 연구를 포함하도록 확장되었습니다. TriFC([20]Trifolecular Fluorexcomperation, TriFC)로 기술됩니다.본 발명의 방법은 금성 형광단백질의 단편을 관심 mRNA에 융합하고, 상보적인 금성부분을 관심 RNA결합단백질에 융합하는 것이다.BiFC와 마찬가지로 mRNA와 단백질이 상호작용하면 금성 단백질이 재구성되고 형광이 발생합니다.RNA 브릿지법으로도 알려진 불소체와 다른 상호작용 단백질은 단백질과 관심 RNA 사이의 브릿지를 형성하기 때문에 살아있는 세포 내의 RNA-단백질 상호작용의 간단한 검출과 국재화를 가능하게 하며, 직접 또는 간접적인 RNA-단백질 연관(복합체 내)을 검출하는 간단한 방법을 제공한다.정제 화합물의 시험관내 분석 또는 브리징 분자의 RNAi 녹다운을 통해 검증될 수 있다.[20]
경로 구성 및 신호 전달 계단식
BiFC는 유전자가 [21][22]암호화하는 단백질 사이의 상호작용을 측정함으로써 유전자와 다른 유전자와 그들의 기능을 연결하는데 사용될 수 있다.이 애플리케이션은 새로운 경로 연결이 이루어질 수 있기 때문에 상행 및 하행 이펙터에 대해 거의 알려지지 않은 새로운 유전자에 이상적이다.또한 약물, 호르몬 또는 관심 유전자의 결실 또는 녹다운의 영향과 단백질-단백질 상호작용의 강도와 상호작용 위치 모두에 대한 후속 영향은 몇 [18][19]초 안에 관찰될 수 있다.
서로 다른 셀 컴파트먼트의 복잡한 구성
BiFC는 복잡한 국소화를 통해 핵 전이를 연구하기 위해 사용되었으며, 또한 통합된 [8][32][33][34][35][36][37][38]막 단백질과 관련된 상호작용도 연구하였다.따라서 BiFC는 세포내 구획에서 전사 인자 국부화를 이해하는 데 중요한 도구이다.
단백질-단백질 상호작용 표면 정량화
BiFC는 흐름 세포 측정(BiFC-FC)과 결합되어 있습니다.이를 통해 복합 [2]형성에 영향을 미치는 부위 지향적 또는 무작위 돌연변이의 도입을 통해 단백질-단백질 상호작용 표면을 매핑할 수 있다.
다른 테크놀로지와의 비교
단백질-단백질 상호작용 연구에 사용되는 대부분의 기술은 시험관내 방법에 의존한다.불행히도, 세포 환경 밖에서 인공 시스템에서 단백질을 연구하는 것은 많은 어려움을 야기한다.예를 들어, 이것은 정상적인 세포 환경에서 단백질을 제거하는 것을 필요로 할 수 있다.단백질을 분리하는 데 필요한 처리는 다른 단백질과의 상호작용에 영향을 미칠 수 있다.또한 정상 세포에서 일어나는 세포 내 신호 전달 및 메커니즘으로부터 단백질을 분리하는 것은 세포 내 및 생리학적 [1]발생의 잘못된 그림을 제공할 수 있다.또한 체외에서 연구된 단백질은 정상 농도와 크게 다른 농도로 연구될 수 있으며, 세포로 효율적으로 운반되지 않을 수도 있고, 숙주 [39][40][41][42]게놈에서 기능하기 위해 충분히 선택적이지 않을 수도 있다.마지막으로, 시험관내 단백질을 연구함으로써, 기능적 또는 생리학적 결과에 대한 세포 내 특정 단백질-단백질 상호작용의 영향을 결정할 수 없다.
단백질-단백질 상호작용 연구에 가장 일반적으로 사용되는 다른 생체내 분석으로는 형광 공명 에너지 전달(FRET)과 효모 2-하이브리드(Y2H) 분석이 있다.BiFC와 비교한 각각의 평가에는 장점과 단점이 있습니다.
형광공명에너지전달(FRET)
örster 공명 에너지 전달, 공명 에너지 전달(RET) 또는 전자 에너지 전달(EET)이라고도 하는 형광 공명 에너지 전달(FRET)은 들뜬(공여) 색단 또는 형광단(형광단인 경우)에서 가까운 수용체로의 에너지 전달에 기초한다.이 방법에서 불소체는 화학적으로 결합되거나 상호작용하도록 가정된 2개의 단백질과 유전적으로 융합된다.만약 단백질이 상호작용을 한다면, 이것은 불소 세포들을 공간적으로 근접하게 만들 것이다.불소-단백질 연결/융합을 설계 및 구성할 때 일반적으로 보장되는 불소-단백질 결합/융합을 서로 노출시키는 방식으로 불소-단백질 결합/융합을 지향하는 경우, 들뜬 공여 불소로부터의 에너지 전달은 형광 강도 또는 불소-단백질 [1][14]결합의 수명 변화를 초래할 것이다.
효모 2-하이브리드(Y2H)
효모 2-하이브리드(Y2H)는 물리적(결합) 단백질-단백질-단백질-단백질-단백질-단백질-을 검출하는 데 사용될 수 있는 유전자 선별 기술이다.DNA 상호작용.그것은 보통 효모 생물인 사카로미세스 세레비시아에 적용된다.예를 들어 전사인자 GAL4의 결합 도메인에 융합된 알려진 기능의 '베이트' 단백질을 잠재적 상호작용 단백질 또는 예를 들어 GAL4 활성화 도메인('프라이')[43][44]을 발현하는 cDNA 라이브러리에 대해 테스트합니다.
테크놀로지 비교
| 비교 테크놀로지 | BiFC와의 유사성 | 이점 | 단점들 | |
|---|---|---|---|---|
| 프렛 | 살아있는[14] 세포 내에서 단백질 상호작용 부위를 검출하고 위치를 찾는 능력 | 단백질 상호작용의 순간 실시간 모니터링
가역성 불소자 상호작용 | 공간적 근접성[45]
감도 저하[45]
| |
| Y2H | 상호작용을 스크리닝하는 데 사용되는 생체내 기술 | 유전자 상호작용 화면
| 미끼-사료 잠정 연계[14]
잘못된 전사 활성화[14]
단백질의 과잉 발현[16]
핵의 현지화[16]
|
레퍼런스
- ^ a b c d e f g h i j k l m Kerppola, T. K. 살아있는 세포에서 단백질 상호작용의 시각화를 위한 바이몰레 형광 보완(BiFC) 분석의 설계 및 구현.Nat. Protoc. 1, 1278–1286 (2006)
- ^ a b c Morell, M., Espargaro, A., Aviles, F. X. & Ventura, S. 쌍분자 형광보완과 흐름 세포측정 결합을 통한 생체내 단백질 상호작용 연구 및 선택.Nat. Protoc. 3, 22-33 (2008)
- ^ Richards, F. M. Subtilisin-Modified Ribonucase의 효소 활성에 대하여검사님, Natl.학술원 미국 과학부 44, 162~166(1958)
- ^ a b Ulmann, A., Jacob, F. & Monod, J. 대장균의 베타갈락토시다아제 구조 유전자의 조작자-근접 세그먼트에 대응하는 펩타이드의 시험관내 상보성에 의한 특징.J. Mol. Biol. 24, 339–343(1967).
- ^ a b Ulmann, A., Jacob, F. & Monod, J. 대장균의 야생형 대 보완 베타 갈락토시다아제 서브유닛 구조에 대하여.J. Mol. Biol. 32, 1-13(1968).
- ^ Johnsson, N. & Varshavsky, A. 생체 내 단백질 상호작용 센서로서의 유비퀴틴 분할.검사님, Natl.학술원 미국 과학회 91, 10340-10344(1994)
- ^ a b c Ghosh, I., Hamilton, A. D. & Regan, L. Antiparallel Leucine 지퍼 지향 단백질 재조립: 녹색 형광 단백질에 적용.미국화학회지 122, 5658 (2000).
- ^ a b c d e f g h i j k l Hu, C. D., Chinenov, Y. & Kerppola, T. K. 생체 세포에서 bZIP 및 Rel 패밀리 단백질 간의 상호작용을 바이몰레 형광 상보를 사용하여 시각화.Mol. 셀 9, 789 – 798 (2002).
- ^ Avilov, Sergiy V.; Aleksandrova, Nataliia (20 November 2018). "Fluorescence protein complementation in microscopy: applications beyond detecting bi-molecular interactions". Methods and Applications in Fluorescence. 7 (1): 012001. doi:10.1088/2050-6120/aaef01. ISSN 2050-6120. PMID 30457122.
- ^ 천, R. Y.녹색 형광 단백질.앤, 생화학 목사님67, 509–544 (1998).
- ^ a b c d e f g h "Kerppola Laboratory".
- ^ a b Kerppola, T. K. 살아있는 세포의 단백질 상호작용 연구를 위한 보완적 방법.Nat. 방법 3, 969~971 (2006)
- ^ a b c d e f g Hu, C. D. & Kerppola, T. K. 다색 형광 보완 분석을 사용하여 살아있는 세포에서 여러 단백질 상호작용을 동시에 시각화.Nat. Biotechnol. 21, 539-545(2003).
- ^ a b c d e f g h Morell, M. et al.쌍분자 형광보완에 의한 생체 내 단백질-단백질 상호작용의 간섭 모니터링: DnaK 케이스.프로테오믹스 8, 3433 – 3442 (2008).
- ^ a b c Kerppola, T. K. 살아있는 세포에서 단백질 상호작용의 프로브로서의 BiFC(bimolecular fluorence comperation) 분석.Annu. Biophys. 37, 465~487(2008).
- ^ a b c d "Archived copy". Archived from the original on 9 June 2010. Retrieved 4 March 2010.
{{cite web}}: CS1 maint: 제목으로 아카이브된 복사(링크) - ^ a b c d 팬, J.Y. 등살아있는 세포에서 단백질-단백질 상호작용을 시각화하기 위한 새로운 적색 이분자 형광 보완 시스템으로 mCherry를 분할한다.생화학.생물 물리학.의원님, 소통.367, 47–53 (2008).
- ^ a b 마이클, S. W., 이어, P. H., 맨더슨, E. N., 레미, I. 및 스테판, E.단백질 조각 보완 분석에 기초한 연구와 약물 발견의 보편적 전략.Nat. Rev.Drug Discov. 6, 569–582 (2007).
- ^ a b c 맥도날드, M. L. 등인간 세포에서 표적 외의 효과와 숨겨진 표현형 확인.냇. 화학.Biol. 2, 329~337(2006).
- ^ a b c Rackham, O. & Brown, C. M. 살아있는 세포의 RNA-단백질 상호작용 시각화: FMRP와 IMP1은 mRNA에서 상호작용합니다.EMBO J. 23, 3346 – 3355 (2004)
- ^ a b Remy, I., Wilson, I. A. & Michnick, S. W. Erythropoietin 수용체 활성화 리간드 유도 배위 변화에 의한.과학 283, 990-993(1999년).
- ^ a b Remy, I., Montmarquet, A. & Michnick, S. W. PKB/Akt는 Smad3와의 직접 상호작용을 통해 TGF-베타 신호를 변조합니다.Nat. Cell Biol. 6, 358–365 (2004)
- ^ Magliery, T. J. et al.녹색 형광 단백질 단편 재구성 트랩을 사용한 단백질-단백질 상호작용 검출: 범위 및 메커니즘.J. Am. Chem.Soc. 127, 146~157 (2005년)
- ^ Chen, Hong; Wiedmer, Stefanie; Hanig, Sacha; Entzeroth, Rolf; Kurth, Michael (2013). "Development of Eimeria nieschulzi (Coccidia, Apicomplexa) Gamonts and Oocysts in Primary Fetal Rat Cells". Journal of Parasitology Research. 2013: 591520. doi:10.1155/2013/591520. PMC 3703804. PMID 23862053.
- ^ Kerppola, Tom K (2008). "BIMOLECULAR FLUORESCENCE COMPLEMENTATION (BiFC) ANALYSIS AS A PROBE OF PROTEIN INTERACTIONS IN LIVING CELLS". Annual Review of Biophysics. 37: 465–87. doi:10.1146/annurev.biophys.37.032807.125842. PMC 2829326. PMID 18573091.
- ^ Varea, M; Clavel, A; Doiz, O; Castillo, F.J; Rubio, M.C; Gómez-Lus, R (1 December 1998). "Fuchsin fluorescence and autofluorescence in Cryptosporidium, Isospora and Cyclospora oocysts". International Journal for Parasitology. 28 (12): 1881–1883. doi:10.1016/S0020-7519(98)00146-5. ISSN 0020-7519. PMID 9925267.
- ^ Subotić, Ana; Swinnen, Erwin; Demuyser, Liesbeth; De Keersmaecker, Herlinde; Mizuno, Hideaki; Tournu, Hélène; Van Dijck, Patrick (2017). "A Bimolecular Fluorescence Complementation Tool for Identification of Protein-Protein Interactions in Candida albicans". G3: Genes, Genomes, Genetics. 7 (10): 3509–3520. doi:10.1534/g3.117.300149. PMC 5633398. PMID 28860184.
- ^ Diaz, Giacomo; Polonelli, Luciano; Conti, Stefania; Messana, Irene; Cabras, Tiziana; Putzolu, Martina; Falchi, Angela Maria; Fadda, Maria Elisabetta; Cosentino, Sofia; Isola, Raffaella (2005). "Mitochondrial alterations and autofluorescent conversion of Candida albicans induced by histatins". Microscopy Research and Technique. 66 (5): 219–28. doi:10.1002/jemt.20161. PMID 15940680. S2CID 41048574.
- ^ Sharma, Himanshu; Anand, Baskaran (7 July 2016). "Fluorescence bimolecular complementation enables facile detection of ribosome assembly defects in Escherichia coli". RNA Biology. 13 (9): 872–882. doi:10.1080/15476286.2016.1207037. PMC 5014008. PMID 27388791.
- ^ Jach, G;페쉬, M; 리히터, K;프링스, S;Uhrig, J.F.개량된 mRFP1은 쌍분자 형광보완에 붉은색을 첨가한다.Nat. 방법 3, 597–600 (2006)
- ^ 슈, Y, J, 류, H, 덩, X, 후, C.D.생리학적 조건 하에서 쌍분자 형광보완 분석을 위한 새로운 형광단백질 조각의 확인.바이오테크놀로지40, 61–66 (2006).
- ^ de Virgilio, M., Kiosses, W. B. & Shattil, S. J. 근위부, 선택 및 통합 알파 간의 동적 상호작용살아있는 세포에서 IIbeta3 및 단백질 티로신 키나아제.J. 셀바이올165, 305–311 (2004).
- ^ 통, E.H. 등전사인자 OREBP/TonEBP/NFAT5의 핵세포질트래픽 조절.J. Biol.화학 281, 23870-23879(2006)
- ^ 로페즈 기메네스, J. F., 캐널, M., 페디아니, J. D. & 밀리건, G.α1b-아드레노셉터는 고차 올리고머로 존재하며, 수용체 성숙, 표면 전달 및 기능을 위해서는 효과적인 올리고머화가 필요하다.몰. 약품. 71, 1015–1029 (2007).
- ^ 나카하라, S, 호간, V, 이노하라, H&라즈, A.갈렉틴-3의 수입 매개 핵 전위.J. Biol.화학 281, 39649-39659(2006)
- ^ 류, H. 등전사 활성화 및 세포하 국재화에 의한 c-Jun과 ATF2의 상호 조절.EMBO J. 25, 1058–1069 (2006)
- ^ Gwzdz, T. 등EcR과 Usp는 엑디스테로이드 핵수용체 복합체의 구성 요소로서 세포내 밀매를 지시하는 분자 결정 인자의 차이 분포를 보인다.셀. 신호. 19, 490–503 (2007).
- ^ Fan, M., Ahmed, K. M., Coleman, M. C., Spitz, D. R. & Li, J. Nuclear Factor-KappaB 및 망간 슈퍼옥사이드 디스무타아제는 저선량 조사 마우스 피부 상피세포에서 적응형 방사선 저항을 매개한다.게자리 67, 3220–3228(2007).
- ^ Wu, P., Daniel-Issakani, S., LaMarco, K. & Strulovici, B.자동화된 높은 처리량 여과 분석: 중합효소 억제제 식별에 적용.항문. 생화학.245, 226–230 (1997).
- ^ Stoevesandt, O. & Brock, R. 간접면역라벨링 및 형광교차상관분광법을 이용한 세포용해액 마이크로리터의 단백질 복합체 원스텝 분석.Nat. Protoc. 1, 223–229 (2006)
- ^ Bergendahl, V., Heyduk, T. & Burgess, R. R. Luminesence 공명 에너지 전달 기반의 높은 처리량 선별 분석 박테리아 RNA 중합효소에서의 필수 단백질-단백질 상호작용 억제제.적용. 환경.미생물69, 1492–1498 (2003).
- ^ 양, P. 등모세관 전기영동을 이용한 단백질-펩타이드 상호작용 및 억제 다중 검출.항문. 제79조, 1690~1695조 (2007년)
- ^ Fields, S. & Song, O. 단백질-단백질 상호작용을 검출하는 새로운 유전자 시스템.네이처 340, 245~246(1989)
- ^ a b Stynen, B; Tournu, H; Tavernier, J; Van Dijck, P (June 2012). "Diversity in genetic in vivo methods for protein-protein interaction studies: from the yeast two-hybrid system to the mammalian split-luciferase system". Microbiology and Molecular Biology Reviews. 76 (2): 331–82. doi:10.1128/MMBR.05021-11. PMC 3372256. PMID 22688816.
- ^ a b Kerppola, T. K. 형광보완에 의한 분자상호작용 시각화.Nat. Rev. Mol. Cell Biol. 7, 449-456 (2006).
- ^ 녹색 형광 단백질 돌연변이의 Creemers, T. M., Lock, A. J., Subramaniam, V., Jovin, T. M. & Volker, S. 광물리학 및 광학 스위칭.검사님, Natl.Academ. Sci. U. S. A. 97, 2974–2978 (2000)
- ^ Terskikh, A. et al. "형광 타이머" : 시간에 따라 색이 변하는 단백질.사이언스 290, 1585–1588 (2000).
- ^ van Thor, J. J., Gensch, T, Hellingwerf, K. J. & Johnson, L. N. UV 및 가시광선을 가진 녹색 형광 단백질의 광변환은 글루탐산염 222의 탈탄산화로 이어진다.Nat. 구조.Biol. 9, 37~41 (2002).
- ^ Schoeters, F; Van Dijck, P (2019). "Protein-Protein Interactions in Candida albicans". Frontiers in Microbiology. 10: 1792. doi:10.3389/fmicb.2019.01792. PMC 6693483. PMID 31440220.