생체 모방 합성
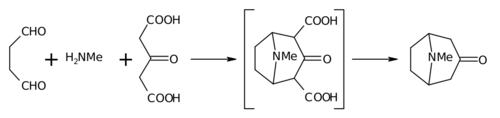
Biomimetic synthesis생체 모방 합성은 유기 화학 합성의 한 분야로 생물학적으로 특별히 영감을 받았다.이 용어는 제안된 생합성을 병행하도록 설계된 일련의 반응의 실행을 통한 "생합성의 가정"의 테스트와 바람직한 합성 목표를 목표로 한 합성 반응 또는 반응이 하나 이상의 알려진 것을 모방하도록 설계된 연구 프로그램을 모두 포함한다.n 확립된 생합성 [1][2]경로의 효소 변환.생체 모방 합성의 가장 이른 예는 로버트 로빈슨 경이 알칼로이드 트로피논을 [3]유기적으로 합성한 것이다.
공학적 선형 폴리는 알버트 Eschenmoser과 길버튼 Stork,[5][6]고 W.S. 존슨의 광범위한 연구에 의해 선형 polyenes의 양이온 cyclizations의 연구에 요건 init 규정하고 만든 4륜의 스테로이드 링 system,[4]를 제공하기 위해 보다 최근의 예는 E. 코리의carbenium-mediated 환화iate고환화를 종료하고 환화 중에 양이온성 카르베늄기를 안정화한다(자연은 [7]콜레스테롤과 같은 스테로이드 생합성 동안 효소를 통해 달성한다).제2의 정의와 관련하여 생물촉매(예를 들어 순수 단백질 촉매, 효소에 결합된 금속 또는 기타 보조인자 또는 리보자임)에 의해 자연에서 이루어지는 화학적 변환을 달성하기 위해 적용된 합성유기 또는 무기촉매는 생체모방합성을 달성하고 있다고 할 수 있다.그러한 촉매 시스템의 합리화는 생체 모방 [8][9][10]화학이라고 불려왔다.
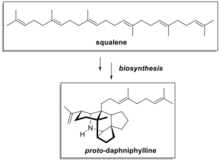
다프니필린 원생합성
다프니필린 원형은 다프니필름 마크로포디움에서 발견되는 알칼로이드 과의 생합성의 전구체이다.복잡한 분자구조로 인해 융합된 고리 구조와 스피로 탄소 중심 때문에 기존의 유기 합성 방법에 대한 도전적인 표적이 된다.클레이튼 히스콕과 동료들은 스쿠알렌에서 추출한 프로토 다프니필린의 제안된 생합성 경로를 바탕으로 단순한 시작 [11]물질에서 프로토 다프니필린의 현저하게 우아하고 짧은 토탈 합성을 개발했다.이것은 생체모방합성이 어떻게 복잡한 자연생물의 전체 합성을 단순화할 수 있는지를 보여주는 사례이다.
히스콕의 합성 경로의 주요 단계는 비순환적 디알데하이드 A 또는 B를 순환시켜 프로토 다프니필린을 형성하는 것입니다.양쪽 디알데하이드(A 또는 B)는 스쿠알렌과 유사한 탄소골격을 가지며, 간단한 시작 물질로부터 합성할 수 있다.A 또는 B를 수산화칼륨, 암모니아 및 아세트산을 포함한 일련의 단순 시약으로 처리하면 프로토 다프니필린이 생성되었다.6개의 γ본드와 5개의 링이 이 놀라운 스텝으로 형성되었습니다.히드록실디히드로피란 중간체 C는 디알데히드 시작물질(A)을 수산화칼륨으로 처리했을 때 처음 형성되었다고 최초 보고서에서 제안되었다.중간체 C와 암모니아 반응에서 2-aza-1, 3-디엔 중간체(D)가 생성되었다.산촉매 Diels-Alder 반응이 중간 E를 형성하고, 이 중간 E가 반응 조건하에서 최종 생성물로 변환되었다.
위키피디아에서 생체모방 합성 예
- 카파논, 채프먼 접근법으로
- 스피로트리프로스타틴B, 가네산접근법
- 엔디안드산, Nicolaou 접근방식을 통한 생체 모방 토탈 합성 참조
생체 모방 합성에 대한 추가 문헌 사례
- 나키테르피오신형 C-nor-D-호모스테로이드의 Merck 합성. 예: 구조: C-13 원자[12] 이동을 통해 절단, 수축 및 확장 고리(세코, 노, 호모스테로이드)
- 테트라/펜타사이클화 캐스케이드를[13][14] 통한 스쿠알렌 유래 다프니필린형 알칼로이드(예: 다프니필름)의 히스콕 합성
레퍼런스
- ^ de la Torre MC, Sierra MA (January 2004). "Comments on recent achievements in biomimetic organic synthesis". Angew. Chem. Int. Ed. Engl. 43 (2): 160–81. doi:10.1002/anie.200200545. PMID 14695603.
- ^ van Tamelen EE (1961). "Biogenetic-type syntheses of natural products". Fortschritte der Chemie Organischer Naturstoffe / Progress in the Chemistry of Organic Natural Products / Progrès dans la Chimie des Substances Organiques Naturelles. Fortschr. Chem. Org. Naturst. Vol. 19. pp. 242–290. doi:10.1007/978-3-7091-7156-1_5. ISBN 978-3-7091-7158-5. PMID 13924635.
- ^ Robinson R (1917). "LXIII. A Synthesis of Tropinone". Journal of the Chemical Society, Transactions. 111: 762–768. doi:10.1039/CT9171100762.
- ^ Corey EJ, Luo G, Lin LS (1997). "A simple enantioselective synthesis of the biologically active tetracyclic marine sesterterpene scalarenedial". J. Am. Chem. Soc. 119 (41): 9927–28. doi:10.1021/ja972690l.
- ^ Eschenmoser A, Felix D, Gut M, Meier J, Stadler P (1959). "Some aspects of acid-catalysed cyclizations of terpenoid polyenes". In Wolstenholme GE, O'Conner M (eds.). Ciba Foundation Symposium on the Biosynthesiis of Terpenes and Steroids. Novartis Foundation Symposia. London: J. & A. Churchill. pp. 217–230. doi:10.1002/9780470719121.ch14. ISBN 9780470719121.
- ^ Stork G, Burgstrahler AW (1955). "The stereochemistry of polyene cyclization". J. Am. Chem. Soc. 77 (19): 5068–77. doi:10.1021/ja01624a038.
- ^ Johnson WS, Marshall JA, Keana JF, Franck RW, Martin DG, Bauer JV (1966). "Steroid total synthesis—hydrochrysene approach—XVI: Racemic conessine, progesterone, cholesterol, and some related natural products". Tetrahedron. 22: 541–601. doi:10.1016/S0040-4020(01)90961-5.
- ^ Breslow R (January 2009). "Biomimetic chemistry: biology as an inspiration". The Journal of Biological Chemistry. 284 (3): 1337–42. doi:10.1074/jbc.X800011200. PMID 18784073.
- ^ Lee SC, Holm RH (April 2003). "Speculative synthetic chemistry and the nitrogenase problem". Proceedings of the National Academy of Sciences of the United States of America. 100 (7): 3595–600. doi:10.1073/pnas.0630028100. PMC 152967. PMID 12642670.
- ^ Breslow R (1995). "Biomimetic chemistry and artificial enzymes: Catalysis by design". Accounts of Chemical Research. 28 (3): 146–153. doi:10.1021/ar00051a008.
- ^ Piettre S, Heathcock CH (June 1990). "Biomimetic total synthesis of proto-daphniphylline". Science. 248 (4962): 1532–4. Bibcode:1990Sci...248.1532P. doi:10.1126/science.248.4962.1532. PMID 17818314. S2CID 37777797.
- ^ Gao S, Chen C (2012). "Nakiterpiosin". In Li JJ, Corey EJ (eds.). Total Synthesis of Natural Products: At the Frontiers of Organic Chemistry. Berlin: Springer. pp. 25–38. ISBN 978-3-642-34065-9.
- ^ Heathcock CH, Hansen MM, Ruggeri RB, Kath JC (1992). "Daphniphyllum alkaloids. 11. Biomimetic total synthesis of methyl homosecodaphniphyllate. Development of the tetracyclization reaction". Journal of Organic Chemistry. 57 (9): 2544–53. doi:10.1021/jo00035a008.
- ^ Heathcock CH, Piettre S, Ruggeri RB, Ragan JA, Kath JC (1992). "Daphniphyllum alkaloids. 12. A proposed biosynthesis of the pentacylic skeleton. proto-Daphniphylline". Journal of Organic Chemistry. 57 (9): 2554–66. doi:10.1021/jo00035a009.
추가 정보
- Poupon E, Nay B, eds. (2011). Biomimetic Organic Synthesis. Alkaloids. Vol. 1. Wiley-VCH Verlag GmbH & Co. KGaA. doi:10.1002/9783527634606. ISBN 978-3-527-32580-1.
- Ashely E (January 5, 2004). "Biomimetic Synthesis of Natural Products" (PDF). Literature Seminar, Stoltz Research Group. California Institute of Technology. Archived from the original (PDF) on June 23, 2010. Retrieved November 24, 2013.