콜드 PCR
COLD-PCRCOLD-PCR(저변성 온도 PCR에서의 공동증폭)은 야생형과 돌연변이를 포함한 DNA의 혼합으로부터 변이형 대립 유전자를 풍부하게 하는 변형 중합효소 연쇄반응(PCR) 프로토콜이다.과잉 야생형 대립 유전자가 존재할 때 소수 대립 유전자와 저수준 체세포 DNA 돌연변이를 우선적으로 증폭하고 식별하는 능력은 돌연변이 검출에 유용하다.돌연변이의 검출은 조직 생체검사와 혈장이나 혈청 등의 체액에서 암 조기 검출, 수술이나 화학요법 후 잔류 질환 평가, 예후 또는 개별 환자에 대한 맞춤형 치료를 위한 질병 단계 및 분자 프로파일링, 치료 결과와 암 모니터링의 경우에 중요하다.방출 또는 재발.일반적인 PCR은 큰(야생형) 대립 유전자와 작은(변이형) 대립 유전자를 동일한 효율로 증폭시켜 낮은 수준의 돌연변이의 존재를 쉽게 검출할 수 있는 능력을 방해한다.변종/야생 DNA 혼합물의 돌연변이를 검출하는 능력은 암 생체 검사의 경우처럼 이종 샘플과 함께 제공될 때 변종 DNA 혼합물이 발생할 수 있기 때문에 중요하다.현재, 전통적인 PCR은 유전자형 또는 체세포 돌연변이의 검출을 위해 많은 다른 하류 분석과 함께 사용된다.여기에는 RFLP 분석, MALDI-TOF(매트릭스 지원 레이저 탈착-비행 시간) 유전자형 또는 생거 염기서열 분석 또는 파이로시퀀싱에 의한 돌연변이 검출을 위한 직접 염기서열 분석이 포함될 수 있다.이러한 다운스트림 검사를 위해 기존의 PCR을 COLD-PCR로 대체하면 종양과 체액을 포함한 혼합 검체의 돌연변이 검출에 대한 신뢰성이 향상됩니다.
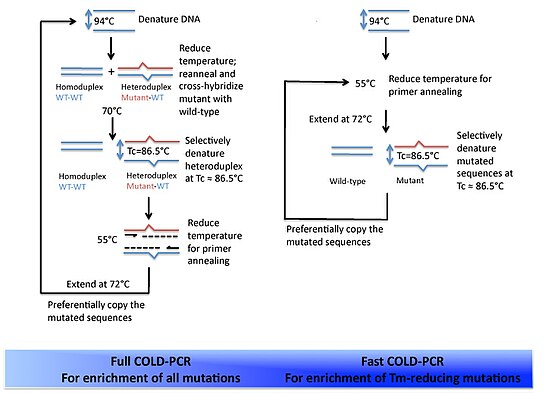
COLD-PCR 방식의 개요
COLD-PCR의 기본 원리는 단일 뉴클레오티드 불일치가 이중 가닥 DNA의 용해 온도(Tm)를 약간 변화시킨다는 것입니다.불일치의 시퀀스 컨텍스트와 위치에 따라 최대 200bp 이상의 시퀀스에 대해 0.2–1.5°C(0.36–2.7°F)의 Tm 변화가 일반적입니다.이를 알고 프로토콜 작성자들은 두 가지 관찰 결과를 이용했다.
- 각 이중 가닥 DNA는 Tm보다 낮은 '임계 온도'(Tc)를 가집니다.PCR 증폭 효율은 Tc 이하로 현저하게 떨어집니다.
- Tc는 DNA 배열에 의존합니다.PCR의 변성 단계가 Tc로 설정되어 있는 경우, 1개 또는 2개의 뉴클레오티드 불일치만으로 다른 2개의 템플릿 DNA 조각은 다른 증폭 효율을 가진다.
저자들은 이러한 원칙을 염두에 두고 다음과 같은 일반 프로토콜을 개발하였다.
- 변성 단계.DNA는 고온 – 보통 94°C(201°F)에서 변성됩니다.
- 중간 어닐링 단계.돌연변이와 야생형 대립 유전자의 교배가 가능한 중간 아닐 온도를 설정한다.돌연변이 대립 유전자 DNA가 혼합물에서 DNA의 소수를 형성하기 때문에 그들은 야생형 DNA와 불일치 헤테로듀플렉스 DNA를 형성할 가능성이 더 높을 것이다.
- 녹는 단계.이러한 헤테로 이중플렉스는 낮은 온도에서 더 쉽게 녹습니다.따라서 Tc에서 선택적으로 변성됩니다.
- 프라이머 어닐링 단계.호모 듀플렉스 DNA는 우선 이중 가닥을 유지하며 프라이머 어닐링에 사용할 수 없습니다.
- 확장 단계DNA 중합효소는 템플릿 DNA에 상보적으로 확장될 것이다.헤테로듀플렉스 DNA가 템플릿으로 사용되기 때문에, 더 많은 비율의 작은 변종 DNA가 증폭되어 후속 PCR 라운드에 사용할 수 있게 될 것이다.
현재까지 개발된 COLD-PCR에는 두 가지 형태가 있습니다.풀 COD-PCR 및 고속 COD-PCR.
풀 콜드 PCR
Full COLD-PCR은 위에서 설명한 프로토콜과 동일합니다.이 5단계는 각 증폭 라운드에 사용됩니다.
고속 COD-PCR
Fast COLD-PCR은 Full COLD-PCR과 달리 변성 및 중간 아닐 단계를 건너뜁니다.이는 경우에 따라 돌연변이 DNA의 선호 증폭이 너무 커서 돌연변이/야생형 헤테로듀플렉스 DNA의 형성을 보장할 필요가 없기 때문이다.따라서 변성은 Tc에서 발생할 수 있으며 프라이머 어닐링과 중합효소 매개 확장을 진행할 수 있습니다.증폭의 각 라운드는 이 세 단계를 순서대로 포함합니다.낮은 변성 온도를 활용하면 Tm이 낮은 제품, 즉 변종 대립 유전자에 대한 반응이 구별됩니다.Fast COLD-PCR은 프로토콜의 단축으로 인해 훨씬 더 빠른 결과를 생성합니다.그러나 Full COLD-PCR은 DNA의 시작 혼합에서 가능한 모든 돌연변이를 증폭하는 데 필수적입니다.
2라운드 COLD-PCR은 Fast COLD-PCR의 변경 버전입니다.Fast COLD-PCR의 두 번째 라운드에서는 네스트된 프라이머가 사용됩니다.이것에 의해, 1 라운드 Fast COLD-PCR [1]에 비해 돌연변이 검출의 감도가 향상됩니다.
지금까지의 COLD-PCR 사용
COLD-PCR은 기존의 PCR을 사용하는 다수의 다른 분석의 신뢰성을 향상시키기 위해 사용되어 왔습니다.
RFLP 및 콜드 PCR
제한 단편 길이 다형성은 야생형 DNA를 절단하지 않는 선택된 제한효소에 의해 특정 돌연변이에 대한 DNA의 절단(또는 그 결여)을 초래한다.일반 PCR 또는 COLD-PCR에 의해 증폭된 DNA를 포함하는 야생형과 돌연변이의 혼합물을 사용한 연구에서 RFLP 분석 이전의 COLD-PCR은 돌연변이 검출을 10~[2]20배 향상시키는 것으로 나타났다.
생거 시퀀싱 및 COLD-PCR
생어 시퀀싱은 최근 1:20 돌연변이: 야생형 DNA의 혼합물에서 돌연변이 DNA의 농도를 평가하기 위해 사용되었다.돌연변이를 포함한 변종 DNA는 p53 [1]돌연변이를 포함하는 것으로 알려진 유방암 세포주로부터 얻어졌다.Sanger 염기서열 분석 크로마토그램 비교 결과 COLD-PCR을 사용했을 때 돌연변이 대립 유전자가 [1]기존 PCR에만 비해 13배 농축되었다.이는 변종 대립 유전자 위치의 크로마토그램의 피크 크기에 의해 결정되었습니다.
또한 COLD-PCR을 사용하여 폐 아데노카시노종 검체에서 p53 돌연변이를 검출하였다.연구는 변종 염기서열 DNA에 대해 농축되지 않는 기존 방법을 사용하면 놓쳤을 가능성이 있는 8개의 낮은 수준(20% 미만의) 돌연변이를 검출할 수 있었다.
파이로시퀀싱 및 COLD-PCR
직접 생거 염기서열 분석에서 사용하는 것과 유사하게, 파이로시퀀싱 COLD-PCR은 사용된 [3]샘플에서 0.5~1%의 유병률을 가진 돌연변이를 검출할 수 있는 것으로 나타났다.COLD-PCR은 파이로시퀀싱을 통해 p53과 KRAS 돌연변이를 검출하는 데 사용되었으며, 두 경우 모두 기존 PCR보다 성능이 우수한 것으로 나타났다.
MALDI-TOF 및 콜드 PCR
COLD-PCR을 개발하여 유전자형에 대한 일반 PCR의 민감도를 직접 생거 염기서열 분석, RFLP 및 파이로시퀀싱과 비교하기 위해 사용한 연구 그룹도 돌연변이 검출을 위한 다운스트림 애플리케이션으로 MALDI-TOF를 사용하여 유사한 연구를 수행했다.그 결과 COLD-PCR은 DNA 혼합물의 돌연변이 시퀀스를 10~100배 농축할 수 있으며 초기 유병률 0.1~0.5%의 돌연변이를 검출할 [4]수 있었다.기존 PCR에서 예상되는 5~10%의 낮은 수준의 검출율과 비교된다.
QPCR 및 COLD-PCR
돌연변이에 특화된 TaqMan 프로브를 사용하여 정량 PCR 기계에서 COLD-PCR을 실행하면 돌연변이 샘플과 야생형 [4]샘플 간의 측정된 차이가 증가하는 것으로 나타났다.
COLD-PCR의 이점
- 돌연변이 유형과 위치에 관계없이 알려진 소수 대립 유전자와 알려지지 않은 소수 대립 유전자를 모두 농축할 수 있는 단일 단계 방법.
- 별도의 시약이나 특수 기계가 필요하지 않습니다.따라서 비용이 증가하지 않습니다.
- 혼합 검체에서의 돌연변이 검출에는 기존의 PCR보다 우수합니다.
- 기존 PCR에 비해 실험 실행 시간을 크게 늘리지 않습니다.
COLD-PCR의 단점
- 각 엠프리콘에 대해 최적의 Tc를 측정하여 결정해야 합니다.기존 PCR 기반 절차에 추가 단계 추가
- PCR 중 ± 0.3°C(0.54°F) 이내로 정확한 변성 온도 제어 요구 사항.
- 돌연변이 DNA 배열과 야생형 DNA 배열을 구별하는 적절한 임계 온도가 없을 수 있습니다.
- 약 200bp보다 작은 시퀀스를 분석하도록 제한됩니다.
- 중합효소 유도 오류에 취약합니다.
- DNA 위치 및 뉴클레오티드 치환에 따라 달라지는 가변적인 전체 돌연변이 농축.
- 모든 낮은 수준의 돌연변이가 우선적으로 농축된다는 보장은 없다.
역사
COLD-PCR은 2008년 하버드 의대 [2]다나 파버 암 연구소의 마이크 마크리고스 연구팀이 발표한 네이처 메디신(Nature Medicine) 논문에서 Li 등에 의해 처음 기술되었다.위에서 요약한 바와 같이, 이 기술은 많은 원리 증명 실험과 의학 연구 진단 실험에 사용되어 왔습니다.
최근 COLD-PCR 기술은 Transgenomic, Inc.에 의해 라이선스되었습니다.라이센스 조건에는 Sanger 시퀀싱과 결합된 기술을 상용화할 수 있는 독점권이 포함됩니다.이 계획은 저수준의 체세포와 미토콘드리아 DNA [5]돌연변이의 빠른 고감도 검출을 가능하게 하는 상업적인 응용 프로그램을 개발하는 것이다.
대체 수단
소수 DNA 돌연변이를 검출하기 위해 다른 기술을 사용할 수 있으며, 이러한 방법들은 알려진 돌연변이와 알려지지 않은 [6]돌연변이를 풍부하게 하고 검출하는 능력으로 분리될 수 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c Li J, Milbury CA, Li C, Makrigiorgos GM (November 2009). "Two-round COLD-PCR-based Sanger sequencing identifies a novel spectrum of low-level mutations in lung adenocarcinoma". Human Mutation. 30 (11): 1583–90. doi:10.1002/humu.21112. PMC 2784016. PMID 19760750.
- ^ a b Li J, Wang L, Mamon H, Kulke MH, Berbeco R, Makrigiorgos GM (May 2008). "Replacing PCR with COLD-PCR enriches variant DNA sequences and redefines the sensitivity of genetic testing". Nature Medicine. 14 (5): 579–84. doi:10.1038/nm1708. PMID 18408729. S2CID 205385306.
- ^ Zuo Z, Chen SS, Chandra PK, et al. (August 2009). "Application of COLD-PCR for improved detection of KRAS mutations in clinical samples". Modern Pathology. 22 (8): 1023–31. doi:10.1038/modpathol.2009.59. PMID 19430420.
- ^ a b Li J, Makrigiorgos GM (April 2009). "COLD-PCR: a new platform for highly improved mutation detection in cancer and genetic testing". Biochemical Society Transactions. 37 (2): 427–32. doi:10.1042/BST0370427. PMID 19290875.
- ^ Laboratorytalk editorial team (Oct 2009). "Transgenomics licenses COLD-PCR technology". Archived from the original on 2011-07-18. Retrieved 2010-03-04.
- ^ Milbury CA, Li J, Makrigiorgos GM (April 2009). "PCR-Based Methods for the Enrichment of Minority Alleles and Mutations". Clinical Chemistry. 55 (4): 632–40. doi:10.1373/clinchem.2008.113035. PMC 2811432. PMID 19201784.