코넥슨
Connexon| 코넥슨 | |
|---|---|
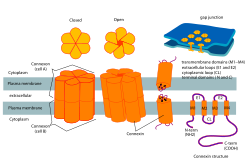 코넥슨 및 코넥신 구조 | |
| 세부 사항 | |
| 식별자 | |
| 라틴어 | 코넥소나 |
| TH | H1.00.01.1.02025 |
| 해부학적 용어 | |
생물학에서 코넥신혈모세포라고도 알려진 코넥슨은 코넥신이라고 불리는 6개의 단백질의 집합체로서 인접한 두 세포의 세포질 사이의 갭 접합을 위해 모공을 형성한다. 이 채널은 이온과 신호 분자의 양방향 흐름을 허용한다.[1] 커넥션은 접합부의 한쪽 면에 있는 셀에 의해 공급되는 헤미칸넬이다; 반대쪽 셀에서 온 두 개의 커넥터는 보통 완전한 세포간 간격 접합 채널을 형성하기 위해 함께 모인다. 그러나 일부 세포에서는 혈전 자체가 세포질과 세포외 공간 사이의 통로로서 활발히 작용하여 1-2KDa 이하의 이온과 작은 분자의 전이가 가능하다 세포내 신호에서 그들의 핵심적 역할을 시사하는 새로운 증거 외에 이러한 커넥션의 기능에 대해서는 거의 알려져 있지 않다.[2]
동일한 유형의 커넥팅스로 만들어진 커넥팅슨은 동음이의어로 간주되는 반면, 다른 유형의 커넥팅스로 만들어진 커넥팅슨은 이형이다.[3]
구조
조립
커넥션의 조립은 셀 내 커넥틴의 합성으로 시작하여 셀 막에 갭 접속 채널 플라크가 형성되는 것으로 끝난다. 커넥션을 구성하는 코넥신 소단위 단백질은 세포 내 소포체 망막에서 합성된다. 이 서브유닛들은 골지 기구에 있는 커넥넥슨으로 과점되거나 다른 작은 부품들과 결합된다.[4] 그런 다음 커넥터는 혈장 막의 적절한 위치로 전달된다. 그런 다음 코넥슨은 인접한 셀에서 호환되는 커넥션과 도킹하여 갭 접합 채널 판을 형성한다.[4] 이 과정의 많은 부분은 다른 효소와 단백질의 인산화 작용에 의해 매개되어 특정 단백질 간의 상호작용을 허용하고 방지한다.[4]
일반
코넥슨은 갭 접합부의 형성에 기여하며, 신경 경로에서 전기 시냅스의 필수적인 구성 요소다.[4] 단일 갭 접점에서, 커넥터는 코넥신들로 구성된 헤미 채널을 형성하면서 수성 다공성 막 주위에 모일 것이다. 코넥신은 연결을 구성하고 갭 결합을 형성하는 데 중요한 역할을 하는 더 작은 단백질 분자들이다. 구조적으로, 코넥신은 세포외 루프 2개와 세포질 루프 1개로 연결된 4개의 알파 나선형 투과선 영역으로 구성되는 반면, N과 C 단자는 세포 내 상주한다. 코넥신 종류는 예측 분자량(예: 코넥신 43은 분자량 43kDa로 Cx 43)을 사용하여 더욱 구별할 수 있다. 코넥슨은 헤미 채널을 인접한 세포막의 다른 헤미 채널에 도킹하여 갭 접점을 형성한다.[2] 이 단계 동안, 두 플라즈마 막에 걸쳐 있는 세포간 채널의 형성이 발생한다. 그 후, 이 과정은 뉴런들 사이에서 전기 시냅스가 어떻게 촉진되는지 더 잘 이해하도록 이끈다.[2]
분해
코넥슨 구조는 플라즈마 막에서 제거되어 성능이 저하된다. 코넥슨은 (헤미 채널의 도킹으로 인해) 이중 멤브레인 채널 구조로서 셀 자체에 의해 내장될 것이다.[4] 이것을 내분 또는 내분증이라고 한다. 연구에 따르면 일반적으로 두 가지 이상의 방법을 사용하여 간극 접합을 내실화할 수 있지만 가장 잘 알려져 있고 가장 많이 연구되는 것은 쇄도 매개 내피세포증일 것이다.[4] 간단히 말해서, 이 과정은 막의 특정 부분이 클라트린으로 코팅되도록 수용체 신호에 대한 리간드 결합으로 구성된다.[4] 그리고 나서 이 막의 이 부분은 방광막을 형성하는 세포 안으로 싹이 튼다. 이제 세포막에 존재하는 커넥터는 라이소솜의 경로에 의해 분해될 것이다.[4] 라이소솜은 이 과정을 위해 특별히 만들어진 특정한 효소를 포함하고 있기 때문에 커넥션의 단백질을 분해할 수 있다. 편재 신호는 세포 내의 열화를 신호로 하는 것으로 생각된다.[4]
셀룰러
특성.
개별 코넥신 단백질의 성질은 전체 코넥슨 채널의 전반적인 성질을 결정한다. 채널의 투과성과 선택성은 그 폭은 물론 전하 선택성과 같은 커넥틴의 분자 선택성에 의해 결정된다.[2] 연구에 따르면, 커넥터는 특히 수용성 두 번째 메신저, 아미노산, 뉴클레오티드, 이온, 포도당 등에 침투할 수 있다.[2] 채널도 전압에 민감하다. 커넥션 채널은 두 셀의 내부 사이의 전압 차이에 따라 열리거나 닫히는 전압 의존 게이트가 있다.[2] 게이츠는 셀 내부와 외부와의 전압 차이(즉, 멤브레인 전위)에 따라 전압 감도를 나타낼 수도 있다.[2]
변조
갭-준딩 간의 통신은 여러 가지 방법으로 변조/조절될 수 있다. 변조의 주요 유형은 다음과 같다.
- 화학 – 한 가지 일반적인 유형의 화학 변조는 Ca와2+ 특정 영역의 커넥틴의 상호작용을 통해 이루어진다. 완전히 이해되지는 않지만, 이러한 상호작용으로 Ca가2+ 채널의 모공을 차단하게 되는 것이 제안된다. 또 다른 형태의 화학적 변조는 채널의 산화에 대한 반응(세포 내 pH의 감소)을 통해 이루어진다. 세포내 산성화는 c-단자 코넥신 영역에 변화를 일으켜 채널 활동을 감소시키는 것으로 밝혀졌다.[2]
- 단백질 인산화 – 단백질 인산화:골기기구로부터의 코넥신 밀거래, 특정 지역에 대한 코넥슨 축적, 불필요한 채널의 저하 등을 제어함으로써 채널 간 통신을 다방면으로 조절한다. 이러한 작용의 과정은 매우 복잡하지만 단백질 인산화의 관여는 알려져 있다.[2]
- 갭 접합 통신의 유머 변조는 신경 전달 물질, 성장 요인 및 다양한 생체 활성 화합물과 같은 많은 생체 분자를 통해 이루어진다. 에피네프린과 노르에피네프린과 같은 신경전달물질은 뉴런 간극정합에서 작용하여 작용전위를 뉴런으로 전달한다. 이러한 유형의 변조를 가진 이러한 종류의 간극 결합은 심장 조직과 척추동물 망막의 뉴런에서 종종 발견된다.[2]
전체함수
코넥슨은 행동과 신경생리학에서 필수적인 역할을 한다. 그들의 병리학적 기능을 둘러싼 많은 세부 사항들은 연구가 최근에야 시작되었기 때문에 여전히 알려지지 않고 있다. 중추신경계(CNS)에서는 간질, 허혈, 염증, 신경퇴행 등의 질환에서 커넥터가 큰 역할을 한다.[1] 커넥터가 위에 열거된 조건에서 어떻게 역할을 하는지에 관한 분자 메커니즘은 아직 완전히 이해되지 않았으며, 추가 연구 중에 있다. CNS에서의 그들의 주요 역할과 함께, 커넥터는 심장 조직의 기능에서 중요하다. 직접 연결은 심장의 뉴런을 빠르고 동시에 발사할 수 있게 하는데, 이것은 심장이 빠르게 뛰고 특정 자극에 반응하여 그 속도를 변화시키는 능력을 설명한다.[2] 코넥슨 또한 세포 발달에 필수적인 역할을 한다. 특히, 특정 질병/병리학 동안 뇌 회복뿐만 아니라 뇌 발달을 다루는 신경 유전자에서 그들의 역할은 세포 증식뿐만 아니라 두 세포 분열에도 도움을 준다. 그러나 이러한 과정에서 커넥션이 도움을 주는 메커니즘은 여전히 연구되고 있지만, 현재 이 메커니즘은 퓨린성 신호(purinergic signing, adenosine, ATP와 같은 뉴클레오시드와 뉴클레오시드로 매개되는 세포외 신호의 형태)와 ATP로의 투과성을 포함하는 것으로 이해되고 있다.[1] 연결기의 다른 중요한 역할은 포도당 감지 및 신호 전달이다. 코넥슨은 세포외 포도당 농도의 변화를 유발하여 먹이/안전성 행동, 수면-웨이크 주기, 에너지 사용에 영향을 미친다.[1] 추가 연구는 (아직도 메커니즘이 완전히 이해되지 않은) 커넥션에 의해 매개되는 포도당 흡수율이 증가하고 높은 스트레스와 염증이 발생하는 시기에는 증가한다는 것을 보여준다.[1] 최근의 연구는 또한 커넥션이 시냅스성 가소성, 학습, 기억, 시각, 센서리모터 게이팅에 영향을 미칠 수 있다는 것을 보여준다.
관련 질병
커넥션과 관련된 질병들 중 일부는 심혈관 질환과 당뇨인데, 이것은 인체가 세포에 의한 포도당 흡수를 위한 인슐린을 생산할 수 없고, 코넥신이라고 불리는 작은 커넥션의 단위의 저하로 심장 질환을 일으킬 수 있다. 심혈관 질환과 당뇨병은 1형과 2형으로 심장과 췌장의 세포 내 유사한 위치에 영향을 미친다. 이 위치는 커넥터가 전기 송신을 통한 신속한 셀 대 셀 상호작용을 촉진하는 갭 접점이다. 간경련은 심장근육과 같은 신경종말에서 나타나는 경우가 많으며 간에서 동점근성을 유지하고 신장의 적절한 기능을 유지하는 데 중요하다. 갭 접합 자체가 커넥션 헤미칸넬에 의해 형성된 특수한 투과성 단백질인 구조다.[5] 심혈관 질환과 아마도 I형과 II형 당뇨병은 각각 갭 접점을 구성하는 주요 단백질 코넥신과 연관되어 있다.
심혈관질환에서 cx43(connexin 43)은 코넥슨의 서브단위인 갭 접합부의 일반 단백질로, 심장의 동기화된 박동을 촉진하는 중간 디스크의 근세포 근육세포를 자극한다. 심혈관 질환의 발생 시 Cx43 서브유닛은 산화스트레스의 징후를 보이기 시작하는데, 이는 나이나 식이요법으로 인한 유해한 독소의 축적을 억제할 수 있는 심장의 능력으로서 혈관 기능이 저하되는 결과를 초래한다.[5] 또한, 심근경색 후 상처의 심실재몰딩과 치유에 한 몫을 하는 혈관조직의 Cx43 감소된 표현이 구조적인 심장질환에 존재한다.[6] 그러나 심장에 있는 Cx43의 메커니즘은 아직 제대로 파악되지 않고 있다.[6] 전반적으로 Cx43 표현과 산화제 스트레스의 이러한 변화는 심장의 조정된 박동에 이상을 초래하여 심장 부정맥으로 귀결될 수 있다.[5]
코넥슨은 또한 1형 당뇨병과 2형 당뇨병과 모두 연관되어 있다. Cx36(connexin 36) 하위 장치는 간 및 췌장의 갭 접합으로부터 인슐린 배설과 포도당 유도 인슐린 분비를 매개한다.[3] 간 및 췌장 장기의 동점선은 내분비 신호라고 불리는 복잡한 세포 상호작용 시스템에 의해 지탱된다. 멀리 떨어진 장기를 겨냥하기 위해 혈류로 호르몬이 분비되는 것이다. 그러나 췌장과 간에서 내분비 신호는 신호 경로, 이온 통로, G단백 결합 수용체, 티로신-키나아제 수용체, 세포간 접촉에 의해 세포막의 단거리를 따라 작용한다.[3] 내분비 신호 중재로 지지되는 이러한 조직 내의 틈새 접합은 인접한 셀을 서로 밀착시켜 서로 연결함으로써 세포와 더 큰 장기 시스템 사이의 세포 내 신호에 의해 지지된다. 갭 접합부의 Tight fit은 조직 내의 세포가 보다 효율적으로 의사소통할 수 있고 동점선을 유지할 수 있는 것이다. 따라서 갭 접점의 목적은 이온, 영양소, 대사물, 두 번째 전달자, 작은 생물학적 분자의 통로를 조절하는 것이다.[3] 당뇨병에서 Cx36의 후속 손실 또는 저하는 췌장 내 인슐린 생산을 실질적으로 억제하고 간 내 포도당은 전신의 에너지 생산에 필수적이다. Cx36의 결핍은 이러한 조직 내에서 갭 접합이 작동하여 기능 저하를 초래하고 가능한 질병에 영향을 미친다. 갭접합부의 상실이나 저하와 관련된 유사한 증상이 제2형 당뇨병에서도 관찰되었지만, 인간의 제1형 당뇨병과 제2형 당뇨병의 Cx36의 기능은 아직 알려져 있지 않다. 또한, Cx36 코넥신은 제2형 당뇨병의 유전자 위치 및 당뇨병 증후군에 대한 성향을 가진 GJD2 유전자에 의해 코딩된다.[3]
참조
- ^ a b c d e Cheung, Giselle; Chever, Oana; Rouach, Nathalie (2014-11-04). "Connexons and Pannexons: Newcomers in Neurophysiology". Frontiers in Cellular Neuroscience. 8: 348. doi:10.3389/fncel.2014.00348. PMC 4219455. PMID 25408635.
- ^ a b c d e f g h i j k Herve, Jean-Claude; Derangeon, Mickael (2012-09-01). "Gap-junction-mediated cell-to-cell communication". Cell and Tissue Research. 352 (1): 21–31. doi:10.1007/s00441-012-1485-6. PMID 22940728. S2CID 176666.
- ^ a b c d e Wright, Josephine; Richards, Toby; Becker, David (2012-03-01). "Connexins And Diabetes". Cardiology Research and Practice. 2012: 496904. doi:10.1155/2012/496904. PMC 3303578. PMID 22536530.
- ^ a b c d e f g h i Thevenin, Anastasia F (2013-03-07). "Proteins and Mechanisms Regulating Gap-Junction Assembly, Internalization, and Degradation". Physiology. 28 (2): 93–116. doi:10.1152/physiol.00038.2012. PMC 3768091. PMID 23455769.
- ^ a b c Tomaselli, Gordon F. (2010-12-04). "Oxidant stress derails the cardiac connexon connection". Journal of Clinical Investigation. 120 (1): 87–89. doi:10.1172/jci41780. PMC 2798705. PMID 20038808.
- ^ a b Zhang, Yan; Wang, Hongtao; Kovacs, Attila; Kanter, Evelyn; Yamada, Kathryn (2010-02-01). "Reduced expression of Cx43 attenuates ventricular remodeling after myocardial infarction via impaired TGF-β signaling". American Journal of Physiology. Heart and Circulatory Physiology. 298 (2): H477-87. doi:10.1152/ajpheart.00806.2009. PMC 2822575. PMID 19966054.
추가 읽기
- Andrew L Harris and Darren Locke (2009). Connexins, A Guide. New York: Springer. p. 574. ISBN 978-1-934115-46-6.


