근육세포
Muscle cell| 근육세포 | |
|---|---|
 | |
| 세부 사항 | |
| 위치 | 근육 |
| 식별자 | |
| 라틴어 | 근구균류 |
| 메쉬 | D032342 |
| TH | H2.00.05.0.00002 |
| FMA | 67328 |
| 미세해부술의 해부학적 용어 | |
근육 세포는 또한 심근 세포 또는 평활근 세포 둘 다 작은 [1]세포이기 때문에 근육 세포라고 알려져 있다.골격근 세포는 길고 실처럼 많은 핵을 가지고 있으며 근육 [1]섬유라고 불립니다.근육 세포는 [2]근아세포라고 불리는 배아 전구 세포로부터 발달합니다.
근아세포는 [3][4]근생성이라고 알려진 과정에서 합성세포로 알려진 다핵 골격근 세포를 형성하기 위해 융합한다.골격근세포 및 심근세포는 근섬유와 육갑을 포함하고 있으며 줄무늬근조직을 [5]형성한다.
심장근육세포는 심장실 벽에서 심장근육을 형성하고 하나의 [6]중심핵을 가지고 있다.심근세포는 삽입된 디스크에 의해 인접한 세포에 결합되며 가시적인 단위로 결합되면 [7]심근섬유라고 한다.
평활근 세포는 식도와 위장의 연동 수축과 같은 무의식적인 움직임을 조절합니다.평활근은 근섬유나 육종이 없기 때문에 줄무늬가 없다.평활근 세포는 하나의 핵을 가지고 있다.
구조.
근육세포의 특이한 현미경 해부학이 독자적인 용어를 만들어냈다.근육세포의 세포질은 석소체라고 불리며, 근육세포의 매끄러운 소포체는 석소체라고 불리며, 근육세포의 세포막은 석소체라고 불린다.[8]육갑상샘은 자극을 받고 전도한다.
골격근세포
골격근 세포는 근육 안에 있는 개별 수축 세포이며, 긴 실 같은 [9]모양 때문에 보통 근육 섬유로 더 알려져 있습니다.젊은 성인 남성의 이두근과 같은 단일 근육에는 약 253,000개의 근육 [10]섬유가 포함되어 있습니다.골격근 섬유는 보통 근핵이라고 불리는 핵과 함께 다핵화된 유일한 근육 세포이다.이것은 근아세포의 융합으로 근생성 중에 발생하며 각각은 새로 형성된 근육 세포나 [11]근튜브에 핵을 기여한다.핵융합은 근막과 [12]근막이라고 불리는 융합물질로 알려진 근육특이 단백질에 의존한다.
근필라멘트의 긴 단백질 사슬로 이루어진 근섬유를 함유하는 스트라이프 근섬유.근필라멘트에는 세 가지 종류가 있습니다: 얇고, 두껍고, 그리고 탄력적인 근필라멘트는 근육수축을 만들기 위해 [13]함께 작용합니다.얇은 근필라멘트는 대부분 액틴의 필라멘트이고 두꺼운 필라멘트는 대부분 미오신이며 근육 수축 시 섬유 길이를 줄이기 위해 서로 미끄러집니다.세 번째 유형의 근필라멘트는 매우 큰 단백질인 티틴으로 구성된 탄성 필라멘트이다.
근육 띠의 줄무늬에서 미오신은 A 띠를 구성하는 어두운 필라멘트를 형성합니다.액틴의 얇은 필라멘트는 I 밴드를 구성하는 가벼운 필라멘트입니다.섬유에서 가장 작은 수축 단위는 두 개의 Z 밴드 내에서 반복되는 단위인 sarcomere라고 불립니다.이 석회질에는 또한 강화된 운동 동안 세포에 에너지를 공급하는 글리코겐과 근육 [13]활동을 위해 필요할 때까지 산소를 저장하는 붉은 색소인 미오글로빈도 포함되어 있습니다.
매끄러운 소포체의 특수한 유형인 석소체는 근섬유의 각 근섬유 주위에 네트워크를 형성합니다.이 네트워크는 Terminal cisternae라고 불리는 두 개의 확장된 말단낭과 세포를 통해 구멍을 뚫고 다른 쪽에 나타나는 단일 T-튜브(횡관)의 그룹으로 구성되어 있습니다; 이 세 가지 구성 요소는 함께 각 T-튜브가 2개의 말단을 가진 sarcplic 망막 네트워크 내에 존재하는 삼합체를 형성합니다.그 양쪽에.석소체 망막은 칼슘 이온의 저장고 역할을 하므로 활동 전위가 T관 위로 퍼지면 석소체 망막에 신호를 보내 칼슘 이온을 게이트막 채널에서 방출시켜 근육 수축을 [13][14]자극한다.
골격근에서 각 근섬유의 끝에서 근막의 외층은 근연접점의 [15][16]힘줄 섬유와 결합한다.근섬유에 압착된 근섬유 안에는 여러 개의 평탄한 핵이 있습니다; 발생학적으로, 이 다핵 상태는 각 근섬유를 만들기 위해 융합하는 여러 근아세포에서 비롯되며, 여기서 각 근아세포는 하나의 [13]핵에 기여합니다.
심근 세포
심장근육세포의 세포막은 삽입된 디스크와 횡관을 포함할 수 있는 몇 가지 특수 영역을 가지고 있다.세포막은 약 50nm 너비의 라미나 코트로 덮여 있습니다.라미나 코트는 라미나 덴사와 라미나 루시다의 두 층으로 분리할 수 있습니다.이 두 층 사이에는 [17]칼슘을 포함한 여러 종류의 이온이 있을 수 있습니다.
골격근과 같은 심근에도 줄무늬가 있으며, 골격근 세포로서 근섬유, 근필라멘트, 육갑상선 등이 세포에 포함되어 있습니다.세포막은 약 10 nm 너비의 앵커 섬유에 의해 세포의 세포골격에 고정된다.이들은 일반적으로 Z 라인에 위치하여 홈을 형성하고 횡방향 튜브를 방출합니다.심장근세포에서 이것은 파상표면을 [17]형성한다.
세포골격은 세포의 나머지 부분들이 만들어 내는 것이고 두 가지 주요한 목적을 가지고 있습니다; 첫 번째는 세포 내 구성 요소의 지형을 안정시키는 것이고 두 번째는 세포의 크기와 모양을 조절하는 것을 돕는 것입니다.첫 번째 기능은 생화학적 과정에 중요한 반면, 후자는 세포의 표면 대 체적 비율을 정의하는 데 중요하다.이는 흥분성 셀의 잠재적인 전기적 특성에 큰 영향을 미칩니다.또한 세포의 표준 모양 및 크기에서 편차는 예측에 부정적인 [17]영향을 미칠 수 있습니다.
평활근세포
평활근 세포는 근섬유도 육질도 없기 때문에 줄무늬가 없기 때문에 일컬어진다.그것들은 위, 장, 방광, 자궁을 포함한 중공 기관들의 벽, 혈관 벽, 그리고 호흡, 비뇨기, 생식 기관들의 기관들에서 발견됩니다.눈에서, 섬모근은 홍채를 확장하거나 수축하고 수정체의 모양을 변화시킨다.피부에서, 후두엽과 같은 평활근 세포는 추운 온도나 [18]두려움에 반응하여 머리카락을 곧게 세우게 한다.
평활근 세포는 가운데가 넓고 끝이 가늘어지는 방추형이다.그들은 하나의 핵을 가지고 있고 길이가 30에서 200 마이크로미터 사이이다.이것은 골격근 섬유보다 수천 배나 짧습니다.그들의 세포의 지름은 또한 훨씬 작아서 줄무늬 근육 세포에서 발견되는 T-튜브의 필요성을 없앱니다.평활근 세포는 육종과 근섬유가 부족하지만 액틴과 미오신을 많이 포함하고 있다.액틴 필라멘트는 육갑상선([18]Sarcomer)의 Z 디스크와 유사한 밀도 높은 몸체에 의해 고정됩니다.
개발
근아세포는 다른 종류의 [19]근육세포를 생성하기 위해 분화하는 배아 전구세포이다.분화는 MyoD, Myf5, myogenin 및 [20]MRF4를 포함한 근원 조절 인자에 의해 조절되며, GATA4와 GATA6도 근세포 [21]분화에 역할을 한다.
골격근 섬유는 근아세포가 함께 결합할 때 만들어진다; 그러므로 근 섬유는 근핵으로 알려진 여러 개의 핵을 가진 세포이며, 각 세포핵은 단일 근아세포에서 유래한다.근아세포의 융합은 심근이나 평활근이 아닌 골격근에 특유하다.
근섬유를 형성하지 않는 골격근의 근아세포는 다시 근위성 세포로 분화된다.이러한 위성 세포는 사골격근 섬유와 내막의[22] 기저막 사이에 위치한 골격근 섬유에 인접해 있습니다.근생성을 다시 활성화하기 위해서는 위성세포가 새로운 섬유로 분화하도록 자극되어야 한다.
위성 세포를 포함한 근아세포와 그 유도체는 이제 만능 줄기세포의 직접 [23]분화를 통해 체외에서 생성될 수 있다.
킨들린-2는 근생성 [24]동안 발달 연장에 역할을 한다.
기능.
줄무늬 근육의 근육 수축
골격근 수축
수축할 때 얇고 두꺼운 필라멘트는 아데노신 삼인산을 사용하여 서로 미끄러진다.이것은 슬라이딩 필라멘트 메커니즘이라고 불리는 과정에서 Z 디스크를 더 가까이 당깁니다.전체 근섬유의 수축은 전체 근섬유의 수축으로 이어진다.근구의 이러한 수축은 근구의 세포막 위의 활동 전위에 의해 유발된다.활동 전위는 세포막 내에서 연속적인 근구 표면에서 내부로 가기 위해 횡관관을 사용합니다.석회질 망막은 횡관과는 접촉하지만 분리된 상태로 유지되는 막 형태의 주머니이다.이것들은 각 육체를 감싸고 [25]Ca로2+ 채워져 있다.
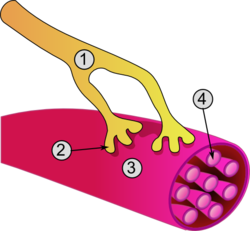
근구의 들뜸은 활동전위를 유발하는 신경근접합인 시냅스에서 탈분극을 일으킨다.단일 신경근접합으로, 각 근육 섬유는 오직 하나의 체세포 효율 뉴런으로부터 입력을 받습니다.체세포 효율 뉴런의 활동 전위는 신경전달물질인 [26]아세틸콜린의 방출을 일으킨다.
아세틸콜린이 방출되면 시냅스를 통해 확산되어 세포막을 참조하는 근육 세포에 고유한 용어인 사골막의 수용체에 결합합니다.이것은 사골막을 [27]가로질러 이동하는 충동을 일으킨다.
활동 전위가 석소체에 도달하면 Ca 채널에서2+ Ca의 방출을2+ 유발합니다.Ca는2+ 양쪽 필라멘트와 함께 석소체에서 육안으로 흐른다.이로 인해 필라멘트가 미끄러지기 시작하고 서커머가 짧아집니다.이것은 모든 미오신 헤드의 부착과 방출에 모두 사용되기 때문에 많은 양의 ATP를 필요로 합니다.매우2+ 빠르게 Ca는 얇은 필라멘트와 두꺼운 필라멘트 사이의 상호작용을 차단하는 석소체로 다시 활발하게 운반된다.이것은 차례로 근육 세포를 [27]이완시킨다.
근육 수축에는 크게 경련, 트레프, 파상풍 그리고 등각성/등각성 근육 수축의 네 가지 유형이 있습니다.경련 수축은 단일 자극이 단일 수축 신호를 보내는 과정이다.경련 수축에서는 근육 세포의 크기에 따라 수축 길이가 달라질 수 있습니다.트레프(또는 총상) 동안 수축근은 최대 효율로 시작되지 않습니다; 대신 반복된 자극으로 수축 강도를 높입니다.파상풍은 일련의 빠른 자극에 의해 근육이 지속적으로 수축하는 것을 수반하며, 이는 근육이 피로해질 때까지 지속될 수 있다.등각수축은 근육의 움직임을 일으키지 않는 골격근 수축이다.그러나 등축성 수축은 움직임을 [27]일으키는 골격근 수축이다.
심근 수축
동심방결절의 특수 심근세포는 심박수를 조절하는 전기 자극을 생성한다.이러한 전기 충격은 심장의 전기 전도 시스템을 통해 남아있는 심장 근육 전체의 수축을 조정합니다.심방결절의 활동은 교감신경계와 부교감신경계의 신경섬유에 의해 차례로 조절된다.이러한 시스템은 각각 동심원 노드에 의한 전기 임펄스 생성 속도를 증가 및 감소시키는 역할을 합니다.
진화
동물의 근육세포의 진화적 기원은 매우 논란이 되고 있다.한 가지 관점은 근육 세포가 한 번 진화했기 때문에 모든 근육 세포는 하나의 공통 조상을 가지고 있다는 것이다.또 다른 견해는 근육세포가 한 번 이상 진화했고 형태학적 또는 구조적 유사성은 근육의 진화와 심지어 척추동물의 근육세포를 발생시키는 배아층인 중배엽의 진화 이전에 수렴된 진화와 유전자에 기인한다는 것이다.
Schmid와 Seipel은 근육 세포의 기원은 모든 동물의 소화기와 신경계의 발달과 동시에 일어난 단통성 특성이며 이러한 기원은 근육 세포가 존재하는 단일 변형 동물 조상으로 추적될 수 있다고 주장한다.그들은 cnidaria와 ctenophora의 근육 세포들 사이의 분자학적 그리고 형태학적 유사성은 근육 세포가 유래하는 메타조아에 하나의 조상이 있을 정도로 양전자류의 그것과 충분히 유사하다고 주장한다.이 경우에, Schmid와 Seipel은 빌라테리아, ctenophora, cnidaria의 마지막 공통 조상은 3배아층 또는 3배아층을 가진 유기체였으며, 2배아층을 가진 유기체라는 의미인 이배아는 대부분의 중배엽이나 근육의 부재를 관찰했기 때문에 이차적으로 진화했다고 주장한다.견과류와 견과류의 형태학을 양악류와 비교함으로써, Schmid와 Seipel은 견과류의 일부 종의 촉수와 내장에 근아세포와 같은 구조가 있다는 결론을 내릴 수 있었다.이것은 근육 세포에 고유한 구조이기 때문에, 이 과학자들은 동료들이 수집한 데이터를 바탕으로 이것이 양전자에서 관찰된 것과 유사한 줄무늬 근육의 지표라는 것을 알아냈다.저자들은 또한 Cnidarians와 Ctenophore에서 발견되는 근육 세포는 종종 이러한 근육 세포들의 기원이 중배엽이나 중배엽이 아닌 외배엽이기 때문에 경쟁한다고 말한다.진정한 근육 세포의 기원은 중배엽과 내배엽의 내배엽 부분이라고 다른 사람들에 의해 주장된다.그러나 슈미드와 세이펠은 ctenophore와 cnidarians에서 발견되는 근육세포가 진짜 근육세포인지에 대한 이러한 회의론에 대해 cnidarians가 medusa 단계와 polyp 단계를 거쳐 발달한다는 점을 고려함으로써 반박한다.그들은 하이드로조아 메두사 단계에서 중배엽과 비슷한 방식으로 줄무늬 근육 세포를 형성하기 위해 외배엽의 원위쪽에서 분리된 세포층이 있다는 것을 관찰하고 이 세 번째 분리된 세포층을 외배엽이라고 부른다.그들은 또한 모든 근육 세포가 양배엽의 중배엽에서 파생되는 것은 아니며, 척추동물의 눈 근육과 나선동물의 근육에서 모두 이러한 세포가 내배엽 중배엽이 아닌 외배엽 중배엽에서 파생되는 것이 주요 예라고 주장한다.게다가, Schmid와 Seipel은 근생성이 양악근의 근육 세포 사양에서 발견된 분자 조절 요소의 도움으로 cnidarian에서 발생하기 때문에 줄무늬 근육의 [28]단일 기원에 대한 증거가 있다고 주장한다.
근육 세포의 단일 기원에 대한 이러한 주장과 대조적으로, Steinmetz 외 연구진은 줄무늬 근육의 이 단일 기원을 결정하기 위해 사용된 미오신 II 단백질과 같은 분자 표지가 실제로 근육 세포의 형성보다 앞선다고 주장한다.본 저자는 포리페라 또는 이 단백질을 포함한 이 줄무늬 근육이 진정으로 결여된 스폰지에 존재하는 수축성 요소의 예를 사용한다.또한, Steinmetz 등은 양면체계에 존재하며, 양면체세포에 존재하지 않는 형태학적 및 분자적 표지자 분석을 통해 횡문근세포 발달의 다계통 기원에 대한 증거를 제시한다.Steimetz et al.는 액틴, 미오신 측쇄 인산화와 칼슘 양성 농도의 높은 농도와 결합하는 능력 및 기타 MyHC 요소들과 같은 전통적인 형태학적 및 조절 마커가 근육 세포를 가진 유기체뿐만 아니라 모든 메타존에 존재함을 보여주었다.따라서, 스타인메츠 외 연구진(Steinmetz et al)에 따르면, Cnidarians와 Ctenophore의 근육세포가 단일 계보를 확인할 수 있을 만큼 충분히 유사한지 여부를 판단할 때 이러한 구조적 요소 또는 조절 요소의 사용은 의문이다.게다가, Steinmetz et al.는 줄무늬 근육의 기원을 가정하기 위해 사용된 MyHc 유전자의 직설은 최초의 진정한 근육 세포보다 앞선 유전자 복제 이벤트를 통해 발생했으며, MyHc 유전자가 수축성 요소를 가진 스폰지에 존재함을 보여준다.진짜 근육세포가 없어또한 Steinmetz 등은 줄무늬 근육 유전자 형성을 촉진하는 기능과 세포 조절 및 이동 유전자를 모두 제공하는 이 중복된 유전자 세트의 국부화가 이미 줄무늬 myhc와 비근육 myhc로 분리되었음을 보여주었다.이러한 중복된 유전자 세트의 분리는 발달 세포 형태와 변화 중에 비근육 myhc가 더 확산적으로 발현되는 동안 스폰지 내 수축성 액포에 대한 줄무늬 myhc의 국부화를 통해 나타난다.Steinmetz 외 연구진은 소화 트랙의 평활근에 이 줄무늬 근육 마커를 가진 cnidarian N. vectensis를 제외하고 cnidarian에서 유사한 국소화 패턴을 발견했다.따라서, Steinmetz 등 연구진은 myhc의 분리된 직교체의 다형성 특성은 근육의 모노필 발생을 결정하는 데 사용될 수 없다고 주장하고, 추가적으로 이 cnidarian의 평활근에 줄무늬 근육 표지의 존재가 근육 세포 발달과 구조의 근본적으로 다른 메커니즘을 보여준다고 주장한다.아이디안[29]
스타인메츠 외 연구진은 양면체에서의 근육 조절과 형성을 위한 트로포닌 복합체 형성에 사용되는 핵심 유전자 세트가 Cnidarians와 ctenophore에서 누락되었으며, 관찰된 47개의 구조 및 조절 단백질 중 Steinmetz 외 연구진은 이를 계속해서 주장할 수 없었다.cnidarians와 bilaterians에서 발현된 독특한 줄무늬 근육 세포 단백질에서도 찾을 수 있습니다.또한 Z-디스크는 양면체 내에서도 다르게 진화한 것으로 보이며, 이 분지 사이에서도 단백질의 다양성이 매우 높아 근육세포에 대한 방사선이 대량으로 나타난다.이러한 Z-디스크의 분리를 통해, Steimetz 등은 모든 양전자 근육 조상에 존재했던 4개의 공통 단백질 성분이 있으며, 필요한 Z-디스크 성분에 대해 그들이 이미 플레이시형 상태를 통해 정보적이지 않은 표지자라고 주장해온 액틴 단백질만이 cnidari에 존재한다고 주장한다.추가적인 분자 마커 테스트를 통해, Steinmetz 등은 비-빌라테리안 근육 형성에 필요한 많은 조절 및 구조적 구성요소가 부족하다는 것을 관찰하고, 스폰지와 같은 초기, 원시 동물에 존재하지 않는 양면동물과 크니다리아인 및 크테노포어 모두에 대한 독특한 단백질 세트를 발견하지 못했다.es와 아메보조안.이 분석을 통해 저자들은 양안근육이 구조와 사용에 의존하는 요소의 부족으로 인해 비변형근육은 다른 조절 단백질과 구조 [29]단백질을 가진 다른 기원이어야 한다고 결론지었다.
이 주장에 대한 또 다른 견해로, Andrikou와 Arnone은 유전자 조절 네트워크에 대한 새롭게 이용 가능한 데이터를 사용하여 유전자, 형태소 및 조직 특정의 다른 메커니즘의 계층 구조가 어떻게 분화되고 초기 중수소체와 원형질 사이에서 유사한지를 조사합니다.Andrikou와 Arnone은 모든 양전자학자에게 존재하는 유전자뿐만 아니라 이들 유전자의 배치 시간과 장소를 이해함으로써 근생성의 [30]진화에 대한 더 깊은 이해를 논의한다.
그들의 논문에서 Andrikou와 Arnone은 근육 세포의 진화를 진정으로 이해하기 위해서는 다른 외부 및 내부 상호작용의 맥락에서 전사 조절자의 기능을 이해해야 한다고 주장한다.그들의 분석을 통해, Andrikou와 Arnone은 무척추동물 양악동물과 견과류 모두에서 유전자 조절 네트워크의 보존된 직교들이 있다는 것을 알아냈다.이들은 이 공통의 일반적인 규제회로를 통해 기능하는 단일 네트워크로부터의 높은 수준의 분기가 가능했다고 주장한다.Andrikou와 Arnone은 척추동물에서 발견되는 유전자의 직립이 무척추동물 중수소체와 원생생물에서 서로 다른 형태의 구조적 돌연변이를 통해 바뀌었다는 것을 발견했고, 그들은 유전자의 이러한 구조적 변화가 이들 종에서 근육 기능과 근육 형성의 큰 차이를 허용한다고 주장한다.Andrikou와 Arnone은 척추동물과 무척추동물에서 발견되는 유전자의 돌연변이에 의한 어떠한 차이도 인지할 수 있었을 뿐만 아니라 원래의 유전자 조절 네트워크 기능에서 차이를 일으킬 수 있는 종 고유의 유전자의 통합도 인지할 수 있었다.따라서, 비록 일반적인 근육 패턴 시스템이 결정되었지만, 그들은 이것이 추가적인 유전자와 매우 다른 근육의 발달을 야기하는 돌연변이와 함께 여러 차례에 걸쳐 더 많은 조상들의 유전자 조절 네트워크가 결합되었기 때문일 수 있다고 주장한다.따라서 근원적 패턴 형성 틀은 조상들의 특성일 수 있다.그러나 Andrikou와 Arnone은 기본적인 근육 패턴화 구조도 개발 중 서로 다른 시기에 존재하는 cis 조절 요소와 함께 고려해야 한다고 설명한다.높은 수준의 유전자 패밀리 장치 구조와 대조적으로, Andrikou와 Arnone은 cis 조절 요소가 네트워크 내에서 시간과 장소 모두에서 잘 보존되지 않아 근육 세포의 형성에 큰 차이를 보일 수 있다는 것을 발견했다.이 분석을 통해 근원적 GRN은 근원적 기능 및 구조의 실제 변화를 다른 시기 및 장소에서 [30]유전자의 추후 결합과 연관지을 가능성이 있는 선조 GRN으로 보인다.
진화적으로, 골격 및 심장 근육의 특수한 형태는 척추동물/절지동물 진화 라인의 발산보다 [31]앞서 있었다.이것은 이러한 종류의 근육이 7억 년 전쯤 공통의 조상으로부터 발달했다는 것을 나타냅니다.척추동물 평활근은 골격근과 심장근과는 독립적으로 진화한 것으로 밝혀졌다.
무척추동물근육세포형
빠른 근육 섬유, 중간 근육 섬유, 느린 근육 섬유를 구별하는 데 사용되는 특성은 무척추동물 비행과 점프 [32]근육에 따라 다를 수 있습니다.이 분류 체계를 더욱 복잡하게 하기 위해, 근육 섬유 내의 미토콘드리아 함량과 다른 형태학적 특성은 운동과 [33]나이에 따라 체체 플라이에서 변화할 수 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Saladin, Kenneth S. (2011). Human anatomy (3rd ed.). New York: McGraw-Hill. pp. 72–73. ISBN 9780071222075.
- ^ 미국 국립 의학 도서관(MeSH)의 근구 제목
- ^ Scott, W; Stevens, J; Binder-Macleod, SA (2001). "Human skeletal muscle fiber type classifications". Physical Therapy. 81 (11): 1810–1816. doi:10.1093/ptj/81.11.1810. PMID 11694174. Archived from the original on 13 February 2015.
- ^ "Does anyone know why skeletal muscle fibers have peripheral nuclei, but the cardiomyocytes not? What are the functional advantages?". Archived from the original on 19 September 2017.
- ^ Betts, J. Gordon; Young, Kelly A.; Wise, James A.; Johnson, Eddie; Poe, Brandon; Kruse, Dean H.; Korol, Oksana; Johnson, Jody E.; Womble, Mark; Desaix, Peter (6 March 2013). "Cardiac muscle tissue". Retrieved 3 May 2021.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ "Muscle tissues". Archived from the original on 13 October 2015. Retrieved 29 September 2015.
- ^ "Atrial structure, fibres and conduction" (PDF). Retrieved 5 June 2021.
- ^ Saladin, Kenneth S. (2011). Human anatomy (3rd ed.). New York: McGraw-Hill. pp. 244–246. ISBN 9780071222075.
- ^ "Structure of Skeletal Muscle SEER Training". training.seer.cancer.gov.
- ^ Klein, CS; Marsh, GD; Petrella, RJ; Rice, CL (July 2003). "Muscle fiber number in the biceps brachii muscle of young and old men". Muscle & Nerve. 28 (1): 62–8. doi:10.1002/mus.10386. PMID 12811774. S2CID 20508198.
- ^ Cho, CH; Lee, KJ; Lee, EH (August 2018). "With the greatest care, stromal interaction molecule (STIM) proteins verify what skeletal muscle is doing". BMB Reports. 51 (8): 378–387. doi:10.5483/bmbrep.2018.51.8.128. PMC 6130827. PMID 29898810.
- ^ Prasad, V; Millay, DP (8 May 2021). "Skeletal muscle fibers count on nuclear numbers for growth". Seminars in Cell & Developmental Biology. 119: 3–10. doi:10.1016/j.semcdb.2021.04.015. PMC 9070318. PMID 33972174. S2CID 234362466.
- ^ a b c d Saladin, K (2012). Anatomy & Physiology: The Unity of Form and Function (6th ed.). New York: McGraw-Hill. pp. 403–405. ISBN 978-0-07-337825-1.
- ^ Sugi, Haruo; Abe, T; Kobayashi, T; Chaen, S; Ohnuki, Y; Saeki, Y; Sugiura, S; Guerrero-Hernandez, Agustin (2013). "Enhancement of force generated by individual myosin heads in skinned rabbit psoas muscle fibers at low ionic strength". PLOS ONE. 8 (5): e63658. Bibcode:2013PLoSO...863658S. doi:10.1371/journal.pone.0063658. PMC 3655179. PMID 23691080.
- ^ Charvet, B; Ruggiero, F; Le Guellec, D (April 2012). "The development of the myotendinous junction. A review". Muscles, Ligaments and Tendons Journal. 2 (2): 53–63. PMC 3666507. PMID 23738275.
- ^ Bentzinger, CF; Wang, YX; Rudnicki, MA (1 February 2012). "Building muscle: molecular regulation of myogenesis". Cold Spring Harbor Perspectives in Biology. 4 (2): a008342. doi:10.1101/cshperspect.a008342. PMC 3281568. PMID 22300977.
- ^ a b c Ferrari, Roberto. "Healthy versus sick myocytes: metabolism, structure and function" (PDF). oxfordjournals.org/en. Oxford University Press. Archived from the original (PDF) on 19 February 2015. Retrieved 12 February 2015.
- ^ a b Betts, J. Gordon; Young, Kelly A.; Wise, James A.; Johnson, Eddie; Poe, Brandon; Kruse, Dean H.; Korol, Oksana; Johnson, Jody E.; Womble, Mark; Desaix, Peter (6 March 2013). "Smooth muscle". Retrieved 10 June 2021.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ 395쪽, 생물학, 제5판, 캠벨, 1999년
- ^ Perry R, Rudnick M (2000). "Molecular mechanisms regulating myogenic determination and differentiation". Front Biosci. 5: D750–67. doi:10.2741/Perry. PMID 10966875.
- ^ Zhao R, Watt AJ, Battle MA, Li J, Bondow BJ, Duncan SA (May 2008). "Loss of both GATA4 and GATA6 blocks cardiac myocyte differentiation and results in acardia in mice". Dev. Biol. 317 (2): 614–9. doi:10.1016/j.ydbio.2008.03.013. PMC 2423416. PMID 18400219.
- ^ Zammit, PS; Partridge, TA; Yablonka-Reuveni, Z (November 2006). "The skeletal muscle satellite cell: the stem cell that came in from the cold". Journal of Histochemistry and Cytochemistry. 54 (11): 1177–91. doi:10.1369/jhc.6r6995.2006. PMID 16899758.
- ^ Chal J, Oginuma M, Al Tanoury Z, Gobert B, Sumara O, Hick A, Bousson F, Zidouni Y, Mursch C, Moncuquet P, Tassy O, Vincent S, Miyanari A, Bera A, Garnier JM, Guevara G, Hestin M, Kennedy L, Hayashi S, Drayton B, Cherrier T, Gayraud-Morel B, Gussoni E, Relaix F, Tajbakhsh S, Pourquié O (August 2015). "Differentiation of pluripotent stem cells to muscle fiber to model Duchenne muscular dystrophy". Nature Biotechnology. 33 (9): 962–9. doi:10.1038/nbt.3297. PMID 26237517. S2CID 21241434.

- ^ Dowling JJ, Vreede AP, Kim S, Golden J, Feldman EL (2008). "Kindlin-2 is required for myocyte elongation and is essential for myogenesis". BMC Cell Biol. 9: 36. doi:10.1186/1471-2121-9-36. PMC 2478659. PMID 18611274.
- ^ "Structure and Function of Skeletal Muscles". courses.washington.edu. Archived from the original on 15 February 2015. Retrieved 13 February 2015.
- ^ "Muscle Fiber Excitation". courses.washington.edu. University of Washington. Archived from the original on 27 February 2015. Retrieved 11 February 2015.
- ^ a b c Ziser, Stephen. "Muscle Cell Anatomy & Function" (PDF). www.austincc.edu. Archived (PDF) from the original on 23 September 2015. Retrieved 12 February 2015.
- ^ Seipel, Katja; Schmid, Volker (1 June 2005). "Evolution of striated muscle: Jellyfish and the origin of triploblasty". Developmental Biology. 282 (1): 14–26. doi:10.1016/j.ydbio.2005.03.032. PMID 15936326.
- ^ a b Steinmetz, Patrick R.H.; Kraus, Johanna E.M.; Larroux, Claire; Hammel, Jörg U.; Amon-Hassenzahl, Annette; Houliston, Evelyn; Wörheide, Gert; Nickel, Michael; Degnan, Bernard M. (2012). "Independent evolution of striated muscles in cnidarians and bilaterians". Nature. 487 (7406): 231–234. Bibcode:2012Natur.487..231S. doi:10.1038/nature11180. PMC 3398149. PMID 22763458.
- ^ a b Andrikou, Carmen; Arnone, Maria Ina (1 May 2015). "Too many ways to make a muscle: Evolution of GRNs governing myogenesis". Zoologischer Anzeiger. Special Issue: Proceedings of the 3rd International Congress on Invertebrate Morphology. 256: 2–13. doi:10.1016/j.jcz.2015.03.005.
- ^ OOta, S.; Saitou, N. (1999). "Phylogenetic relationship of muscle tissues deduced from superimposition of gene trees". Molecular Biology and Evolution. 16 (6): 856–867. doi:10.1093/oxfordjournals.molbev.a026170. ISSN 0737-4038. PMID 10368962.
- ^ Hoyle, Graham (1983). "8. Muscle Cell Diversity". Muscles and Their Neural Control. New York: John Wiley & Sons. pp. 293–299. ISBN 9780471877097.
- ^ Anderson, M; Finlayson, L. H. (1976). "The effect of exercise on the growth of mitochondria and myofibrils in the flight muscles of the Tsetse fly, Glossina morsitans". J. Morphol. 150 (2): 321–326. doi:10.1002/jmor.1051500205. S2CID 85719905.