존스 산화
Jones oxidation| 존스 산화 | |
|---|---|
| 이름을 따서 명명됨 | 유와트 존스 |
| 반응형 | 유기 리독스 반응 |
| 식별자 | |
| 유기화학포털 | 존스프링 |
| RSC 온톨로지 ID | RXNO:0000356 |
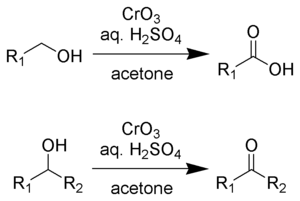
존스 산화는 1차 알코올과 2차 알코올이 각각 카르복실산과 케톤에 산화되는 유기적 반응이다. 그것은 발견자인 Ewart Jones경의 이름을 따서 명명되었다. 그 반응은 알코올의 산화를 위한 초기 방법이었다. 콜린스 시약과 같은 보다 순하고 선택적인 시약이 개발되었기 때문에 그것의 용도가 줄어들었다.[1]
존스 시약은 삼산화 크롬을 수성 황산에 녹여 제조한 용액이다. 존스의 산화 작용을 위해, 이 산성 혼합물은 기질의 아세톤 용액에 첨가된다. 대신 삼산화 크롬 대신에 중크롬산칼륨을 사용할 수 있다. 산화는 매우 빠르고 상당히 발열적이다. 일반적으로 수익률은 높다. 시약이 편리하고 싸다. 그러나 Cr(VI) 화합물은 발암성이므로 이 방법론의 사용을 방해한다.
스토이치측정학 및 메커니즘
존스 시약은 1차 알코올과 2차 알코올을 각각 알데히드와 케톤으로 변환시킬 것이다. 반응 조건에 따라 알데히드는 카르복실산으로 변환될 수 있다. 알데히드 및 케톤에 대한 산화의 경우 크롬산의 등가물 2개가 알코올의 등가물 3개를 산화시킨다.
- 2 HCrO4− + 3 RR'C(OH)H + 8 H+ + 4 HO2 → 2 [Cr(HO2)]63+ + 3 RR'CO, C.O.
일차 알코올을 카르복실산에 산화하는 경우, 크롬산 4개 등가물이 알코올의 3개 등가물을 산화시킨다. 알데히드는 중간 물질이다.
- 4 HCRO4− + 3 RCHO2 + 16 H + 11 HO+2 → 4 [Cr2(HO)]63+ + 3 RCOOH
무기물은 녹색으로 크롬(III) 아쿠오 복합체가 특징이다.[2]
금속 산화물에 의한 알코올의 다른 산화와 마찬가지로, 혼합된 색산 에스테르의 형성을 통해 반응이 진행된다.[3][4] 이 에스테르에는 CrO3(OCHR2)−라는 공식이 있다.
- CrO3(OH)− + RCH2OH → CrO3(OCH2R)− + H2O
종래의 에스테르처럼, 이 염색체 에스테르의 형성은 산에 의해 가속된다. 이 에스테르들은 3차 알코올일 때 격리될 수 있다. 왜냐하면 이것들은 카보닐을 형성하기 위해 손실될 수 있는 α 수소가 없기 때문이다. 예를 들어 테르트부틸알코올을 사용하면 테르트부틸크롬산염(CH3)3CO(2CrO2)을 분리할 수 있는데, 그 자체가 좋은 산화제다.[5]
산소에 수소 알파가 있는 구조물의 경우, 색산 에스테르가 분해되어 카보닐 제품과 잘못 정의된 Cr(IV) 제품이 방출된다.
- CRO3(OCHR2)− → "CROOh"2− + O=CHR
중수 알코올인 HOCDR은2 무중수 유도체보다 약 6배 느리게 산화한다. 이 큰 운동 동위원소 효과는 C-H(또는 C-D) 결합이 요율 결정 단계에서 깨진다는 것을 보여준다.
반작용 스토이히메트리는 Cr(IV)종인 "CrOOh"2−를 포함하고 있는데, 이 종은 크롬산과 결합하여 Cr(V)산화물을 주는데, 이것은 알코올의 산화제 역할도 한다.[6]
알데히드의 산화는 C=O 본드 전체에서 OCRO-H3− 결합이 추가되면서 발생하는 헤미아세트 유사 매개체 형성을 통해 진행되도록 제안한다.
그 시약은 좀처럼 불포화 결합을 산화시키지 않는다.
적용 사례 및 애플리케이션
유기합성에 여전히 유용하다.[2][7] 적외선 분광법을 포함한 다양한 분광 기술을 사용하여 존스 산화 반응의 진행 상황을 감시할 수 있다. 한때 존스 산화는 음주 측정기에 사용되었다.
관련 프로세스
주요 시약은 콜린스 시약, PDC, PCC이다. 이 시약은 존스 시약과 같은 무기체크롬(VI) 시약보다 개선된 것을 나타낸다.
과거 참조
- Bowden, K.; Heilbron, I. M.; Jones, E. R. H (1946). "13. Researches on acetylenic compounds. Part I. The preparation of acetylenic ketones by oxidation of acetylenic carbinols and glycols". J. Chem. Soc.: 39. doi:10.1039/jr9460000039.
- Heilbron, I.M.; Jones, E.R.H.; Sondheimer, F (1949). "129. Researches on acetylenic compounds. Part XV. The oxidation of primary acetylenic carbinols and glycols". J. Chem. Soc.: 604. doi:10.1039/jr9490000604.
- Bladon, P; Fabian, Joyce M.; Henbest, H. B.; Koch, H. P.; Wood, Geoffrey W. (1951). "532. Studies in the sterol group. Part LII. Infra-red absorption of nuclear tri- and tetra-substituted ethylenic centres". J. Chem. Soc.: 2402. doi:10.1039/jr9510002402.
- Jones, E. R. H (1953). "92. The chemistry of the triterpenes. Part XIII. The further characterisation of polyporenic acid A". J. Chem. Soc.: 457. doi:10.1039/jr9530000457.
- Jones, E. R. H (1953). "520. The chemistry of the triterpenes and related compounds. Part XVIII. Elucidation of the structure of polyporenic acid C". J. Chem. Soc.: 2548. doi:10.1039/jr9530002548.
- Jones, E. R. H (1953). "599. The chemistry of the triterpenes and related compounds. Part XIX. Further evidence concerning the structure of polyporenic acid A". J. Chem. Soc.: 3019. doi:10.1039/jr9530003019.
- C. Djerassi, R. Engle and A. Bowers (1956). "Notes – The Direct Conversion of Steroidal Δ5-3β-Alcohols to Δ5- and Δ4-3-Ketones". J. Org. Chem. 21 (12): 1547–1549. doi:10.1021/jo01118a627.
참조
- ^ "Chromium-based Reagents". Oxidation of Alcohols to Aldehydes and Ketones. Basic Reactions in Organic Synthesis. 2006. pp. 1–95. doi:10.1007/0-387-25725-X_1. ISBN 0-387-23607-4.
- ^ a b Eisenbraun, E. J. (1965). "Cyclooctanone". Organic Syntheses. 45: 28. doi:10.15227/orgsyn.045.0028.
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Ley, S. V.; Madin, A. (1991). B. M. Trost; I. Fleming (eds.). Comprehensive organic synthesis. 7. Oxford: Pergamon Press. pp. 253–256.
- ^ 필모어 프리먼, "Di-tert-butyl Chromate" 유기합성을 위한 시약 백과사전, 2001, John Wiley & Sons, Ltd. doi:10.1002/047084289X.rd059m
- ^ 유기화학에서의 산화. K. B. 편집. 위버그, 1965년 NY, Academic Press.
- ^ Meinwald, J.; Crandall, J.; Hymans, W. E. (1965). "Nortricyclanone". Organic Syntheses. 45: 77. doi:10.15227/orgsyn.045.0077.