트로포닌 1세
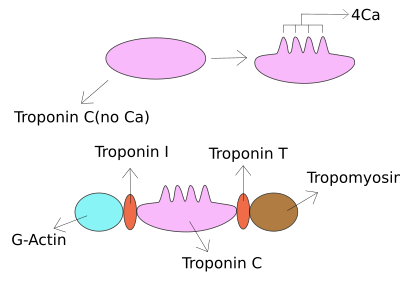
Troponin I트로포닌 1세는 심장과 골격근 단백질 계열이다. 트로포닌 단백질 복합체의 한 부분으로, 액틴-트로포미오신 복합체를 제자리에 고정시키기 위해 얇은 근필름으로 액틴을 결합한다. 트로포닌 1세는 미오신이 이완된 근육에서 작용하는 것을 방지한다. 칼슘이 트로포닌 C에 결합할 때, 그것은 트로포닌 I의 탈구로 이어지는 순응적인 변화를 일으킨다. 이후 트로포미오신은 근육의 수축으로 이어지는 액틴에 미오신 결합 부위를 떠난다. 내가 받은 편지는 억제된 성격 때문에 받은 것이다. 그것은 심장마비의 실험실 진단에서 유용한 표식이다.[1] 이것은 다른 혈장 농도에서 발생하지만 트로포닌 T와 동일한 환경에서 심장 근육 손상의 확인을 위해 테스트를 수행할 수 있으며 실험실은 보통 한 가지 테스트 또는 다른 테스트를 제공한다.[2]
고유한 조직별 표현 패턴을 가진 세 개의 파라로그가 인간에게 표현되며, 그 위치와 OMIM 접근법을 함께 수록한다.
- 느린 트위치 골격근 이소성 트로포닌 I, TNNI1(1q31.3, 191042)
- 빠른 트위치 골격근 이소성형 트로포닌 I, TNNI2 (11p15.5, 191043)
- 심장 트로포닌 I, TNNI3(19q13.4, 191044)
cTnI
종종 cTnI로 표기되는 Cardiac troponin I은 23.9 kDa의 분자 중량으로 하나의 이소 형태로 심장 근육 조직에 제시된다. 209개의 아미노산 잔류물로 구성되어 있다. cTnI의 이론 pI는 9.05.[3]cTnI는 26개의 아미노산 N단자 확장으로 인해 다른 트로포닌과 다르다. 이 확장에는 베타-아드레날린 자극에 반응하여 단백질 키나제 A에 의해 인산염화되며 비등방성 반응을 증가시키는데 중요한 2개의 세린이 포함되어 있다.[4] cTnI의 인산화 작용은 단백질의 순응을 변화시키고 다른 트로포닌과의 상호작용뿐만 아니라 항TnI 항체와의 상호작용을 수정한다. 이러한 변화들은 칼슘에 대한 근필름 반응을 변화시키며, 심부전을 목표로 하는 데 관심이 있다. 인간 cTnI에 대한 다중 반응 모니터링을 통해 14개의 인산화 부위가 있으며 이러한 부위가 질병에 대응하여 관찰된 인산화 패턴이 변화한다는 것을 밝혀냈다.[5]cTnI는 단백질 키나제 A, 단백질 키나제 C, 단백질 키나제 G, p21 활성 키나제 3에 의해 인산화되는 것으로 나타났다.[6] 환자의 혈류로 방출되는 cTnI의 상당 부분은 인산염이다.[7] 15년 이상 cTnI는 심장 근육 조직 손상의 믿을 만한 표시로 알려져 있다. 지난 수십 년간의 "황금 마커"인 CK-MB는 물론, 총 크레아틴 키나아제, 미오글로빈, 젖산탈수소효소 등산화효소보다 심근경색 진단에 훨씬 민감하고 구체적이라고 여겨진다.
트로포닌 1세는 2차적으로 경색된 심근 손상에 대해 완전히 특정된 것은 아니다. 트로포닌 1세가 상승하는 다른 원인으로는 만성 신부전, 심부전, 아타라크노이드 출혈, 폐색전 등이 있다.[8][9]
수의학에서 cTnI 증가는 소의 이온성 독성 이후 심근 손상으로 확인되었다.[10]
참고 항목
외부 링크
- Troponin+I 미국 국립 의학 도서관의 의료 과목 제목(MesH)
참조
- ^ "Troponin". labtestsonline.
- ^ "Troponin". labtestsonline.org/. 2019-01-09. Retrieved 2019-07-16.
- ^ Kozlowski, LP (21 October 2016). "IPC - Isoelectric Point Calculator". Biology Direct. 11 (1): 55. doi:10.1186/s13062-016-0159-9. PMC 5075173. PMID 27769290.
- ^ Solaro RJ, Moir AJ, Perry SV (1976). "Phosphorylation of troponin I and the inotropic effect of adrenaline in the perfused rabbit heart". Nature. 262 (5569): 615–616. Bibcode:1976Natur.262..615S. doi:10.1038/262615a0. PMID 958429. S2CID 4216390.
- ^ Zhang P, Kirk, JA, Ji W, dos Remedios CG, Kass DA, Van Eyk JE, Murphy AM (2012). "Multiple Reaction Monitoring to Identify Site-Specific Troponin I Phosphorylated Residues in the Failing Human Heart". Circulation. 126 (15): 1828–1837. doi:10.1161/circulationaha.112.096388. PMC 3733556. PMID 22972900.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Layland J, Solaro RJ, Shah AM (2005). "Regulation of cardiac contractile function by troponin I phosphorylation". Cardiovascular Research. 66 (1): 12–21. doi:10.1016/j.cardiores.2004.12.022. PMID 15769444.
- ^ Labugger R, Organ L, Collier C, Atar D, Van Eyk JE (2000). "Extensive troponin I and T modification detected in serum from patients with acute myocardial infarction". Circulation. 102 (11): 1221–1226. doi:10.1161/01.cir.102.11.1221. PMID 10982534.
- ^ Mannu GS, 심장 트로포닌의 비경상적 사용 및 중요성. 스콧 메드 J, 2014. 59(3): 172-8페이지.
- ^ Tanindi, Asil; Cemri, Mustafa (2011). "Troponin elevation in conditions other than acute coronary syndromes". Vascular Health and Risk Management. 7: 597–603. doi:10.2147/VHRM.S24509. PMC 3212425. PMID 22102783.
- ^ Smith, Joe S.; Varga, Anita; Schober, Karsten E. (2020). "Comparison of Two Commercially Available Immunoassays for the Measurement of Bovine Cardiac Troponin I in Cattle with Induced Myocardial Injury". Frontiers in Veterinary Science. 7: 531. doi:10.3389/fvets.2020.00531. PMC 7481330. PMID 33062647.