뉴클레오사이드인산화물
Nucleoside phosphoramidite뉴클레오사이드 인광아미드는 천연 또는 합성 뉴클레오시드의 파생물이다. 그것들은 올리고뉴클레오티드, 상대적으로 짧은 핵산 조각과 그들의 아날로그를 합성하는데 사용된다. 뉴클레오사이드 인광산염은 1981년 부카게와 카루더스에 의해 처음 도입되었다.[1] 원치 않는 측면 반응을 피하기 위해 자연 또는 합성 뉴클레오시드에 존재하는 반응성 히드록시 및 외생성 아미노 그룹을 적절히 보호한다. 뉴클레오사이드 아날로그가 적어도 하나 이상의 히드록시 그룹을 포함하는 한, 적절한 보호 전략을 사용하면 그것을 각각의 인광아미드로 변환하고 후자를 합성 핵산으로 통합할 수 있다. 인지질 전략을 사용하여 올리고뉴클레오티드 사슬의 중간에 통합되기 위해서는 뉴클레오시드 아날로그가 두 개의 히드록시 그룹과 다른 뉴클레오필 그룹(아미노 또는 메르카프토)을 보유해야 한다. 예를 들어 대체 뉴클레오티드, LNA, morpholino, nucleosides은 2'-position(OMe, NH2, F보호)에서 수정 nucleosides(히포크산틴과 크산틴 자연 nucleosides에 담긴 xanthosine 각각 G-clamp,[2]등 3환식의 기지 이노신)이나 기지 derivatiz 비복 음서의 기지 포함하는 등이 포함된다.교육 형광 그룹이나 링커 팔로.
준비
뉴클레오사이드 인광산염의 조제에는 크게 세 가지 방법이 있다.
- 일반적인 방법은 약한 산의 촉매 작용 하에서 인광다이아미드사이트를 포함한 단일 자유 히드록시 그룹을 포함하는 보호된 뉴클레오사이드의 처리를 포함한다.[3][4] 일부 비사미디트는 열적으로 불안정한 [5]화합물인 2-시아노에틸 N,N,N',N'-테트라이소프로필인스포로다이아미디트로 보고되었지만 상용 뉴클레오사이드 인산염 조성에 사용되는 아미다이트는 비교적 안정적이다. 2단계, 1배트 시술을 사용하여 합성할 수 있으며 진공 박리법으로 정제할 수 있다.[6] 우수한 리뷰는 핵산염과 비핵산 인광산염에 대비하여 후자의 시약 사용을 매우 상세하게 개략적으로 설명한다.[7]
- 두 번째 방법에서, 보호되는 핵산염은 유기 염기, 가장 흔히 N-에틸-N, N-디이소프로필아민(Hunig의 염기)이 있는 곳에서 인광염소산염으로 처리된다.[8]
- 세 번째 방법에서 보호 뉴클레오시드는 먼저 유기 염기 앞에서 클로로 N,N,N',N'-테트라이소프로필 인포로다이아미드라이트로 처리되며, 가장 흔히 N-에틸-N,N-디이소프로필라민(Hunig의 염기)을 사용하여 보호 뉴클레오시드 직경이 형성된다.[9] 후자는 예를 들어 2-시아노에탄올과 같은 원하는 인산염 보호 그룹에 해당하는 알코올로 치료된다.
뉴클레오사이드 인산염은 실리카겔에 있는 컬럼 크로마토그래피에 의해 정화된다. 인광산염 계통의 안정성을 보장하려면 3 ~ 5%의 트리에틸아민이 함유된 용출액으로 기둥을 평준화하고 분리 과정 내내 용출액에서 이 농도를 유지하는 것이 바람직하다. 인광산염의 순도는 P NMR 분광법으로 평가할 수 있다. 뉴클레오사이드 인광암idate의 P(III) 원자가 치랄이기 때문에 화합물의 두 이염화물질에 해당하는 약 149ppm으로 두 개의 피크를 표시한다. 잠재적으로 존재하는 인산염 시험기 불순물은 피크 138–140ppm을 나타낸다. H-인스포네이트 불순물 표시는 8ppm과 10ppm으로 최고조에 이른다.
인광암idite moiety의 화학적 특성
뉴클레오사이드 인광아미드는 4℃ 이하의 온도에서 공기가 없는 무수 조건에서 분말로 보관할 경우 저장 수명이 긴 비교적 안정적인 화합물이다. 미더파이는 온화한 기본 조건을 견뎌낸다. 이와는 대조적으로, 심지어 경산도 있는 곳에서, 인광산염은 거의 즉각적으로 죽는다. 인광산염은 중립 조건에서 가수 분해에 상대적으로 안정적이다. 예를 들어 25℃에서 수성 아세토니트릴의 95%에서 2-시아노에틸 5'-O-(4,4'-디메트호시트리틸)시미딘-3'-O-(N, Diisopropylamino)인산염의 반감기는 200h이다.[10]
- 인광산염의 가장 중요한 특징은 산성 아졸 촉매, 1H-테트라졸, 2-에틸-티오토트라졸,[11] 2-벤질-티오토트라졸,[12][13][14] 4,5-디시카노니미다졸 또는 다수의 유사한 화합물들이 있는 곳에서 핵성 그룹과 반응하는 인광아미드 결합 반응을 겪는 능력이다. 반응은 극도로 빠르게 진행된다. 바로 이 특징은 뉴클레오사이드 인광아미드를 올리고뉴클레오타이드 합성에 유용한 매개체로 만든다. 스테레오화학적으로, 인산염 결합은 P(III) 치랄 중심에서 인식화(이염제 형성)로 이어진다.
물이 핵분열체로 제공될 때 제품은 위의 체계와 같이 H-인스포네이트 다이제터다. 용제와 시약에 잔류수가 존재하기 때문에 후자 화합물의 형성은 특히 올리고뉴클레오티드 합성에 있어서 인광산염의 준비적 사용에 있어서 가장 흔한 합병증이다.
마찬가지로 인광산염은 다른 찰코균과 반응한다. 황의[15][16] 용액이나 집단적으로 황화제라고 불리는 여러 화합물에 접촉했을 때, 인광산염은 정량적으로 인광로티오아미다이트를 형성한다.[17][18] 셀레늄[15][16] 또는 셀레늄 유도체와의[19] 반응은 인광로셀레노아미다이트를 생성한다. 이러한 유형의 모든 반응에서 인 원자의 구성은 유지된다.
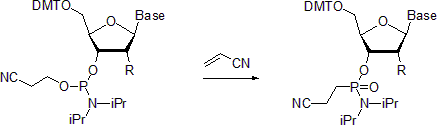
- 뉴클레오사이드 인광산염은 미카엘리스-아르부조프 반응을 거쳐 각각의 인광산염을 형성한다. 한 예는 아크릴로니트릴이 존재하는 곳에서 인광산염의 조제를 설명한다.[20] 실온에서 인 중심부에 구성을 유지하면 입체적인 반응이 나타난다고 한다. 이와는 대조적으로 55 °C에서 수행될 때, 그 반응은 경주용 제품으로 이어진다.
- 인산염과 3차 인산염과 마찬가지로 인산염도 스토딩거 반응을 쉽게 겪는다.
(RO)2P-N(R1)2 + R-N23 + HO2 ---(RO)2P(=O)-N(R1)2 + R-NH22 + N2;
보호전략
자연적으로 발생하는 뉴클레오티드(뉴클레오사이드-3'- 또는 5'인산염)와 그 인산염 아날로그는 높은 수율에서 올리고뉴클레오티드의 신속한 합성 조제를 제공하기에 불충분하게 반응한다. 인산염 트라이터 방법론에서 구성 블록 역할을 하는 뉴클레오시드(핵산인산염)의 3'-O-(N, N-Diisopropyl phosphoramidite) 유도체를 사용하여 핵융합 연결의 선택성과 형성 속도를 획기적으로 개선한다. 원치 않는 측면 반응을 방지하기 위해 핵물질에 존재하는 다른 모든 기능 그룹은 보호 그룹을 부착하여 비활동적(보호적)으로 렌더링해야 한다. 올리고뉴클레오티드 체인 조립이 완료되면 모든 보호 집단을 제거하여 원하는 올리고뉴클레오티드를 산출한다. 아래에서는 현재 상용화되고[21][22][23][24][25] 있는 대부분의 공통 핵물질 인광아미드 건물 블록에서 사용되고 있는 보호 그룹을 간략히 검토한다.
- 5'-히드록실 그룹은 산-레이블 DMT (4,4'-디메트호시트리틀) 그룹에 의해 보호된다.
- 티미딘과 우리딘의 핵 기반인 티민 및 우라실에는 각각 엑소사이클릭 아미노 그룹이 없으므로 보호가 필요하지 않다. 이와는 대조적으로 핵 염기 아데닌, 시토신, 구아닌은 결합 반응 조건 하에서 활성화된 인산염으로 반응하는 엑소사이클릭 아미노 그룹을 포함하고 있다. 합성 주기의 추가 단계를 희생하여, 올리고뉴클레오티드 체인 어셈블리는 보호되지 않은 아미노 그룹을 가진 인광산염(phosphoramidite)을 사용하여 수행될 수 있지만,[26] 대부분은 올리고뉴클레오티드 체인 어셈블리의 전체 길이에 걸쳐 영구적으로 보호된다. 외전성 아미노 그룹의 보호는 각 합성 주기의 끝에 5' 유압식 그룹의 보호와 직교해야 한다. 구현이 가장 간단하고 따라서 가장 널리 받아들여지는 전략은 외생아미노 그룹이 기저부 라벨 보호를 갖는 전략이다. 가장 흔히 두 가지 보호 체계가 사용된다.
- 첫째, 표준적이고 보다 견고한 체계(그림), A, dA, C, dC, G, dG에 대해 Bz(벤조일) 보호가 사용되며, dG는 Isobutyryl 그룹으로 보호된다. 최근에는 그림에서와 같이 Ac(아세틸) 그룹이 C와 dC를 보호하기 위해 자주 사용된다.[27]
- 두 번째 경도 보호 체계에서 A와 dA는 이소부티릴[28] 또는 페녹시아세틸 그룹(PAC)으로 보호된다.[29] C와 dC는 아세틸 보호를, [27]G와 dG는 4-이소프로필페녹시아세틸(i-PR-PAC)[30] 또는 디메틸포름아미디노(dmf)[31] 그룹으로 보호한다. 가벼운 보호 그룹은 표준 보호 그룹보다 더 쉽게 제거된다. 그러나 이러한 집단이 함유된 인광산염은 용액에 보관할 때 안정성이 떨어진다.
- 인산염 그룹은 염기성 2-시아노에틸 그룹에 의해 보호된다.[32] 일단 인산염은 고체 지지 결합형 올리고뉴클레오티드에 결합되고 인산염 모이에티스가 P(V) 종으로 전환되면, 추가 결합 반응을 성공적으로 수행하기 위해 인산염 보호의 존재가 의무적인 것은 아니다.[33]
- RNA 합성에서 2'-히드록시 그룹은 TBDMS(t-butyldimethilsilyl) 그룹으로 보호된다.[34][35][36][37] 또는 TOM(Tri-iso-propylsilyloxymethyl) 그룹과 함께, 둘 다 불소이온으로 처리하여 분리할 수 있다.[38][39]
- 또한 인산염 모이티에는 산성 조건에서 반응하는 디이소프로필아미노(iPrN2) 집단이 있다. 활성화되면, 디이소프로필아미노 그룹은 지지 결합 올리고뉴클레오타이드의 5' 히드록시 그룹으로 대체하기 위해 떠난다.
참고 항목
참조
- ^ Beaucage, S.L.; Caruthers M.H. (1981). "Deoxynucleoside phosphoramidites—A new class of key intermediates for deoxypolynucleotide synthesis". Tetrahedron Letters. 22 (20): 1859–1862. doi:10.1016/S0040-4039(01)90461-7.
- ^ Lin, K.-Y., Matteucci, M. D. (1998). "A cytosine analog capable of clamp-like binding to a guanine in helical nucleic acids". J. Am. Chem. Soc. 120 (33): 8531–8532. doi:10.1021/ja981286z.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Nielsen, J.; Marugg, J. E.; Taagaard, M.; Van Boom, J. H.; Dahl, O. (1986). "Polymer-supported synthesis of deoxyoligonucleotides using in situ prepared deoxynucleoside 2-cyanoethyl phosphoramidites". Recl. Trav. Chim. Pays-Bas. 105 (1): 33–34. doi:10.1002/recl.19861050106.
- ^ Nielsen, J.; Taagaard, M.; Marugg, J. E.; Van Boom, J. H.; Dahl, O. (1986). "Application of 2-cyanoethyl N,N,N',N'-tetraisopropylphosphorodiamidite for in situ preparation of deoxyribonucleoside phosphoramidites and their use in polymer-supported synthesis of oligodeoxyribonucleotides". Nucleic Acids Res. 14 (18): 7391–7403. doi:10.1093/nar/14.18.7391. PMC 311758. PMID 3763407.
- ^ Nielsen, J.; Marugg, J. E.; Van Boom, J. H.; Honnens, J.; Taagaard, M.; Dahl, O. (1986). "Thermal instability of some alkyl phosphorodiamidites". J. Chem Res. Synopses (1): 26–27.
- ^ Nielsen, J.; Dahl, O. (1987). "Improved synthesis of 2-cyanoethyl N,N,N',N'-tetraisopropylphosphorodiamidite (iPr2N)2POCH2CH2CN)". Nucleic Acids Res. 15 (8): 3626. doi:10.1093/nar/15.8.3626. PMC 340760. PMID 3575107.
- ^ Beaucage, S. L. (2001). "2-Cyanoethyl Tetraisopropylphosphorodiamidite". E-EROS Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rn00312. ISBN 0471936235.
- ^ Sinha, N. D.; Biernat, J.; Koester, H. (1983). "β-Cyanoethyl N,N-dialkylamino/N-morpholinomonochloro phosphoamidites, new phosphitylating agents facilitating ease of deprotection and work-up of synthesized oligonucleotides". Tetrahedron Lett. 24 (52): 5843–5846. doi:10.1016/S0040-4039(00)94216-3.
- ^ Marugg, J. E.; Burik, A.; Tromp, M.; Van der Marel, G. A. & Van Boom, J. H. (1986). "A new and versatile approach to the preparation of valuable deoxynucleoside 3'-phosphite intermediates". Tetrahedron Lett. 24 (20): 2271–22274. doi:10.1016/S0040-4039(00)84506-2.
- ^ Guzaev, A. P.; Manoharan, M. (2001). "2-Benzamidoethyl group - a novel type of phosphate protecting group for oligonucleotide synthesis". J. Am. Chem. Soc. 123 (5): 783–793. doi:10.1021/ja0016396. PMID 11456611.
- ^ Sproat, B.; Colonna, F.; Mullah, B.; Tsou, D.; Andrus, A.; Hampel, A.; Vinayak, R. (Feb 1995). "An efficient method for the isolation and purification of oligoribonucleotides". Nucleosides & Nucleotides. 14 (1&2): 255–273. doi:10.1080/15257779508014668. ISSN 0261-3166.
- ^ Stutz, A.; Hobartner, C.; Pitsch, S. (Sep 2000). "Novel fluoride-labile nucleobase-protecting groups for the synthesis of 3'(2')-O-amino-acylated RNA sequences". Helv. Chim. Acta. 83 (9): 2477–2503. doi:10.1002/1522-2675(20000906)83:9<2477::aid-hlca2477>3.0.co;2-9. ISSN 0018-019X.
- ^ Welz, R.; Muller, S. (Jan 2002). "5-(Benzylmercapto)-1H-tetrazole as activator for 2'-O-TBDMS phosphoramidite building blocks in RNA synthesis". Tetrahedron Letters. 43 (5): 795–797. doi:10.1016/S0040-4039(01)02274-2. ISSN 0040-4039.
- ^ Vargeese, C.; Carter, J.; Yegge, J.; Krivjansky, S.; Settle, A.; Kropp, E.; Peterson, K.; Pieken, W. (1998). "Efficient activation of nucleoside phosphoramidites with 4,5-dicyanoimidazole during oligonucleotide synthesis". Nucleic Acids Res. 26 (4): 1046–1050. doi:10.1093/nar/26.4.1046. ISSN 0305-1048. PMC 147346. PMID 9461466.
- ^ a b c Gacs-Baitz, E.; Sipos, F.; Egyed, O.; Sagi, G. (2009). "Synthesis and structural study of variously oxidized diastereomeric 5'-dimethoxytrityl-thymidine-3'-O-[O-(2-cyanoethyl)-N,N-diisopropyl]-phosphoramidite derivatives. Comparison of the effects of the P=O, P=S, and P=Se functions on the NMR spectral and chromatographic properties". Chirality. 21 (7): 663–673. doi:10.1002/chir.20653. PMID 18937288.
- ^ a b Nemer, M. J.; Ogilvie, K. K. (1980). "Phosphoramidate analogs of diribonucleoside monophosphates". Tetrahedron Lett. 21 (43): 4153–4154. doi:10.1016/s0040-4039(00)93675-x.
- ^ Wilk, A.; Uznanski, B.; Stec, W. J. (1991). "Assignment of absolute configuration at phosphorus in dithymidylyl(3',5')phosphormorpholidates and -phosphormorpholidothioates". Nucleosides & Nucleotides. 10 (1–3): 319–322. doi:10.1080/07328319108046469.
- ^ Guzaev, A. P. (2011). "Reactivity of 3H-1,2,4-dithiazole-3-thiones and 3H-1,2-dithiole-3-thiones as sulfurizing agents for oligonucleotide synthesis". Tetrahedron Letters. 52 (3): 434–437. doi:10.1016/j.tetlet.2010.11.086.
- ^ Holloway, G. A.; Pavot, C.; Scaringe, S. A.; Lu, Y.; Rauchfuss, T. B. (2002). "An organometallic route to oligonucleotides containing phosphoroselenoate". ChemBioChem. 3 (11): 1061–1065. doi:10.1002/1439-7633(20021104)3:11<1061::aid-cbic1061>3.0.co;2-9. PMID 12404630.
- ^ Ravikumar, V. T.; Kumar, R. K. (2004). "Stereoselective Synthesis of Alkylphosphonates: A Facile Rearrangement of Cyanoethyl-Protected Nucleoside Phosphoramidites". Org. Process Res. Dev. 8 (4): 603–608. doi:10.1021/op030035u.
- ^ "Beta-Cyanoethyl Phosphoramidites". Products.appliedbiosystems.com. Retrieved 2009-05-12.
- ^ "Biosearch Technologies". Biosearchtech.com. Retrieved 2009-05-12.
- ^ "ChemGenes Corporation, a Biotechnology company". Chemgenes.com. Retrieved 2009-05-12.
- ^ M. Powell (2008-01-17). "Applied Biosystems Instruments". Glenresearch.com. Retrieved 2009-05-12.
- ^ "Nucleic Acid Synthesis & Labeling". Thermo.com. 2008-08-16. Archived from the original on February 28, 2009. Retrieved 2009-05-12.
- ^ Gryaznov, S. M.; Letsinger, R. L. (1991). "Synthesis of oligonucleotides via monomers with unprotected bases". J. Am. Chem. Soc. 113 (15): 5876–5877. doi:10.1021/ja00015a059.
- ^ a b Reddy, M. P.; Hanna, N. B.; Farooqui, F. (1997). "Ultrafast Cleavage and Deprotection of Oligonucleotides Synthesis and Use of CAc Derivatives". Nucleosides & Nucleotides. 16 (7–9): 1589–1598. doi:10.1080/07328319708006236.
- ^ McMinn, D. (1997). "Synthesis of oligonucleotides containing 3'-alkyl amines using N-isobutyryl protected deoxyadenosine phosphoramidite". Tetrahedron Lett. 38 (18): 3123. doi:10.1016/S0040-4039(97)00568-6.
- ^ Schulhof, J. C.; Molko, D.; Teoule, R. (1987). "The final deprotection step in oligonucleotide synthesis is reduced to a mild and rapid ammonia treatment by using labile base-protecting groups". Nucleic Acids Res. 15 (2): 397–416. doi:10.1093/nar/15.2.397. PMC 340442. PMID 3822812.
- ^ Zhu, Q. (2001). "Observation and elimination of N-acetylation of oligonucleotides prepared using fast-deprotecting phosphoramidites and ultra-mild deprotection". Bioorg. Med. Chem. Lett. 11 (9): 1105–7. doi:10.1016/S0960-894X(01)00161-5. PMID 11354354.
- ^ McBride, L. J.; Kierzek, R.; Beaucage, S. L.; Caruthers, M. H. (1986). "Nucleotide chemistry. 16. Amidine protecting groups for oligonucleotide synthesis". J. Am. Chem. Soc. 108 (8): 2040. doi:10.1021/ja00268a052.
- ^ Sinha, N. D.; Biernat, J.; McManus, J.; Koester, H. (1984). "Polymer support oligonucleotide synthesis. XVIII: use of β-cyanoethyl-N,N-dialkylamino-/N-morpholino phosphoramidite of deoxynucleosides for the synthesis of DNA fragments simplifying deprotection and isolation of the final product". Nucleic Acids Res. 12 (11): 4539–4557. doi:10.1093/nar/12.11.4539. PMC 318857. PMID 6547529.
- ^ Guzaev, A. P.; Manoharan, M. (2001). "Phosphoramidite Coupling to Oligonucleotides Bearing Unprotected Internucleosidic Phosphate Moieties". J. Org. Chem. 66 (5): 1798–1804. doi:10.1021/jo001591e. PMID 11262130.
- ^ Ogilvie, K. K.; Theriault, N.; Sadana, K. L. (1977). "Synthesis of oligoribonucleotides". J. Am. Chem. Soc. 99 (23): 7741–7743. doi:10.1021/ja00465a073. PMID 915168.
- ^ Usman, N.; Ogilvie, K. K.; Jiang, M. Y.; Cedergren, R. J. (1987). "The automated chemical synthesis of long oligoribuncleotides using 2'-O-silylated ribonucleoside 3'-O-phosphoramidites on a controlled-pore glass support: synthesis of a 43-nucleotide sequence similar to the 3'-half molecule of an Escherichia coli formylmethionine tRNA". J. Am. Chem. Soc. 109 (25): 7845–7854. doi:10.1021/ja00259a037.
- ^ Usman, N.; Pon, R. T.; Ogilvie, K. K. (1985). "Preparation of ribonucleoside 3'-O-phosphoramidites and their application to the automated solid phase synthesis of oligonucleotides". Tetrahedron Lett. 26 (38): 4567–4570. doi:10.1016/S0040-4039(00)98753-7.
- ^ Scaringe, S. A.; Francklyn, C.; Usman, N. (1990). "Chemical synthesis of biologically active oligoribonucleotides using β-cyanoethyl protected ribonucleoside phosphoramidites". Nucleic Acids Res. 18 (18): 5433–5441. doi:10.1093/nar/18.18.5433. PMC 332221. PMID 2216717.
- ^ Pitsch, S.; Weiss, P. A.; Wu, X.; Ackermann, D.; Honegger, T. (1999). "Fast and reliable automated synthesis of RNA and partially 2'-O-protected precursors ("caged RNA") based on two novel, orthogonal 2'-O-protecting groups". Helv. Chim. Acta. 82 (10): 1753–1761. doi:10.1002/(SICI)1522-2675(19991006)82:10<1753::AID-HLCA1753>3.0.CO;2-Y.
- ^ Pitsch, S.; Weiss, P. A.; Jenny, L.; Stutz, A.; Wu, X. (2001). "Reliable chemical synthesis of oligoribonucleotides (RNA) with 2'-O-[(triisopropylsilyl)oxy]methyl(2'-O-tom)-protected phosphoramidites". Helv. Chim. Acta. 84 (12): 3773–3795. doi:10.1002/1522-2675(20011219)84:12<3773::AID-HLCA3773>3.0.CO;2-E.
추가 읽기
- 포괄적 천연물 화학, 제7권: DNA와 분자생물학의 양상 Kool, Eric T.; 편집자. 넷. (1999), 733 pp. 출판사: (Elsevier, 암스테르담, Neth.)
- Beaucage S. L., Iyer R. P. (1992). "Advances in the synthesis of oligonucleotides by the phosphoramidite approach". Tetrahedron. 48 (12): 2223–2311. doi:10.1016/s0040-4020(01)88752-4.
- Beaucage S. L., Iyer R. P. (1993). "The functionalization of oligonucleotides via phosphoramidite derivatives". Tetrahedron. 49 (10): 1925–1963. doi:10.1016/s0040-4020(01)86295-5.
- Beaucage S. L., Iyer R. P. (1993). "The synthesis of modified oligonucleotides by the phosphoramidite approach and their applications". Tetrahedron. 49 (28): 6123–6194. doi:10.1016/s0040-4020(01)87958-8.
- Boaucage, S L. "Oligodoxyrivonucleotides 합성. 인광암산염 접근법. Methods in Molecular Biology(토토와, NJ, 미국)(1993), 20(올리고뉴클레오티드 및 아날로그 프로토콜), 33–61.
- Reese C. B. (2002). "The chemical synthesis of oligo- and poly-nucleotides: a personal commentary". Tetrahedron. 58 (44): 8893–8920. doi:10.1016/s0040-4020(02)01084-0.
- 브라운 T, 브라운 D. J. S. 1991. 올리고뉴클레오티즈와 아날로그에서. 실용적 접근법, 에드. F. Eckstein, 페이지 1-24. 옥스퍼드: IRL