파알-노르 합성
Paal–Knorr synthesis| 파알-노르 합성 | |
|---|---|
| 이름을 따서 명명됨 | 칼 팔 루트비히 노르 |
| 반응형 | 링 형성 반응 |
| 식별자 | |
| RSC 온톨로지 ID | RXNO:0000161 |
유기화학에서의 Paal-Knorr 합성은 1,4-디케톤에서 푸란, 피롤 또는 티오페네를 생성하는 반응이다. 그것은 많은 천연물의 공통된 구조 요소인 대체 퓨란과 피롤을 얻기 위한 종합적으로 가치 있는 방법이다. 초기에는 독일의 화학자 칼 파알과 루드비히 크노르에 의해 푸란 조제법으로 1884년 독립적으로 보고되었으며, 피롤과 티오페네에 맞게 각색되어 왔다.[1][2] Paal-Knorr 합성이 널리 사용되는 것을 보았지만, 이 메커니즘은 V에 의해 해명될 때까지 완전히 이해되지 않았다. 1990년대 아마르나트 외 연구진.[3][4]
후란 합성은 산성 촉매를 필요로 한다.[5]
피롤 합성에 1차 아민은 다음과 같이 참여한다.
그리고 티오페네의 그것에서 예를 들면, 인 펜타설피드 화합물은 다음과 같다.
메커니즘
후란합성
| 파알-노르 푸란 합성 | |
|---|---|
| 식별자 | |
| 유기화학포털 | 파-노르-푸란-푸란-스페인 |
| RSC 온톨로지 ID | RXNO:0000162 |
산성 촉매 후란 합성은 다른 카보닐의 형성 에놀에 의해 공격되는 한 카보닐의 양성화에 의해 진행된다. 헤미아세트 탈수는 결과적으로 후란을 일으킨다.[6]
Paal-Knorr puran 합성의 메커니즘은 V에 의해 1995년에 설명되었다. 아마르나트 [3]외 아마르나스의 연구는 3,4-분산-2,5-헥산 디온스의 이질 제거제가 다른 비율로 반응한다는 것을 보여주었다. 일반적으로 받아들여지는 메커니즘에서, 이 디온들은 공통 에놀 중간을 거치게 되는데, 이는 메소와 d,l-레이스 이소머들이 공통 중간에서 형성되는 것과 같은 속도로 사이클링을 하게 된다는 것을 의미한다. 서로 다른 반응의 함축적 의미는 사이클화가 에놀 형성과 일치된 단계에서 일어날 필요가 있다는 것이다. 따라서 이 메커니즘은 형성 에놀을 가진 양성자 카보닐의 공격을 통해 발생하도록 제안되었다. 아마르나스는 또한 미처리된 디오네가 순응적 이성질화를 겪지 않았다는 것을 발견했는데, 이것은 또한 에놀이 중간이 아님을 나타내기도 했다.
피롤 합성
| 파알-노르 피롤 합성 | |
|---|---|
| 식별자 | |
| 유기화학포털 | 파-노르-피롤레-피롤레-피롤레-피롤레-피롤레- |
| RSC 온톨로지 ID | RXNO:0000164 |
피롤 합성을 위한 메커니즘은 V에 의해 조사되었다. 1991년 아마르나트 외.[4] 그의 연구는 양성자 카보닐이 아민에 의해 공격되어 뇌하수체를 형성한다는 것을 암시한다. 아민은 다른 카보닐을 공격하여 2,5-dihydroxytrahydropyrole 파생물을 형성하고, 이 파생물은 탈수증을 일으켜 해당 대체 피롤을 준다.[7]
반응은 일반적으로 양성자 또는 루이스 산성의 조건에서 1차 아민과 함께 실행된다. 수산화 암모늄 또는 아세테이트 암모늄(Paal이 보고한 바와 같이)을 사용하면 N-미대체 피롤을 얻을 수 있다.
티오페네 합성
| 파알-노르 티오페네 합성 | |
|---|---|
| 식별자 | |
| 유기화학포털 | 파-노르-thiophene-pa-knorr-thiophene- |
| RSC 온톨로지 ID | RXNO:0000163 |
티오펜 합성은 후란 합성과 매우 유사한 메커니즘을 통해 달성된다. 초기 디케톤은 유황화 물질을 가진 티오케톤으로 변환되어 후란합성과 동일한 메커니즘을 거친다.[8]
대부분의 황화제는 강한 탈수기로 반응의 완성을 촉진한다. Paal-Knorr puran 합성의 메커니즘을 향한 초기 가설은 티오페네가 puran 제품의 황화에 의해 달성되었음을 시사했다. Campaigne와 Foye는 Paal-Knorr puran 합성으로부터 격리된 푸란과 Pentasulfide를 사용한 Phentasulfide의 치료는 1,4-Dicarbonyls의 치료와 일관되지 않는 결과를 가져왔음을 보여주었는데, 이것은 푸란 메커니즘의 황화를 배제하고 디카르보닐의 황화를 통해 반응이 진행됨을 암시한다. 티오케톤을 생산한다.[8]
범위
Paal-Knorr 반응은 상당히 다재다능하다. 모든 합성물에서 거의 모든 디카르보닐은 상응하는 이성애자로 변환될 수 있다. R2와 R5는 H, 아릴 또는 알킬일 수 있다. R3, R4는 H, 아릴, 알킬 또는 에스테르일 수 있다. 피롤 합성(X = N)에서 R1은 H, 아릴, 알킬, 아미노 또는 히드록실일 수 있다.[9]
이러한 반응을 수행하기 위해 다양한 조건을 사용할 수 있는데, 대부분은 온화하다. Paal-Knorr Furan 합성은 일반적으로 수성 황산이나 염산과 같은 양성산을 가진 수성 조건이나 루이스 산이나 탈수제를 가진 무수 조건에서 수행된다. 일반적인 탈수제로는 오산화 인, 무수화물 또는 염화 아연이 있다. 피롤 합성은 유사한 조건에서 1차 아민이 필요하거나 암모니아(또는 암모니아 전구체)를 사용할 수 있다. 티오페인을 합성하려면 일반적으로 충분한 탈수기인 인 펜타설피드, 로에손의 시약 또는 황화수소와 같은 황화제가 필요하다.
전통적으로 Paal-Knorr 반응은 1,4-Diketon을 합성 전구체로 사용할 수 있기 때문에 범위가 제한되어 왔다. 현재의 화학적 방법은 이러한 시약들의 접근성을 크게 확장시켰으며, Paal-Knorr의 변형은 이제 다른 전구체를 사용할 수 있게 되었다. Paal-Knorr은 또한 많은 잠재적 푸란 전구체의 민감한 기능을 저하시킬 수 있는 산에서의 장기 가열과 같은 가혹한 반응 조건에 의해 제한되는 것으로 간주되었다. 현재 방법은 마이크로파 촉매 사이클링을 포함하여 열을 완전히 피할 수 있는 온화한 조건을 허용한다.
변형
몇몇 1,4-디카르보닐 대용품을 1,4-디카르보닐 대신 사용할 수 있다. 이러한 대체물들은 1,4-디카르보닐과 다른 구조를 가지고 있지만, 그들의 반응은 파알-노르와 매우 유사한 메커니즘을 통해 진행된다.
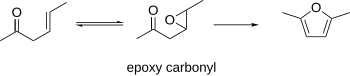
β-에폭시 카보닐
β-Epoxy 카보닐은 퓨란까지 사이클링하는 것으로 알려져 있다. 이 절차는 β-산화 불포화 카보닐을 시동 물질로 사용할 수 있으며, 이는 에폭시화 될 수 있다. 그 결과 에폭시카르보닐은 산성 또는 기초 조건 하에서 후란으로 사이클링될 수 있다.[10]
1,4-Diol-2-Ynes
1,4-diol-2-yne 시스템은 Paal-Knorr 화학에도 사용되었다. 팔라듐을 사용하면 1,4-diol-2-yne을 해당 1,4-diketone에 대해 현장에서 이소체화 한 후 탈수제를 사용하여 해당 후란으로 탈수시킬 수 있다.[11]
이러한 변동의 중요성은 존재하는 아세틸렌 화학, 특히 프로파질 알코올의 생성을 위한 화학의 풍부한 이점을 이용하여 파알-노르의 범위를 증가시킨다는 데 있다.
아세탈인
아세탈은 또한 파알-노르를 위한 유용한 출발 재료가 입증되었다. 아세트 3 결합을 가진 케톤은 1,4-디케톤과 정확히 같은 조건에서 해당 이질세포에 변환될 수 있다.
전자레인지 보조 파알-노르
또 다른 변화는 Paal-Knorr을 강화하기 위한 마이크로파 방사선의 도입이었다. 전통적인 Paal-Knorr 조건에서는 탈수증을 일으키기 위해 강한 산을 장기간 가열하는 것이 포함되었다. 마이크로파 보조 Paal-Knorr 반응은 분 단위로 측정한 시간 척도와 실온에서 열린 플라스크에서 발생하는 것으로 입증되었다.[12]
관련 반응
1884년 Knorr에 의해 보고된 Knorr pyrrole 합성은 아미노 케톤과 케톤에서 대체된 피롤을 합성한 것이다.[13]
| 크노르 피라졸 합성 | |
|---|---|
| 이름을 따서 명명됨 | 루트비히 노르 |
| 반응형 | 링 형성 반응 |
| 식별자 | |
| RSC 온톨로지 ID | RXNO:0000391 |
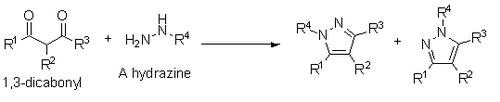
Knorr에 의해서도 보고되고 있는 것은 1,3-이카르보닐과 히드라진, 히드라지드, 또는 세미비카르바지드의 피라졸의 합성이다. 이 합성은 Paal-Knorr과 유사한 응축 메커니즘을 통해 발생하지만, 대체 하이드라진을 사용할 경우 대체 헤테로아톰이 R1 대체 물질 또는 R3 대체 물질 옆에 있는 레지오이소머가 혼합된다.[14]
합성 응용 프로그램
2000년에 B. M. 트로스트 외 연구진은 항생제 로소필린의 공식 합성을 보고했다. 다른 사람들과 마찬가지로 트로스트가 로소필린의 매크로사이클릭 중심부로 가는 경로는 융합 피롤을 얻기 위해 파알-노르 피롤 합성에 의존했다.[15] 아세트산 암모늄을 메탄올에 넣은 1,4-디케톤을 캠포르 설폰산과 앙스트롬 분자체 4개로 가열하면 피롤에 N-지체가 생기지 않는다. 이 피롤은 불안정한 것으로 확인되었으며, 이에 따라 분리 전에 피롤을 보호하기 위해 트리메틸릴 에톡시 메톡시 염화염화(SEM-Cl)로 처리되었다.
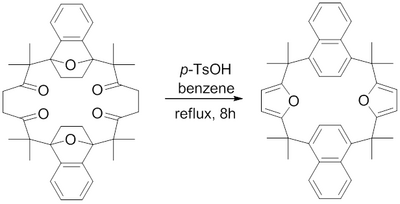
1982년 H. 하트 외 연구진은 파알-Knorr 푸란 합성을 사용하여 퓨전 후란 링을 포함하는 매크로사이클의 합성을 보고했다.[16] 벤젠에서 역류하는 파라 톨루엔 술폰산은 1,4-디케톤을 각각의 푸란으로 탈수시켜 도전적인 매크로사이클릭 퓨전 푸란을 달성하는 것으로 밝혀졌다.
참고 항목
참조
- ^ Paal, C. (1884), "Ueber die Derivate des Acetophenonacetessigesters und des Acetonylacetessigesters", Berichte der deutschen chemischen Gesellschaft, 17 (2): 2756–2767, doi:10.1002/cber.188401702228
- ^ Knorr, L. (1884), "Synthese von Furfuranderivaten aus dem Diacetbernsteinsäureester", Berichte der deutschen chemischen Gesellschaft, 17 (2): 2863–2870, doi:10.1002/cber.188401702254
- ^ a b Amarnath, V.; Amarnath, K. (1995), "Intermediates in the Paal-Knorr Synthesis of Furans", The Journal of Organic Chemistry, 60 (2): 301–307, doi:10.1021/jo00107a006
- ^ a b Amarnath, V.; Anthony, D. C.; Amarnath, K.; Valentine, W. M.; Wetterau, L. A.; Graham, D. G. (1991), "Intermediates in the Paal-Knorr synthesis of pyrroles", The Journal of Organic Chemistry, 56 (24): 6924–6931, doi:10.1021/jo00024a040
- ^ Thomas L. Gilchrist (1987). Heterocyclic Chemistry. Harlow: Longman Scientific. ISBN 0-582-01421-2.
- ^ László Kürti; Barbara Czakó (2005), Strategic Applications of Named Reactions in Organic Synthesis, Elsevier Science & Technology Books, ISBN 9780123694836
- ^ Adalbert Wollrab (1999), Organische Chemie (in German), Springer-Verlag, p. 850, ISBN 3-540-43998-6
- ^ a b Campaigne, E.; Foye, W. O. (1952), "The Synthesis of 2,5-Diarylthiophenes", The Journal of Organic Chemistry, 17 (10): 1405–1412, doi:10.1021/jo50010a023
- ^ Holman, R. W. (2005), "Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms (Kürti, László; Czakó, Barbara)", Journal of Chemical Education, 82 (12): 1780, Bibcode:2005JChEd..82S1780H, doi:10.1021/ed082p1780.3
- ^ Cormier, R. A.; Francis, M. D. (1981), "The Epoxyketone-Furan Rearrangement", Synthetic Communications, 11 (5): 365, doi:10.1080/00397918108064300
- ^ Ji, J.; Lu, X. (1993), "Facile synthesis of 2,5-disubstituted furans via palladium complex and perfluorinated resinsulfonic acid catalysed isomerization–dehydration of alkynediols", Journal of the Chemical Society, Chemical Communications (9): 764–765, doi:10.1039/C39930000764
- ^ Minetto, G.; Raveglia, L. F.; Taddei, M. (2004), "Microwave-Assisted Paal−Knorr Reaction. A Rapid Approach to Substituted Pyrroles and Furans", Organic Letters, 6 (3): 389–392, doi:10.1021/ol0362820, PMID 14748600
- ^ Knorr, L. (1884), "Synthese von Pyrrolderivaten", Berichte der deutschen chemischen Gesellschaft, 17 (2): 1635–1642, doi:10.1002/cber.18840170220
- ^ Knorr, L. (1883), "Einwirkung von Acetessigester auf Phenylhydrazin", Berichte der deutschen chemischen Gesellschaft, 16 (2): 2597–2599, doi:10.1002/cber.188301602194
- ^ Trost, B. M.; Doherty, G. A. (2000), "An Asymmetric Synthesis of the Tricyclic Core and a Formal Total Synthesis of Roseophilin via an Enyne Metathesis", Journal of the American Chemical Society, 122 (16): 3801–3810, doi:10.1021/ja9941781
- ^ Hart, H.; Takehira, Y. (1982), "Adducts derived from furan macrocycles and benzyne", The Journal of Organic Chemistry, 47 (22): 4370–4372, doi:10.1021/jo00143a049