프로타민
Protamine| 프로타민 1 | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 기호 | PRM1 | ||||||
| 엔씨비유전자 | 5619 | ||||||
| HGNC | 9447 | ||||||
| 오밈 | 182880 | ||||||
| RefSeq | NM_002761 | ||||||
| 유니프로트 | P04553 | ||||||
| 기타자료 | |||||||
| 로커스 | 16번 씨 13.13 페이지 | ||||||
| |||||||
| 프로타민 2 | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 기호 | PRM2 | ||||||
| 엔씨비유전자 | 5620 | ||||||
| HGNC | 9448 | ||||||
| 오밈 | 182890 | ||||||
| RefSeq | NM_002762 | ||||||
| 유니프로트 | P04554 | ||||||
| 기타자료 | |||||||
| 로커스 | 16번 씨 13.13 페이지 | ||||||
| |||||||
프로토민은 작고 아르기닌이 풍부한 핵 단백질로 정자생식의 하플로이드 단계에서 늦게 히스톤을 대체하며 정자 헤드 응축과 DNA 안정화에 필수적이라고 여겨진다. 그것들은 히스톤보다 정자의 DNA의 밀도가 더 높은 포장을 허용할 수 있지만, 유전자 데이터가 단백질 합성에 사용될 수 있기 전에 압축을 풀어야 한다. 그러나 인간과 다른 영장류에서 정자의 게놈의 1015%는 초기 배아발달에 필수적인 유전자를 결합하는 것으로 생각되는 히스톤에 의해 포장된다.[1]
프로타민과 프로타민 유사 단백질(PL)은 정자 특이 핵 기본 단백질(SNBP)으로 통칭된다. PL 단백질은 프로타민과 히스톤 H1 사이의 중간 구조다. PL의 C단말 영역은 척추동물 프로토타민의 전구체가 될 수 있다.[2]
정자생식
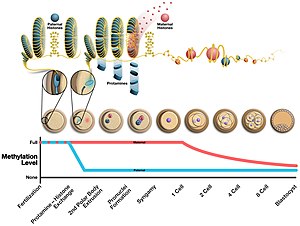
정자가 형성되는 동안 프로타민은 아르기닌이 풍부한 영역을 닻으로 삼아 DNA의 인산염 중추에 결합한다. DNA는 그 메커니즘을 알 수는 없지만 O자 모양의 구조인 토로이드로 접혀진다. 정자 세포는 핵 안에 약 50 킬로바스를 포함하는 각각의 토로이드를 포함하는 최대 5만 개의 토로이드 모양의 구조물을 포함할 수 있다.[4] 토로이드가 형성되기 전에, 프로타민이 그것을 응축할 수 있도록 전환된 핵 단백질에 의해 DNA에서 히스톤이 제거된다. 이러한 변화의 영향은 1) 머리 크기를 줄임으로써 액체를 통한 더 나은 흐름을 위한 정자 수역학의 증가 2) DNA 손상 발생의 감소 3) 히스톤 수정과 함께 발생하는 후생유전학적 표지의 제거)이다.[5]
정자 헤드의 구조도 프로타민 수치와 관련이 있다. 프로타민 2 대 프로타민 1의 비율과 전환핵단백질들은 프로모터 지역에서 돌연변이를 통해 프로타민 2의 발현을 변화시킴으로써 다양한 종의 생쥐에서 정자의 머리 모양을 변화시키는 것으로 밝혀졌다. 그 비율의 감소는 무스 종의 정자의 경쟁력을 증가시키는 것으로 밝혀졌다. 그러나 이 비율이 머리 모양에 어떤 영향을 미치는지, 일부일처제가 이 선택에 영향을 미치는지 판단하기 위해서는 추가 검사가 필요하다. 인간에게 있어서, 불균형한 Prm1/Prm2를 가진 남성이 난임 또는 불임이라는 연구결과가 있다.[6] 프로타민 2는 기능하기 전에 N단자를 분해해야 하는 더 긴 단백질로 암호화된다. 인간과 침팬지는 빠른 진화를 거쳤다.[7]
의학적 용법
인슐린과 혼합될 때, 프로토민은 시작 속도를 늦추고 인슐린 작용 기간을 증가시킨다(NPH 인슐린 참조).[8]
프로타민은 심장수술, 혈관수술, 중재적 방사선 시술 등에 사용돼 헤파린의 항복제 효과를 무력화시킨다. 부작용으로는 폐동맥압의 증가와 말초혈압의 감소, 심근산소 소비, 심박출량, 심박수 등이 있다.[9]
프로타민 황산염은 헤파린 과다 복용을 위한 해독제지만 심각한 알레르기가 발생할 수 있다.[10] 줄인 프로타민도 강력한 헤파린 대항마로 작용하지만 항원성이 현저히 감소한다. 처음에는 프로타민의 열성소화에 의해 만들어진 혼합물로서 [11]생산되었지만, 실제 유효 펩타이드 부분은 VSRRRRRRGGRRRR 그 후 격리되어 있다.[12] 이 펩타이드의 아날로그도 생산되었다.[13]
유전자 치료에서, 미국 식품의약국(FDA)의 승인과 함께 플라스미드 DNA를 응축하는 프로토아민 황산염의 능력은[14] 바이러스 및 비바이러스([15]예: 양이온 리포솜을 활용한) 매개 전달 메커니즘에 의해 전도가율을 증가시킬 수 있는 호소력 있는 후보가 되었다.
프로타민은 비만을 예방하는 약으로 사용될 수 있다. 프로타민은 고지방 다이어트 쥐에서 체중 증가와 저밀도 지단백질을 억제하는 것으로 나타났다. 이 효과는 삼아시글리세롤 소화와 흡수를 담당하는 효소인 리파아제 활성 억제를 통해 발생하며, 이로 인해 식이지방의 흡수가 감소한다. 쥐를 프로타민으로 치료했을 때 간 손상은 발견되지 않았다. 그러나 소장에서 소화 및 흡수를 위한 긴사슬 지방산의 유화작용은 쥐에 비해 인간에게 일정하지 않아 약물로써 프로타민의 효능이 달라질 것이다. 더욱이 인간 펩타이드제는 다른 비율로 프로타민을 저하시킬 수 있으므로, 인간의 비만을 예방할 수 있는 프로타민의 능력을 결정하기 위한 추가 테스트가 필요하다.[16]
종 분포 및 이소 형태
생쥐, 인간[1], 특정 물고기는 둘 이상의 다른 양성자를 가지고 있는 반면, 황소와 멧돼지의 정자는 PRM2 유전자의 돌연변이로 인해 한 가지 형태의 양성자를 가지고 있다.[17] 랫드에서는 PRM2의 유전자가 존재하지만 mRNA 대본의 변형 처리 외에 비효율적인 촉진자 때문에 전사가 제한되어 이 단백질의 발현이 극히 적다.[18]
포유류
인간 양성자 2명은 PRM1과 PRM2로 표시되며, 생쥐와 인간에서는 PRM1, PRM2, TRN2가 동일한 유전자 군집 안에서 발견된다.[19]
에우테리아 포유류들은 일반적으로 PRM1과 PRM2를 모두 가지고 있다. 반면에 메타테리아 포유류들은 P1과 동음이의어만 가지고 있다.[20]
물고기
물고기의 양성자의 예는 다음과 같다.
- 연어로부터 황산염과 염산염.
- 청어 정자에서 나온 클루페인(클루페아)
- 무지개송어에서 나온 이리딘
- 튜나피쉬에서 묽은 9(Tunnus)
- 별 모양의 철갑상어(Acipenser stellatus)에서 나온 stelline
- 도그피쉬(실리오르히누스)에서 나온 스키리오리닌
어류 프로타민은 일반적으로 포유류보다 키가 작으며, 아르기닌 함량이 높다.[20]
순서
| 프로타민 P1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| 기호 | 프로타민_P1 | ||||||||
| Pfam | PF00260 | ||||||||
| 인터프로 | IPR000221 | ||||||||
| 프로사이트 | PDOC00047 | ||||||||
| |||||||||
| 프로타민 P2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| 기호 | 프로타민_P2 | ||||||||
| Pfam | PF00841 | ||||||||
| 인터프로 | IPR000492 | ||||||||
| |||||||||

태반 포유류에서 정자 세포에 DNA를 포장하는 데 사용되는 프로타민 P1의 1차 구조는 보통 49 또는 50개의 아미노산이다. 이 염기서열은 세 개의 별도 영역으로 나뉜다. DNA 결합을 위한 아르기닌이 풍부한 영역은 대부분 시스테인 잔류물을 함유한 짧은 펩타이드 염기서열로 측면에 있다. 아르기닌이 풍부한 영역은 3-11 아르기닌 잔류물로 구성되며 약 60-80% 시퀀스 아이덴티티로 어류 프로타민과 포유류 프로타민 1 시퀀스 사이에 보존된다.[1]
구조
번역 후, 프로토아민 P1 구조는 위에서 언급한 세 가지 영역 모두에서 즉시 인산염화된다. 정자가 난자에 들어갈 때 또 한 번 인산화가 일어나지만, 이러한 인산화의 기능은 불확실하다.[1]
프로토타민의 정확한 2차 구조와 3차 구조는 확실히 알려져 있지 않지만 1970년대 이후 여러 건의 제안이 발표되었다.[22][23][1][24][25][20][26] 광범위한 합의는 프로토민이 이슐피드 결합(그리고 잠재적으로 디티로신과 시스테인-티로신 결합)을 통해 교차되는 베타 스트랜드 구조를 형성한다는 것이다.[25][20] 프로타민 P1이 DNA에 결합하면 한 프로타민 P1의 아미노 단자에서 나온 시스테인은 다른 프로타민 P1의 카르복시-단자로부터 나온 시스테인과 이황화 결합을 형성한다. 백본 충전 프로타민을 중화시킴으로써 DNA가 더욱 단단하게 코일을 할 수 있게 한다.[3][26] 이황화 결합은 정자가 난자에 들어갈 때 결합이 줄어들 때까지 DNA로부터 프로타민 P1의 분열을 막는 기능을 한다.[1] 이 긴 프로타민 폴리머들은 주요 홈 안에서 DNA를 감싸고 있을 수 있다.[1][23]
참고 항목
참조
- ^ a b c d e f g Balhorn R (2007). "The protamine family of sperm nuclear proteins". Genome Biology. 8 (9): 227. doi:10.1186/gb-2007-8-9-227. PMC 2375014. PMID 17903313.
- ^ Eirín-López JM, Ausió J (October 2009). "Origin and evolution of chromosomal sperm proteins". BioEssays. 31 (10): 1062–70. doi:10.1002/bies.200900050. PMID 19708021. S2CID 17131119.
- ^ a b Jenkins TG, Carrell DT (2012). "Dynamic alterations in the paternal epigenetic landscape following fertilization". Frontiers in Genetics. 3: 143. doi:10.3389/fgene.2012.00143. PMC 3442791. PMID 23024648.
- ^ Brewer LR, Corzett M, Balhorn R (October 1999). "Protamine-induced condensation and decondensation of the same DNA molecule". Science. 286 (5437): 120–3. doi:10.1126/science.286.5437.120. PMID 10506559.
- ^ Woop M (January 2015). "Optimizing Tethered Particle Motion to Measure DNA Compaction by Protamine". Biophysical Journal. 108 (2): 393a. Bibcode:2015BpJ...108..393W. doi:10.1016/j.bpj.2014.11.2156.
- ^ Lüke L, Campbell P, Varea Sánchez M, Nachman MW, Roldan ER (May 2014). "Sexual selection on protamine and transition nuclear protein expression in mouse species". Proceedings. Biological Sciences. 281 (1783): 20133359. doi:10.1098/rspb.2013.3359. PMC 3996607. PMID 24671975.
- ^ Wyckoff GJ, Wang W, Wu CI (January 2000). "Rapid evolution of male reproductive genes in the descent of man". Nature. 403 (6767): 304–9. Bibcode:2000Natur.403..304W. doi:10.1038/35002070. PMID 10659848. S2CID 3136139.
- ^ Owens DR (June 2011). "Insulin preparations with prolonged effect". Diabetes Technology & Therapeutics. 13 Suppl 1: S5-14. doi:10.1089/dia.2011.0068. PMID 21668337.
- ^ Carr JA, Silverman N (October 1999). "The heparin-protamine interaction. A review". The Journal of Cardiovascular Surgery. 40 (5): 659–66. PMID 10596998.
- ^ Weiler JM, Freiman P, Sharath MD, Metzger WJ, Smith JM, Richerson HB, et al. (February 1985). "Serious adverse reactions to protamine sulfate: are alternatives needed?". The Journal of Allergy and Clinical Immunology. 75 (2): 297–303. doi:10.1016/0091-6749(85)90061-2. PMID 2857186.
- ^ Byun Y, Chang LC, Lee LM, Han IS, Singh VK, Yang VC (2000). "Low molecular weight protamine: a potent but nontoxic antagonist to heparin/low molecular weight protamine". ASAIO Journal. 46 (4): 435–9. doi:10.1097/00002480-200007000-00013. PMID 10926141. S2CID 13106365.
- ^ He H, Ye J, Liu E, Liang Q, Liu Q, Yang VC (November 2014). "Low molecular weight protamine (LMWP): a nontoxic protamine substitute and an effective cell-penetrating peptide". Journal of Controlled Release. 193: 63–73. doi:10.1016/j.jconrel.2014.05.056. PMID 24943246.
- ^ Chang LC, Lee HF, Yang Z, Yang VC (1 September 2001). "Low molecular weight protamine (LMWP) as nontoxic heparin/low molecular weight heparin antidote (I): preparation and characterization". AAPS PharmSci. 3 (3): 7–14. doi:10.1208/ps030317. PMC 2751012. PMID 11741268.
- ^ Cornetta K, Anderson WF (February 1989). "Protamine sulfate as an effective alternative to polybrene in retroviral-mediated gene-transfer: implications for human gene therapy". Journal of Virological Methods. 23 (2): 187–94. doi:10.1016/0166-0934(89)90132-8. PMID 2786000.
- ^ Sorgi FL, Bhattacharya S, Huang L (September 1997). "Protamine sulfate enhances lipid-mediated gene transfer". Gene Therapy. 4 (9): 961–8. doi:10.1038/sj.gt.3300484. PMID 9349433. S2CID 22101764.
- ^ Duarte-Vázquez MA, García-Padilla S, Olvera-Ochoa L, González-Romero KE, Acosta-Iñiguez J, De la Cruz-Cordero R, Rosado JL (June 2009). "Effect of protamine in obesity induced by high-fat diets in rats". International Journal of Obesity. 33 (6): 687–92. doi:10.1038/ijo.2009.78. PMID 19434066.
- ^ Maier WM, Nussbaum G, Domenjoud L, Klemm U, Engel W (March 1990). "The lack of protamine 2 (P2) in boar and bull spermatozoa is due to mutations within the P2 gene". Nucleic Acids Research. 18 (5): 1249–54. doi:10.1093/nar/18.5.1249. PMC 330441. PMID 2320417.
- ^ Bunick D, Balhorn R, Stanker LH, Hecht NB (May 1990). "Expression of the rat protamine 2 gene is suppressed at the level of transcription and translation". Experimental Cell Research. 188 (1): 147–52. doi:10.1016/0014-4827(90)90290-q. PMID 2328773.
- ^ Wykes SM, Krawetz SA (October 2003). "Conservation of the PRM1 --> PRM2 --> TNP2 domain". DNA Sequence. 14 (5): 359–67. doi:10.1080/10425170310001599453. PMID 14756422. S2CID 37737173.
- ^ a b c d Powell CD, Kirchoff DC, DeRouchey JE, Moseley HN (April 2020). "Entropy based analysis of vertebrate sperm protamines sequences: evidence of potential dityrosine and cysteine-tyrosine cross-linking in sperm protamines". BMC Genomics. 21 (1): 277. doi:10.1186/s12864-020-6681-2. PMC 7126135. PMID 32245406.
- ^ Balhorn R (2007-09-26). "The protamine family of sperm nuclear proteins". Genome Biology. 8 (9): 227. doi:10.1186/gb-2007-8-9-227. PMC 2375014. PMID 17903313.
- ^ Warrant RW, Kim SH (January 1978). "alpha-Helix-double helix interaction shown in the structure of a protamine-transfer RNA complex and a nucleoprotamine model". Nature. 271 (5641): 130–5. doi:10.1038/271130a0. PMID 622153. S2CID 4172929.
- ^ a b Hud NV, Milanovich FP, Balhorn R (June 1994). "Evidence of novel secondary structure in DNA-bound protamine is revealed by Raman spectroscopy". Biochemistry. 33 (24): 7528–35. doi:10.1021/bi00190a005. PMID 8011618.
- ^ Martins RP, Ostermeier GC, Krawetz SA (December 2004). "Nuclear matrix interactions at the human protamine domain: a working model of potentiation". The Journal of Biological Chemistry. 279 (50): 51862–8. doi:10.1074/jbc.M409415200. PMID 15452126.
- ^ a b Vilfan ID, Conwell CC, Hud NV (May 2004). "Formation of native-like mammalian sperm cell chromatin with folded bull protamine". The Journal of Biological Chemistry. 279 (19): 20088–95. doi:10.1074/jbc.M312777200. PMID 14990583.
- ^ a b Ukogu OA, Smith AD, Devenica LM, Bediako H, McMillan RB, Ma Y, et al. (June 2020). "Protamine loops DNA in multiple steps". Nucleic Acids Research. 48 (11): 6108–6119. doi:10.1093/NAR/GKAA365. PMC 7293030. PMID 32392345.