체미오스모스
Chemiosmosis체미오스모스(chemiosmosis)는 반과열성 막 결합 구조에서 전기화학 구배를 따라 이온의 이동이다. 세포호흡이나 광합성 과정에서 수소이온(H+)이 막을 가로지르는 움직임에 의해 아데노신 삼인산(ATP)이 형성되는 것이 중요한 예다.
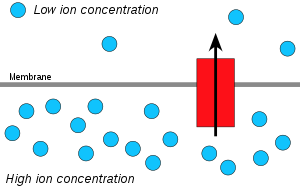
수소 이온, 즉 양성자는 양성자 농도가 높은 지역에서 양성자 농도가 낮은 지역으로 확산되며, 막을 가로질러 양성자의 전기화학 농도 구배를 이용하여 ATP를 만들 수 있다. 이 과정은 선택적 막을 가로지르는 물의 이동인 삼투와 관련이 있어 이를 '체미오스포시스'라고 부른다.
ATP 싱타아제는 체미오스메시스(chemiosmosis)에 의해 ATP를 만드는 효소다. 양성자가 막을 통과할 수 있도록 하고 인산화 아데노신 디포스포산염(ADP)에 자유 에너지 차이를 이용해 ATP를 만든다. 체모스모스에 의한 ATP 생성은 대부분의 박테리아와 고고학뿐만 아니라 미토콘드리아와 엽록체에서도 일어난다. 예를 들어 광합성 중 엽록체에서 전자전달체인은 태일라코이드 막을 통해 태일라코이드 공간에 있는 H+ 이온(프로톤)을 스트로마(유체)로 펌프한다. 저장된 에너지는 양성자가 ATP 싱타아제를 통해 이동함에 따라 ATP를 만드는 광인산화 ADP에 사용된다.
체모스모틱 이론
피터 D. Mitchell은 1961년에 체미오스테틱 가설을 제안했다.[1] 이 이론은 근본적으로 세포 재전송에 사용되는 대부분의 아데노신 트리인산염(ATP) 합성은 포도당과 같은 유기 분자의 분해로 형성된 시토크롬 c, NADH, FADH와의2 redox 반응에서 방출되는 산소의 에너지를 사용하여 생성된 미토콘드리아의 내부 막에 걸친 전기화학적 경사로에서 나온다는 것을 시사한다.
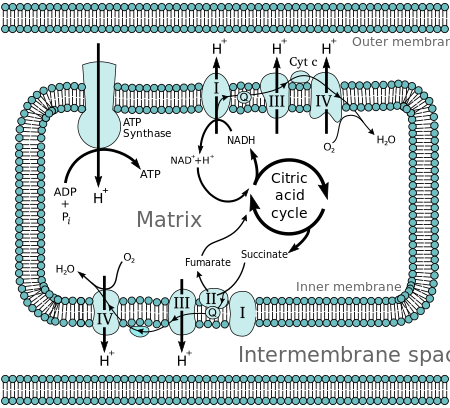
포도당과 같은 분자는 신진대사를 통해 상당히 에너지가 풍부한 중간 물질로서 아세틸 CoA를 생성한다. 미토콘드리아 매트릭스에서 아세틸 코엔자임 A(acetyl-CoA)의 산화는 니코틴아미드 아데닌 디뉴클레오티드(NAD), 플라빈 아데닌 디뉴클레오티드(FAD)와 같은 운반체 분자의 감소와 결합된다.[2] 캐리어는 내측 미토콘드리아 막에 있는 전자전달체인(ETC)에 전자를 전달하고, 이 전자는 다시 ETC에 있는 다른 단백질에 전자를 전달한다. ETC의 단자 수용기인 산소의 에너지는 매트릭스에서 양성자를 상호간 공간으로 펌핑하는 데 사용되며, 에너지는 투과성 전기화학 구배 형태로 저장된다. 양자는 효소 ATP 신타아제를 통해 내막을 가로질러 다시 이동한다. ATP 신타제를 통해 미토콘드리온의 매트릭스로 되돌아가는 양자의 흐름은 ADP가 무기인산염과 결합하여 ATP를 형성할 수 있는 충분한 에너지를 제공한다.
이것은 당시 급진적인 제안이었고, 잘 받아들여지지 않았다. 전자전달의 에너지가 화학적으로 더 보수적인 개념인 안정적 높은 잠재력 중간으로 저장되어 있다는 견해가 지배적이었다. 오래된 패러다임의 문제는 고에너지 중간이 발견되지 않았고, 전자전달 사슬의 콤플렉스에 의한 양성자 펌핑에 대한 증거가 너무 커 무시될 수 없다는 것이다. 결국 증거의 무게는 체미오스테틱 가설을 지지하기 시작했고, 1978년 피터 미첼은 노벨 화학상을 받았다.[3]
체모스모틱 결합은 미토콘드리아, 엽록체[4], 그리고 많은 박테리아와 고고학에서 ATP 생산에 중요하다.[5]
원동기력
멤브레인 전체에서 이온의 이동은 다음 두 가지 요인의 조합에 따라 달라진다.
- 농도 구배에서 발생하는 확산력 - 모든 입자는 높은 농도로부터 낮은 농도로 확산되는 경향이 있다.
- 전기적 전위 구배에 의해 야기되는 정전력 - 양성자+ H와 같은 양이 전위를 막의 양극(P) 쪽에서 음극(N) 쪽으로 확산시키는 경향이 있다. 음이온은 반대 방향으로 자연적으로 확산된다.
이 두 가지 구배는 전기화학 구배라고 표현할 수 있다.
그러나 생물막의 지질 빌리어는 이온의 장벽이다. 이 때문에 에너지가 막을 가로지르는 이 두 구배의 조합으로 저장될 수 있는 것이다. 이온 채널과 같은 특수한 막 단백질만이 이온이 막 사이를 이동할 수 있도록 허용할 수 있다(또한: 멤브레인 운반). 체미오스 이론에서 transmbrane ATP synthases는 매우 중요하다. 그들은 그들을 통해 양성자의 자발적 흐름의 에너지를 ATP 결합의 화학적 에너지로 전환한다.
따라서 연구원들은 앞에서 언급한 전기화학 구배에서 파생된 양성자-기전력(PMF)이라는 용어를 만들었다. 막 전체에 걸쳐 양성자와 전압(전위) 구배의 조합으로 저장되는 전위 에너지의 척도로 설명할 수 있다. 전기 구배는 막에 걸친 전하 분리의 결과(양자 H가+ 염화물 Cl과− 같은 반작용 없이 이동하는 경우)이다.
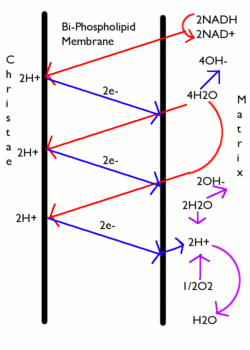
대부분의 경우 양성자 기력은 양성자 펌프 역할을 하는 전자 운송 체인에 의해 생성되며, 리독스 반응의 깁스 자유 에너지를 사용하여 양자를 펌핑하여 멤브레인 전체에 걸쳐 전하를 분리한다. 미토콘드리아에서는 전자전달체인에 의해 방출되는 에너지가 미토콘드리아 매트릭스(N측)에서 인터엠브레인 공간(P측)으로 양자를 이동시키는 데 사용된다. 양성자를 미토콘드리온 밖으로 이동시키면 그 안에서 양전하 양성자의 농도가 낮아져 막 내부에 과도한 음전하가 발생한다. 전위 구배는 약 -170 mV , 내부 (N)이다. 이러한 구배 - 전하 차이와 양성자 농도 차이는 모두 막 전체에 걸쳐 결합된 전기화학 구배를 생성하며, 종종 양성자-기전력(PMF)으로 표현된다. 미토콘드리아에서 PMF는 거의 전적으로 전기부품으로 구성되지만 엽록체에서 PMF는 양성자 H의+ 전하가 Cl과− 다른 음이온의 움직임에 의해 중화되기 때문에 대부분 pH 구배로 구성된다. 어느 경우든 ATP 싱타제가 ATP를 만들 수 있으려면 PMF가 약 460mV(45kJ/mol) 이상이어야 한다.
방정식
양성자 기력은 기브스 자유 에너지에서 나온다. N은 세포의 내부를 나타내고, P는 세포의 외부를 나타낸다. 그러면[6]
어디에
- 은(는) P에서 N으로 전송되는 양이온 단위량당 Gibbs 자유 에너지 변화량이다.
- 은(는) 양이온 z+ 의 충전 번호 입니다
- 은(는) P에 상대적인 N의 전위다.
- 및[ + 은(는) 각각 P와 N의 양이온 농도다.
- 은(는) 패러데이 상수임.
- 은(는) 기체 상수 및
- 은(는) 온도다.
어금니 Gibbs 자유 에너지 변화 G 은(는) 어금니 전기화학 이온전위 z+ =
전기화학 양성자 그라데이션 = 의 경우 다음과 같이 하십시오.
어디에
- H= - P{\\!\ =\
미첼은 양성자-기전력(PMF)을 다음과 같이 정의했다.
- = - + F
For example, implies . At this equation takes the form:
\!\
P측에서 N측으로 자발적 양성자 가져오기(상대적으로 더 양적이고 산성이 더 많음)의 경우 + 는 음수( G 와 유사함!)과 반대로 PMF는 양수(redox cell probled E{\ E과)이다.
다른 투과형 운송 프로세스와 마찬가지로 PMF는 방향성이 있다는 점에 주목할 필요가 있다. Δ{\displaystyle } 전송 전위차 {\ \Delta \!\psi 의 부호는 위와 같이 셀로 유입되는 단위 전하당 전위 에너지의 변화를 나타내기 위해 선택된다. 더욱이 연결 부위에 의한 리독스 구동 양성자 펌핑으로 인해 양성자 구배는 항상 내부 알칼린이다. 이러한 두 가지 이유 때문에 양자는 P측에서 N측으로 자연적으로 흐른다. 사용 가능한 자유 에너지는 ATP를 합성하는데 사용된다(아래 참조). 이러한 이유로 PMF는 양성자 수입에 대해 정의되는데, 이것은 자발적인 것이다. 양성자 수출을 위한 PMF, 즉 연결 부위에서 촉매로 작용하는 양성자 펌핑은 단순히 PMF(수입)의 음수일 뿐이다.
양성자 수입(P에서 N쪽으로)의 자발성은 모든 바이오에너제틱 막에서 보편적이다.[8] 이러한 사실은 1990년대 이전에는 인정되지 않았는데, 이는 엽록체 틸라코이드 루멘이 내부 단계로 해석되었기 때문이다. 그러나 사실 그것은 국소학적으로 엽록체 외관과 동등하다. 아조네 외 연구진은 내부 위상(막의 N측)은 세균성 세포질, 미토콘드리아 기질 또는 엽록체 스트로마, 외부(P) 쪽은 세균성 세포질 공간, 미토콘드리아 간 공간 또는 엽록체 루멘이라고 강조했다. 게다가, 미토콘드리아 내막의 3D 단층촬영은 태일라코이드 디스크와 유사하게 쌓여야 하는 광범위한 침입을 보여준다. 따라서 미토콘드리아 간 공간은 국소적으로 엽록체 루멘과 상당히 유사하다.:[9]
여기에서 기브스 자유 에너지, 전기화학 양성자 구배 또는 양성자 기전력(PMF)으로 표현되는 에너지는 막 전체에 걸쳐 다음과 같은 두 가지 구배 조합이다.
- 농도 구배( 및
- 전위 경사로 Δ .
시스템이 평형에 도달했을 때 = {\\!\ 그럼에도 불구하고 멤브레인 양쪽의 농도가 같을 필요는 없다. 전위 막에 걸친 자발적 움직임은 농도와 전기적 전위 구배 둘 다에 의해 결정된다.
어금니 깁스 자유 에너지 ATP 합성
인산화 전위라고도 불린다. 평형농도비[+ /[ T { p 과 예를 들어 포유류 미토콘드리온의 경우:[9]
H+ / ATP = ΔGp / (Δp / 10.4 kJ·mol−1/mV) = 40.2 kJ·mol−1 / (173.5 mV / 10.4 kJ·mol−1/mV) = 40.2 / 16.7 = 2.4. ATP-synchrising 베타 서브 유닛 번호에 대한 양성자 결합 c-부품의 실제 비율은 8/3 = 2.67이며, 이러한 조건에서 미토콘드리온은 90%(2.4/2.67)의 효율로 기능한다는 것을 보여준다.[9]
실제로 진핵세포에서는 열역학적 효율이 대부분 낮은데, 이는 ATP를 매트릭스에서 세포질로 수출해야 하고, ADP와 인산염은 세포질에서 수입해야 하기 때문이다. 이 "비용"은 ATP당 하나의 "추가" 양성자 수입이므로 [6][7]실제 효율은 65%(= 2.4/3.67)에 불과하다.
미토콘드리아에서
산소의 에너지를 방출하는 포도당의 완전한 붕괴를 세포호흡이라고 한다. 이 과정의 마지막 단계는 미토콘드리아에서 일어난다. 감소된 분자 NADH와 FADH는2 크렙스 사이클, 글리콜리시스, 피루바이트 가공에 의해 생성된다. 이 분자들은 전자를 전자 운반 체인으로 전달하는데, 이것은 산소의 에너지를 방출하여 내측 미토콘드리아 막을 가로질러 양성자 구배를 생성한다. 그런 다음 ATP 동기화효소는 이 경사로에 저장된 에너지를 사용하여 ATP를 만든다. 이 과정은 NADH와 FADH가2 ATP로 인산염 ADP를 산화시켜 방출하는 에너지를 사용하기 때문에 산화인산화라고 불린다.
식물에서
광합성의 빛 반응은 체미오스의 작용에 의해 ATP를 생성한다. 햇빛 속의 광자는 더 높은 에너지 수준으로 전자를 흥분시키는 포토시스템 II의 안테나 콤플렉스에 의해 수신된다. 이 전자들은 전자 전송 사슬을 따라 이동하며, 양자가 태일라코이드 막을 가로질러 태일라코이드 루멘으로 활발하게 펌프되도록 한다. 그런 다음 이 양성자들은 ATP-신타아제라는 효소를 통해 전기화학적 전위 구배를 내려가 ADP에 ATP를 인산화하여 ATP를 생성한다. 초기 광 반응에서 나온 전자는 포토시스템 I에 도달한 다음, 광에너지에 의해 더 높은 에너지 레벨로 상승되고 전자 수용기에 의해 수신되어 NADPH를+ NADPH로 감소시킨다. 포토시스템 II에서 손실된 전자는 물의 산화작용에 의해 대체되는데, 이것은 산소를 진화하는 복합체(OEC, WOC 또는 수산화 복합체라고도 한다)에 의해 양자와 산소로 "분할"된다. 1개의이원자 산소를 생성하기 위해서는 10개의 광자가 포토시스템 I과 II에 의해 흡수되어야 하고, 2개의 광시스템을 통해 4개의전자가 이동해야 하며, 2개의 NADPH가 생성되어야 한다(캘빈 Cycle의 고정에 더 많이 사용된다 이산화탄소).
원핵생물에서
박테리아와 고고학은 또한 ATP를 생성하기 위해 체미오스미오스를 사용할 수 있다. 시아노박테리아, 녹황세균, 자주색세균은 광인산화라는 공정에 의해 ATP를 합성한다. 이 박테리아는 광합성 전자 운송 체인을 사용하여 양성자 구배를 만들기 위해 빛의 에너지를 사용한다. 대장균과 같은 비포토합성 박테리아에도 ATP 싱타아제가 함유되어 있다. 사실, 미토콘드리아와 엽록체들은 내분비증의 산물이고 통합된 원핵생물로 거슬러 올라간다. 이 과정은 내분비생물학 이론에 설명되어 있다. 미토콘드리온의 기원은 진핵생물의 기원을 촉발시켰고, 플라스티드의 기원은 진핵생물의 주요 진원지 중 하나인 아르케아플라스티다의 기원을 촉발시켰다.
체미오스모테틱 인산염은 무기인산염과 ADP 분자로부터 ATP를 생산하는 세 번째 통로다. 이 과정은 산화 인산화 작용의 일부분이다.
참고 항목
참조
- ^ Peter Mitchell (1961). "Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism". Nature. 191 (4784): 144–148. Bibcode:1961Natur.191..144M. doi:10.1038/191144a0. PMID 13771349. S2CID 1784050.
- ^ Alberts, Bruce; Alexander Johnson; Julian Lewis; Martin Raff; Keith Roberts; Peter Walter (2002). "Proton Gradients Produce Most of the Cell's ATP". Molecular Biology of the Cell. Garland. ISBN 0-8153-4072-9.
- ^ 1978년 노벨 화학상.
- ^ Cooper, Geoffrey M. (2000). "Figure 10.22: Electron transport and ATP synthesis during photosynthesis". The Cell: A Molecular Approach (2nd ed.). Sinauer Associates, Inc. ISBN 0-87893-119-8.
- ^ Alberts, Bruce; Alexander Johnson; Julian Lewis; Martin Raff; Keith Roberts; Peter Walter (2002). "Figure 14-32: The importance of H+-driven transport in bacteria". Molecular Biology of the Cell. Garland. ISBN 0-8153-4072-9.
- ^ a b c d e f Nicholls D. G.; Ferguson S. J. (1992). Bioenergetics 2 (2nd ed.). San Diego: Academic Press. ISBN 9780125181242.
- ^ a b c Stryer, Lubert (1995). Biochemistry (fourth ed.). New York - Basingstoke: W. H. Freeman and Company. ISBN 978-0716720096.
- ^ Azzone, Giovanni; et al. (1993). "Transmembrane Measurements Across Bioenergetic Membranes". Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1183 (1): 1–3. doi:10.1016/0005-2728(93)90002-W.
- ^ a b c Silverstein, Todd (2014). "An exploration of how the thermodynamic efficiency of bioenergetic membrane systems varies with c-subunit stoichiometry of F1F0 ATP synthases". Journal of Bioenergetics and Biomembranes. 46 (3): 229–241. doi:10.1007/s10863-014-9547-y. PMID 24706236. S2CID 1840860.
추가 읽기
- NCBI 책꽂이의 생화학 교과서 참고문헌 –
- 기술 참조 실험을 세지야 오가와 및 –은 화학적 침투압의 이론의 어떤 교의를 테스트하는 것을 목표로 하고의 한 집합에 대한 관련이 있는 계층 호. 밍 리씨(1984년)."내부 Phosphorylation 잠재력과 그 양성자 동인 포스 미토콘드리아에서 ATP의와 가수 분해 동안 그 관계".필기장 생물학 화학의. 259(16):10004–10011.PMID 6469951.

![{\displaystyle \Delta \!G=zF\Delta \!\psi +RT\ln {\frac {[\mathrm {X} ^{z+}]_{\text{N}}}{[\mathrm {X} ^{z+}]_{\text{P}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e49984fb465bfe70fdf147d5c94b4691fde30b93)
 (는) P에서 N으로 전송되는
(는) P에서 N으로 전송되는 

 (는) P에 상대적인 N의 전위다.
(는) P에 상대적인 N의 전위다.![{\displaystyle [\mathrm {X} ^{z+}]_{\text{P}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b04667620cf542631c6a2a692aefd89310230ddd)
![{\displaystyle [\mathrm {X} ^{z+}]_{\text{N}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f4da81b44fd243b0610ca90f2a571ffe2891ad71)
 (는)
(는)  (는)
(는)  .
.
 경우 다음과 같이 하십시오.
경우 다음과 같이 하십시오. ![{\displaystyle \Delta \!\mu _{\mathrm {H} ^{+}}=F\Delta \!\psi +RT\ln {\frac {[\mathrm {H} ^{+}]_{\text{N}}}{[\mathrm {H} ^{+}]_{\text{P}}}}=F\Delta \!\psi -(\ln 10)RT\Delta \mathrm {pH} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9401e1568170355be3a960a583f16f2d93c5a842)













![{\displaystyle [\mathrm {H} ^{+}]/[\mathrm {ATP} ]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0e253bb9b194bd7dd88012ff9e7acd912dbf6931)