SCF복합체
SCF complex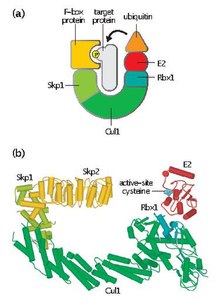
Skp, Cullin, 복합체(또는 SCF 복합체)가 포함된 F-box는 다단백질 E3 유비퀴틴 리기타제 복합체로 26S 단백질 분해로 향하는 단백질의 편재화를 촉진한다.[1]아나파제 촉진 복합체와 함께,[2] SCF는 세포 주기에 관여하는 단백질의 편재화에 중요한 역할을 한다.SCF 복합체에는 파괴를 위한 다양한 세포단백질도 표시된다.[3]
핵심 구성 요소
SCF에는 가변 F-box 단백질과 세 가지 핵심 하위 단위가 포함되어 있다.
- F-box 단백질(FBP) – FBP는 먼저 복합체와는 독립적으로 대상 단백질을 취합하여 SCF 복합체의 기질특성에 기여한다.각 FBP(예: Skp2)는 인산염이나 글리코실레이션과 같은 변환 후 변경에 의존하는 방식으로 여러 다른 기판을 인식할 수 있다.그런 다음 FBP는 F-box 모티브를 사용하여 SCF 복합체의 Skp1에 결합하여 대상 단백질을 기능성 E2 유비퀴틴-콘주게팅 효소와 근접하게 한다.또한 FBP는 세포 주기 동안 SCF 활동을 규제하는데 필수적이다.SCF 수준은 셀 사이클 내내 일정하게 유지되는 것으로 생각된다.그 대신 단백질 기질에 대한 FBP 친화력은 표적 단백질의 사이클린-CDK 매개 인산화를 통해 조절된다.[4]
- Skp1 – Skp1은 F-box 단백질의 인식과 결합에 필수적인 어댑터 단백질이다.
- Cullin (COUL1) – Cullin은 SCF 단지의 주요 구조 비계를 형성하고 skp1 도메인을 Rbx1 도메인과 연결한다.컬린과 FBP의 다른 조합은 서로 다른 기질들을 대상으로 하는 100종의 E3 유비퀴틴 연대의 순서로 생성될 수 있다.[5]
- RBX1 – Rbx1은 E2 유비퀴틴-콘주깅 효소가 결합하는 작은 아연 결합 진짜 흥미로운 새로운 유전자(RING) 핑거 도메인을 포함한다.이 결합 이벤트는 대상 단백질에 있는 리신 잔류물로 E2의 유비퀴틴을 전이할 수 있다.
디스커버리
SCF 콤플렉스의 발견으로 이어진 첫 번째 암시는 싹트기 효모라고도 알려진 사카로마이오스 세레비시아이의 유전자 화면에서 나왔다.Cdc4, Cdc34, Cdc53과[6] 같은 온도에 민감한 세포분할 주기(Cdc) 돌연변이는 복제되지 않은 DNA와 복수의 길쭉한 싹으로 G1에서 체포되었다.[7]이 표현형은 S 사이클린-CDK 콤플렉스의 억제제인 Sic1을 저하시키지 못한 데 기인했다.[6]이러한 결과는 프로테롤리시스가 G1/S 전환에서 중요하다는 것을 보여주었다.
다음으로, 생화학적 연구는 Cdc34가 Skp1, Cdc4, 그리고 몇몇 다른 단백질을 포함하는 E3 유비퀴틴 리가아제 복합체와 물리적으로 상호작용하는 E2 효소라는 것을 밝혀냈다.[6]특히 SKp2, Cyclin F, Cdc4 등 SKp1의 알려진 바인딩 파트너들은 F-box 모티브를 만든 40여 개의 잔여 모티브를 공유하고 있는 것으로 밝혀졌다.이러한 발견에 이은 F-box 가설은[8] F-box 단백질이 분해 대상 기판을 모집하고, skp1은 F-box 단백질을 핵심 유비쿼터스 복합체와 연결한다는 것을 제시했다.
선충에 대한 후속 유전 연구는 후에 다른 SCF 복합 구성요소의 용해화에 기여했다.[8]
세포주기조절
진핵 세포 주기는[9] 규제 단백질의 합성, 분해, 결합 상호작용, 변환 후 수정을 통해 조절된다.이러한 규제 단백질 중 세포 주기 체크포인트를 통한 진행을 위해서는 2개의 유비퀴틴 리깅이 필수적이다.아나파제 추진 콤플렉스(APC)는 메타파제-아나파제 전환을, SCF 콤플렉스는 G1/S와 G2/M 전환을 제어한다.특히, SCF는 늦은 텔로파제로부터 G1/S 전환까지의 중심분리를 규제하는 것으로 나타났다.[1]
SCF 활동은 주로 변환 후 변경에 의해 규제된다.예를 들어, 유비퀴틴 매개 FBP의 자기 분석적 성능 저하는 SCF 활동을 감소시키는 메커니즘이다.
SCF 콤플렉스의 적절한 특성화된 셀 주기 기판은 다음을 포함한다.
- 사이클린 계열 단백질:사이클린 D, 사이클린[2] E
- 전사 규제 기관:마이크, E2f1, p130[2]
- 사이클린 의존성 키나아제 억제제(CKI): p27Kip1, p21, Wee1[2]
- 중심 단백질:세페250, 나인인[1]
인간 FBP는 약 70개가 있으며, 그 중 몇 개는 SCF 복합체의 구성요소로서 세포 주기 제어에 관여한다.[10]
skp2는 p27Kip1, p21 등 CKI를 묶는 FBP이다.[11]skp2는 p27이Kip1 E/A/CKD2에 의해 인산화되어 Cks1에 바인딩되는 두 가지 조건을 만족해야 p27을Kip1 바인딩한다.Skp2를 결합한 결과, p27은Kip1 유비쿼터스화되며 G1 후반에 분해의 대상이 되며 초기 S.[4] SCF-Skp2 또한 인산화 의존적인 방식으로 분해의 p130을 목표로 한다.
베타-트랜듀신 반복함유 단백질(βTRCP)은 초기 유사분열 시 emi1(APC/C-Cdh1 억제제)과 wee1을 대상으로 하는 FBP이다.[2]βTRCP는 이러한 기질들이 폴로 유사 키나아제 1 또는 사이클린 B-CDK1에 의해 인산염화된 후에 기질을 인식한다.
효모에 함유된 cdc4의 인간 호몰로그인 Fbw7은 키클린 E, 마이크, 노치, c준을 대상으로 한 FBP이다.[4]fbw7은 세포주기 전반에[12] 걸쳐 안정적이며 핵 국산화순서(NLS)가 존재하기 때문에 핵에 국부화된다.[13]SCF-Fbw7은 Sic1(가능 사이트 9개 중 최소 6개가 인산염일 때)과 Swi5를 분해 대상으로 한다.[14]Sic1은 일반적으로 Cyclin B-CDK1을 억제하여 S상으로의 조기 진입을 방지하므로, Sic1의 열화를 목표로 하는 것은 S상 진입을 촉진한다.fbw7은 산발적인 여러 발암물질에 관여하는 happlo-inciple 종양 억제기 유전자로 알려져 있는데, 이 유전자는 돌연변이 알레르기가 야생형 표현형을 교란하기에 충분하다.[15]
Fbxo4는 인간암에 관여해 온 또 다른 종양 억제제 FBP이다.SCF-fbxo4는 셀 사이클 제어에서 사이클린 D1의 성능 저하를 목표로 하는 역할을 한다.[4]
사이클린 F는 근위축성 측경화증(ALS)과 전측두엽 치매(FTD)와 관련된 FBP이다.[16][17]사이클린 F의 인산화 방지를 위한 돌연변이는 SCF-사이클로린 F의 활동을 변화시키며, 이는 ALS와 FTD의 뉴런 퇴화와 관련된 다운스트림 과정에 영향을 줄 가능성이 있다.[17]일반적으로 사이클린 F는 열화를 위해 E2f1을 목표로 한다.
암
최근 SCF 단지들은 일부 인간 암에 대한 규제 강화와 생화학적으로 구별되는 활성 사이트 때문에 매력적인 항암 목표가 되고 있다.[18]앞서 언급한 많은 FBP들이 암에 연루되었지만, 세포독성은 약물 개발의 제한적인 요소였다.[19]
skp2 표적 항센스 올리고뉴클레오티드와 siRNA가 마약 개발 파이프라인에 있다.예비 연구에서는 skp2 하향조정이 멜라노마, 폐암세포, 구강암세포, 교모세포의 성장을 억제할 수 있다는 것을 밝혀냈다.[19]
βTRCP 표적형 siRNA는 기존 화학요법에 유방암 세포와 자궁경부암 세포를 감작하는 것으로 나타났다.[19]
식물호르몬신호
식물 호르몬 아우신은 Tir1을 결합시킨다.Tir1은 AFB(Auxin Signating F-box 단백질)로, AFB로, Auxin 수용체 역할을 한다.Auxin-bound Tir1은 AUX/IAA 억제기에 SCF-Tir1의 바인딩을 자극한다.이후 억제기의 분해로 AUX/IAA(즉, 보조 반응) 유전자가 활성화된다.[20]
식물 호르몬인 자스모나테는 FBP인 Coi1을 결합시킨다.그런 다음 SCF-Coi1은 JAZ 전사 계수를 바인딩하고 성능 저하를 목표로 한다.JAZ 전사 인자의 분해는 자스몬테이트 반응 유전자의 전사를 가능하게 한다.[21]
참조
- ^ a b c Ou, Young; Rattner, J.B. (2004), "The Centrosome in Higher Organisms: Structure, Composition, and Duplication", International Review of Cytology, Elsevier, 238: 119–182, doi:10.1016/s0074-7696(04)38003-4, ISBN 978-0-12-364642-2, PMID 15364198
- ^ a b c d e Fischer, Martin; Dang, Chi V.; DeCaprio, James A. (2018), "Control of Cell Division", Hematology, Elsevier, pp. 176–185, doi:10.1016/b978-0-323-35762-3.00017-2, ISBN 978-0-323-35762-3
- ^ Morgan, David "Cell-Cycle Control의 단백질 분해", The Cell Cycle; Control의 원리 2007
- ^ a b c d The Molecular Basis of Cancer. Elsevier. 2008. doi:10.1016/b978-1-4160-3703-3.x5001-7. ISBN 978-1-4160-3703-3.
- ^ Hegde, Ashok N. (2010), "Ubiquitin-Dependent Protein Degradation", Comprehensive Natural Products II, Elsevier, pp. 699–752, doi:10.1016/b978-008045382-8.00697-3, ISBN 978-0-08-045382-8, retrieved 2019-12-01
- ^ a b c Patton, E (1998-06-01). "Combinatorial control in ubiquitin-dependent proteolysis: don't Skp the F-box hypothesis". Trends in Genetics. 14 (6): 236–243. doi:10.1016/s0168-9525(98)01473-5. ISSN 0168-9525. PMID 9635407.
- ^ Schwob, E (1994-10-21). "The B-type cyclin kinase inhibitor p40SIC1 controls the G1 to S transition in S. cerevisiae". Cell. 79 (2): 233–244. doi:10.1016/0092-8674(94)90193-7. ISSN 0092-8674. PMID 7954792. S2CID 34939988.
- ^ a b Willems, Andrew R.; Schwab, Michael; Tyers, Mike (November 2004). "A hitchhiker's guide to the cullin ubiquitin ligases: SCF and its kin". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1695 (1–3): 133–170. doi:10.1016/j.bbamcr.2004.09.027. ISSN 0167-4889. PMID 15571813.
- ^ Vodermaier, Hartmut C. (September 2004). "APC/C and SCF: Controlling Each Other and the Cell Cycle". Current Biology. 14 (18): R787–R796. doi:10.1016/j.cub.2004.09.020. ISSN 0960-9822. PMID 15380093.
- ^ Lambrus, Bramwell G.; Moyer, Tyler C.; Holland, Andrew J. (2017-08-31). "Applying the auxin-inducible degradation (AID) system for rapid protein depletion in mammalian cells". doi:10.1101/182840.
{{cite journal}}:Cite 저널은 필요로 한다.journal=(도움말) - ^ Frescas, David; Pagano, Michele (June 2008). "Deregulated proteolysis by the F-box proteins SKP2 and β-TrCP: tipping the scales of cancer". Nature Reviews Cancer. 8 (6): 438–449. doi:10.1038/nrc2396. ISSN 1474-175X. PMC 2711846. PMID 18500245.
- ^ Mathias, Neal; Steussy, C. Nic; Goebl, Mark G. (1998-02-13). "An Essential Domain within Cdc34p Is Required for Binding to a Complex Containing Cdc4p and Cdc53p inSaccharomyces cerevisiae". Journal of Biological Chemistry. 273 (7): 4040–4045. doi:10.1074/jbc.273.7.4040. ISSN 0021-9258. PMID 9461595.
- ^ Blondel, M. (2000-11-15). "Nuclear-specific degradation of Far1 is controlled by the localization of the F-box protein Cdc4". The EMBO Journal. 19 (22): 6085–6097. doi:10.1093/emboj/19.22.6085. ISSN 1460-2075. PMC 305831. PMID 11080155.
- ^ Kishi, T.; Ikeda, A.; Koyama, N.; Fukada, J.; Nagao, R. (2008-09-11). "A refined two-hybrid system reveals that SCFCdc4-dependent degradation of Swi5 contributes to the regulatory mechanism of S-phase entry". Proceedings of the National Academy of Sciences. 105 (38): 14497–14502. Bibcode:2008PNAS..10514497K. doi:10.1073/pnas.0806253105. ISSN 0027-8424. PMC 2567208. PMID 18787112.
- ^ Calhoun, Eric S.; Jones, Jessa B.; Ashfaq, Raheela; Adsay, Volkan; Baker, Suzanne J.; Valentine, Virginia; Hempen, Paula M.; Hilgers, Werner; Yeo, Charles J.; Hruban, Ralph H.; Kern, Scott E. (October 2003). "BRAF and FBXW7 (CDC4, FBW7, AGO, SEL10) Mutations in Distinct Subsets of Pancreatic Cancer". The American Journal of Pathology. 163 (4): 1255–1260. doi:10.1016/s0002-9440(10)63485-2. ISSN 0002-9440. PMC 1868306. PMID 14507635.
- ^ Yu, Yujiao; Nakagawa, Tadashi; Morohoshi, Akane; Nakagawa, Makiko; Ishida, Noriko; Suzuki, Naoki; Aoki, Masashi; Nakayama, Keiko (2019-09-30). "Pathogenic mutations in the ALS gene CCNF cause cytoplasmic mislocalization of Cyclin F and elevated VCP ATPase activity". Human Molecular Genetics. 28 (20): 3486–3497. doi:10.1093/hmg/ddz119. ISSN 0964-6906. PMID 31577344.
- ^ a b Lee, Albert; Rayner, Stephanie L.; De Luca, Alana; Gwee, Serene S. L.; Morsch, Marco; Sundaramoorthy, Vinod; Shahheydari, Hamideh; Ragagnin, Audrey; Shi, Bingyang; Yang, Shu; Williams, Kelly L. (October 2017). "Casein kinase II phosphorylation of cyclin F at serine 621 regulates the Lys48-ubiquitylation E3 ligase activity of the SCF (cyclin F) complex". Open Biology. 7 (10): 170058. doi:10.1098/rsob.170058. ISSN 2046-2441. PMC 5666078. PMID 29021214.
- ^ Skaar, Jeffrey R.; Pagan, Julia K.; Pagano, Michele (December 2014). "SCF ubiquitin ligase-targeted therapies". Nature Reviews Drug Discovery. 13 (12): 889–903. doi:10.1038/nrd4432. ISSN 1474-1776. PMC 4410837. PMID 25394868.
- ^ a b c Sun, L. Jia and Y. (2011-02-28). "SCF E3 Ubiquitin Ligases as Anticancer Targets". Current Cancer Drug Targets. 11 (3): 347–356. doi:10.2174/156800911794519734. PMC 3323109. PMID 21247385.
- ^ Dharmasiri, Nihal; Dharmasiri, Sunethra; Estelle, Mark (May 2005). "The F-box protein TIR1 is an auxin receptor". Nature. 435 (7041): 441–445. Bibcode:2005Natur.435..441D. doi:10.1038/nature03543. ISSN 0028-0836. PMID 15917797. S2CID 4428049.
- ^ Devoto, Alessandra; Nieto-Rostro, Manuela; Xie, Daoxin; Ellis, Christine; Harmston, Rebecca; Patrick, Elaine; Davis, Jackie; Sherratt, Leigh; Coleman, Mark; Turner, John G. (November 2002). "COI1 links jasmonate signalling and fertility to the SCF ubiquitin-ligase complex inArabidopsis". The Plant Journal. 32 (4): 457–466. doi:10.1046/j.1365-313x.2002.01432.x. ISSN 0960-7412. PMID 12445118.




