고체산소
Solid oxygen고체 산소는 54.36K(-218.79°C, -361.82°F) 미만의 온도에서 정상 대기압에서 형성된다. 고체산소2 O는 액체산소와 마찬가지로 가시광선 스펙트럼의 적색 부분에 흡수가 일어나 하늘색이 옅은 투명한 물질이다.
산소 분자는 분자 자기화와 결정 구조, 전자 구조, 초전도성의 관계 때문에 관심을 끌었다. 산소는 자기 모멘트를 운반하는 유일한 단순한 이원자 분자(그리고 일반적으로 몇 안 되는 분자 중 하나)이다.[1] 이것은 저온 단계에서 반자성 자기 순서를 표시하는 "스핀 제어" 결정으로[1] 여겨지기 때문에, 고형 산소를 특히 흥미롭게 만든다. 산소의 자기 성질은 광범위하게 연구되어 왔다.[2] 매우 높은 압력에서는 고체 산소가 절연 상태에서 금속 상태로 변화하고,[3] 매우 낮은 온도에서는 초전도 상태로 변한다.[4] 고형산소에 대한 구조적 조사는 1920년대에 시작되었고 현재 6개의 뚜렷한 결정학적 단계가 뚜렷이 확립되어 있다.
고체산소의 밀도는 α상에서는 21 cm3/mol, α상에서는 23.5 cm3/mol이다.[5]
단계

고체 산소의 6가지 상이 존재하는 것으로 알려져 있다.[1][6]
- α 위상: 연한 청색 – 23.8K 이하인 1 atm에서 형성된다.
- β-위상: 옅은 청색에서 분홍색까지 – 1 atm에서 43.8 K 이하, 회전 결정 구조에서 형성된다(상온과 고압에서 4차산화겐으로 변환하기 시작한다).
- γ상: 옅은 청색 – 1 atm에서 54.36 K 이하의 입방 결정 구조에서 형성된다.
- Δ 위상: 오렌지 – 9 GPA의 압력에서 상온에서 형성됨
- ε상: 적색에서 흑색까지 – 10 GPA 이상의 압력에서 상온에서 형성됨
- ζ상: 금속 – 96 GPA 이상의 압력에서 형태 형성
산소는 압력을 가하여 상온에서 β상(β-phase)이라는 상태로 굳어지고, 압력이 더욱 증가함에 따라 β-상은 9 GPA에서 Δ-상으로, β-상은 10 GPA에서 Δ-상으로의 위상 전환을 거치게 되며, 분자 상호작용의 증가로 β-상의 색상은 핑크, 오렌지, t로 변하는 것으로 알려져 있다.암탉 빨강(안정적인 옥타옥시겐 단계), 그리고 붉은 색은 압력이 증가하면서 검은 색으로 더욱 어두워진다. ε상 산소를 추가로 압축하면 96 GPA에서 금속성 ζ상(Metrical ζ-phase)이 나타나는 것으로 조사되었다.[6]
적산소
상온에서 산소 압력이 10기가파스칼(150만psi)을 통해 높아지면서 극적인 위상 전환을 거친다. 부피가 크게[7] 줄고 하늘색에서 진한 붉은색으로 색이 바뀐다.[8] 그러나 이것은 단순히 O의2 결정 단계만 다른 것이 아니라 다른 산소 할당 단계인
8 O이다.
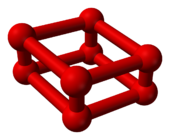 |  |
| O의8 볼앤스틱 모델 | ε-oxygen 결정구조의 일부 |
금속산소
ζ상 산소가 추가로 압축되면 96 GPA에서 ζ상계가 나타난다.[7] 이 단계는 산소를 132 GPA로 가압하여 1990년에 발견되었다.[3] 금속 클러스터가[9] 있는 ζ 상은 100 GPA 이상의 압력과 0.6 K 이하의 온도에서 초전도성을 보인다.[4][6]
참조
- ^ a b c Freiman, Y. A. & Jodl, H. J. (2004). "Solid oxygen". Physics Reports. 401 (1–4): 1–228. Bibcode:2004PhR...401....1F. doi:10.1016/j.physrep.2004.06.002.
- ^ 참고 항목: 고체 산소의 자성을 다루는 논문에 대해서는 R.J. 마이어, C.J. 쉰켈, A. 드 비서, J. 체육에 의한 고압 및 강한 자기장에서의 응축 산소의 자성을 참조한다. C15 (1982) 1015–1024, 마이어 R J, 콜파 J H P, 시그 H 1984 J. 물리에서의 자기 배설이나 스핀파를 다루는 원적외선 흡수. C: 고체 상태 물리적. 17 4501.
- ^ a b Desgreniers, S., Vohra, Y. K. & Ruoff, A. L. (1990). "Optical response of very high density solid oxygen to 132 GPa". The Journal of Physical Chemistry. 94 (3): 1117–1122. doi:10.1021/j100366a020.CS1 maint: 여러 이름: 작성자 목록(링크)
- ^ a b Shimizu, K., Suhara, K., Ikumo, M., Eremets, M. I. & Amaya, K. (1998). "Superconductivity in oxygen". Nature. 393 (6687): 767–769. Bibcode:1998Natur.393..767S. doi:10.1038/31656. S2CID 205001394.CS1 maint: 여러 이름: 작성자 목록(링크)
- ^ Roder, H. M. (1978). "The molar volume (density) of solid oxygen in equilibrium with vapor". Journal of Physical and Chemical Reference Data. 7 (3): 949–958. Bibcode:1978JPCRD...7..949R. doi:10.1063/1.555582.
- ^ a b c Advanced Industrial Science and Technology (AIST) (2006). "Solid Oxygen ε-Phase Crystal Structure Determined Along With The Discovery of a Red Oxygen O8 Cluster". AZoNano. Retrieved 2008-01-10.
- ^ a b Akahama, Yuichi; Haruki Kawamura; Daniel Häusermann; Michael Hanfland; Osamu Shimomura (June 1995). "New High-Pressure Structural Transition of Oxygen at 96 GPa Associated with Metallization in a Molecular Solid". Physical Review Letters. 74 (23): 4690–4694. Bibcode:1995PhRvL..74.4690A. doi:10.1103/PhysRevLett.74.4690. PMID 10058574.
- ^ Nicol, Malcolm; K. R. Hirsch; Wilfried B. Holzapfel (December 1979). "Oxygen Phase Equilibria near 298 K". Chemical Physics Letters. 68 (1): 49–52. Bibcode:1979CPL....68...49N. doi:10.1016/0009-2614(79)80066-4.
- ^ Peter P. Edwards; Friedrich Hensel (2002-01-14). "Metallic Oxygen". ChemPhysChem. Weinheim, Germany: WILEY-VCH-Verlag. 3 (1): 53–56. doi:10.1002/1439-7641(20020118)3:1<53::AID-CPHC53>3.0.CO;2-2. PMID 12465476.


