소미토제네시스
Somitogenesis| 소미토제네시스 | |
|---|---|
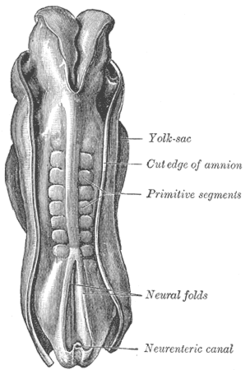 인간 배아의 등심, 길이 2.11mm. (구형 원시 분절은 소미토젠스(somitogenesis)에서 형성되는 소미트(somite)를 식별하는 데 사용된다.) | |
| 세부 사항 | |
| 전구체 | 근축중추 |
| 낳다 | 피부과, 묘약, 신디토메, 스클러토메 |
| 해부학적 용어 | |
소미토제네시스는 소미트가 형성되는 과정이다. 소마이트는 양방향으로 짝을 이룬 근축 중격막으로 분절된 동물에서 발달하는 배아의 전축과 후축을 따라 형성된다. 척추동물의 경우, 솜이끼는 골격근, 연골, 힘줄, 내피, 진피를 발생시킨다.
개요
소미토젠시에서는 소미테가 신경세포 배아에서 중간의 특정 영역인 근축중간에서 형성된다. 이 조직은 원시적인 줄무늬가 퇴행할 때 또는 배아가 미식할 때 수렴 확장을 거친다. 노토코드는 머리 밑부분에서 꼬리까지 뻗어 있으며, 두껍게 늘어선 근축 중간막과 함께 뻗어 있다.[1]
원시적인 줄무늬가 계속 퇴행함에 따라, 소마이트들은 소마토메레스처럼 로스트릭하게 "부드러져" 근막중막으로부터 형성되며, 작고 분리된 체질로 분리된다. 이러한 분열 증상의 주기적인 특성은 많은 사람들이 발달 신호의 파동이 새로운 소마이트의 주기적인 형성을 야기하는 시계-파형 모델을 통해 소마 발생이 발생한다고 말하게 했다.
그리고 나서 이 미성숙한 솜털은 바깥 층(상피층)과 내부 질량(중피층)으로 압축된다.
소마이트 자체는 소마이트의 위치에 따라 지정되며, 소마이트 자체는 소마이트 발생 전 전축과 후축 축의 위치에 따라 결정된다.
각 소마이트 내의 셀은 소마이트 내의 위치를 기준으로 지정된다. 게다가, 그들은 소변생성 과정에서 비교적 늦은 시간까지 어떤 종류의 소변에서 파생된 구조물이 될 수 있는 능력을 가지고 있다.[2]
신호
주기성
일단 위식 중 세포이동에 따라 소마이크 이전의 세포들이 자리를 잡게 되면, 많은 유전자의 진동 발현이 발달 '시계'에 의해 조절되는 것처럼 이들 세포에서 시작된다. 앞서 언급했듯이, 이것은 많은 사람들이 소변생식을 "클록 앤 웨이브" 메커니즘에 의해 조정된다는 결론을 내리게 했다.
기술적 용어로 이것은 유전자와 유전자 생산물의 네트워크의 세포자율적 진동으로 인해 소변생성이 발생한다는 것을 의미하며, 이는 세포가 시계와 같이 일정한 시간적 방식으로 허용과 비영합적 상태 사이에서 진동하게 한다. 이들 유전자는 FGF 계열인 Wnt와 Natch 경로의 구성원뿐만 아니라 이러한 경로의 대상도 포함한다. 파도는 후방으로 천천히 전진한다. 신호의 전선이 허용 상태의 세포와 접촉할 때, 상피-망상체 전이 과정을 거치고 더 후미 소마성 전 중간체로부터 떨어져 나와 소마이트 경계를 형성하고 다음 소마이트에 대한 과정을 재설정한다.[3]
특히 노치 경로의 주기적 활성화는 파동전경-시계 모델에서 매우 중요한 것으로 보인다. 노치의 활성화는 소마이트가 주 근축체로부터 분리하는 데 필요한 유전자의 층계를 주기적으로 활성화시키는 것이 제안되었다. 이것은 제브라피쉬의 단순한 음성 피드백 루프를 통해 또는 병아리나 쥐처럼 FGF와 Wnt 시계가 노치 시계에 영향을 미치는 복잡한 과정과 같이 다른 종에서 다른 수단에 의해 제어된다.[4][5] 그러나 분할 시계 모델은 진화적으로 보존되어 있다.[6]
"시계 유전자"의 본질적인 한 소마이트가 형성되는 데 필요한 시간과 동일한 주기성으로 진동해야 제브라피쉬에서 30분, 90분병아리에서, 뱀에서 100분 등 표현은 한다.[7]
전유전자 세포의 유전자 진동은 대부분, 완전히는 아니지만, 세포 자율적이다. 제브라피쉬에서 노치 신호가 교란되면 이웃한 세포들이 더 이상 동기적으로 진동하지 않게 되어 노치 신호가 이웃한 세포 집단을 동기식으로 유지하는데 중요하다는 것을 알 수 있다.[8] 또한 소닉 고슴도치(Shh) 단백질을 대상으로 한 소니토제네시스(somic generalesis) 연구에서도 세포간 의존성이 어느 정도 드러났다. 비록 쉿 경로 단백질의 발현이 소미티즘 전 중간체에서 진동한다고 보고되지는 않았지만, 소미티생식 동안 소미티즘 전 중간체 내에서 발현된다. 병아리 배아에서 소미토제 발생 시 노토코드가 축축되면 적절한 소미트 수가 형성되지만, 소미트의 후분 2/3에 대해서는 분할 시계가 지연된다. 전뇌는 영향을 받지 않는다. 한 연구에서 이 표현형은 쉬 억제제에 의해 모방되었고, 때맞춰 소마이트 형성은 외생 쉬 단백질에 의해 구조되었는데, 이는 노토코드가 생성되는 누락된 신호가 쉬에 의해 매개된다는 것을 보여준다.[9]
소마이트 분리 신호 및 상피화
솜사이트의 물리적인 분리는 서로 떨어져 있는 세포를 끌어당기는 것과 서로 다른 세포들 사이에 국경의 형성 및 새로운 유착에 달려 있다. 연구는 이 과정에서 국경 형성을 조정하는 에프 수용체와 에프린 단백질군이 관여하는 경로의 중요성을 보여준다. 또한 섬유소세포와 캐더린은 적절한 세포가 서로 국소화하는데 도움을 준다.[10][11]
사양 및 차별화
소름이 돋는 근축중추와 관련하여, 발파 단계에서 운명의 지도화 실험은 일부 유기체에서 원시적인 줄무늬라고 불리는 식전중추생물을 조직자 옆 지역에서 보여준다. 이식 실험은 후기 위굴라 단계에서만 이러한 세포들이 근축적 운명에 헌신한다는 것을 보여주는데, 이는 운명 결정이 국소 신호에 의해 엄격히 통제되고 미리 결정되지 않는다는 것을 의미한다. 예를 들어, 골격형성 단백질(BMPs)에 대한 소마이티크 전 메소데럼의 노출은 조직을 복강화시키지만, 체내에서는 조직자에 의해 분비되는 BMP 길항제(노긴, 코딘 등)가 이를 방지하여 등골 구조의 형성을 촉진한다.[12]
소미토제인성종료
그것은 현재 어떤 특정한 메커니즘 소피토제시스가 종료되는지에 의해 알려져 있지 않다. 제안된 방법 중 하나는 이 지역이 소마이트를 형성하는 것을 막기 위해 근축중막의 포스토모스트 세포에서 대규모 세포사멸이다.[13][14] 다른 사람들은 Wnt 표적 유전자인 노긴에 의한 BMP 신호의 억제가 소미티크 이전의 중간체에서 소미이트의 분리에 필요한 상피 대 메센티피 전환을 억제하여 소미티제네시스(somitogenesis)를 종료한다고 제안했다.[15] 몸통 내 소미토제스(꼬리가 아니라)에 필요한 카우달 Fgf8 영역을 제한하려면 상위 척추동물에서 내생성 레티노산이 필요하지만, 꼬리(인간)가 부족하거나 짧은 꼬리(치크)를 가진 척추동물의 소미토제스 종식에 레티노산의 역할을 하는 연구도 있다.[16] 다른 연구들은 종말이 이 꼬리 부위로 확장되는 소마이트 형성 속도와 소마이트 이전의 성장 사이의 불균형 때문일 수 있다고 제안한다.[17]
다른 종에서 소미토제네시스
종마다 솜털의 수가 다르다. 예를 들어 개구리는 약 10마리, 인간은 37마리, 병아리는 50마리, 쥐는 65마리, 뱀은 약 500마리까지 300마리 이상을 가지고 있다.
소마이트 수는 실험 절차를 통해 배아의 크기 변화에 영향을 받지 않는다. 특정 종의 모든 발달된 배아는 동일한 수의 섬유를 형성하기 때문에, 존재하는 섬미의 수는 척추동물을 발달시키는 데 있어 일반적으로 연령에 대한 기준으로 사용된다.[18][19]
참조
- ^ Gilbert, S.F. (2010). Developmental Biology (9th ed.). Sinauer Associates, Inc. pp. 413–415. ISBN 978-0-87893-384-6.
- ^ Gilbert, S.F. (2010). Developmental Biology (9th ed.). Sinauer Associates, Inc. pp. 413–415. ISBN 978-0-87893-384-6.
- ^ Baker, R. E.; Schnell, S.; Maini, P. K. (2006). "A clock and wavefront mechanism for somite formation". Developmental Biology. 293 (1): 116–126. doi:10.1016/j.ydbio.2006.01.018. PMID 16546158.
- ^ Goldbeter, A.; Pourquié, O. (2008). "Modeling the segmentation clock as a network of coupled oscillations in the Notch, Wnt and FGF signaling pathways". Journal of Theoretical Biology. 252 (3): 574–585. Bibcode:2008JThBi.252..574G. doi:10.1016/j.jtbi.2008.01.006. PMID 18308339.
- ^ Gilbert, S.F. (2010). Developmental Biology (9th ed.). Sinauer Associates, Inc. pp. 413–415. ISBN 978-0-87893-384-6.
- ^ Krol, A. J.; Roellig, D.; Dequéant, M. -L.; Tassy, O.; Glynn, E.; Hattem, G.; Mushegian, A.; Oates, A. C.; Pourquié, O. (2011). "Evolutionary plasticity of segmentation clock networks". Development. 138 (13): 2783–2792. doi:10.1242/dev.063834. PMC 3109603. PMID 21652651.
- ^ Gomez, C; et al. (2008). "Control of segment number in vertebrate embryos". Nature. 454 (7202): 335–339. Bibcode:2008Natur.454..335G. doi:10.1038/nature07020. PMID 18563087. S2CID 4373389.
- ^ Jiang, Y et al. 2000 (2000). "Notch signalling and the synchronization of the somite segmentation clock". Nature. 408 (6811): 475–479. Bibcode:2000Natur.408..475J. doi:10.1038/35044091. PMID 11100729. S2CID 1182831.
- ^ Resende, TP; et al. (2010). "Sonic hedgehog in temporal control of somite formation". Proc Natl Acad Sci USA. 107 (29): 12907–12912. Bibcode:2010PNAS..10712907R. doi:10.1073/pnas.1000979107. PMC 2919945. PMID 20615943.
- ^ Pourquié, O. (2001). "Vertebratesomitogenesis". Annual Review of Cell and Developmental Biology. 17: 311–350. doi:10.1146/annurev.cellbio.17.1.311. PMID 11687492.
- ^ Gilbert, S.F. (2010). Developmental Biology (9th ed.). Sinauer Associates, Inc. pp. 413–415. ISBN 978-0-87893-384-6.
- ^ Pourquie, O. (2001). "Vertebrate somitogenesis". Annu. Rev. Cell Dev. Biol. 17: 311–50. doi:10.1146/annurev.cellbio.17.1.311. PMID 11687492.
- ^ Sanders, E. J.; Khare, M. K.; Ooi, V. C.; Bellairs, R. (1986). "An experimental and morphological analysis of the tail bud mesenchyme of the chick embryo". Anatomy and Embryology. 174 (2): 179–185. doi:10.1007/bf00824333. PMID 3740453. S2CID 26289320.
- ^ Mills, C. L.; Bellairs, R. (1989). "Mitosis and cell death in the tail of the chick embryo". Anatomy and Embryology. 180 (3): 301–308. doi:10.1007/bf00315888. PMID 2596707. S2CID 1318372.
- ^ Ohta, S.; Suzuki, K.; Tachibana, K.; Tanaka, H.; Yamada, G. (2007). "Cessation of gastrulation is mediated by suppression of epithelial-mesenchymal transition at the ventral ectodermal ridge". Development. 134 (24): 4315–4324. doi:10.1242/dev.008151. PMID 18003744.
- ^ Cunningham, T.J.; Duester, G. (2015). "Mechanisms of retinoic acid signalling and its roles in organ and limb development". Nat. Rev. Mol. Cell Biol. 16 (2): 110–123. doi:10.1038/nrm3932. PMC 4636111. PMID 25560970.
- ^ Tenin, G.; Wright, D.; Ferjentsik, Z.; Bone, R.; McGrew, M. J.; Maroto, M. (2010). "The chick somitogenesis oscillator is arrested before all paraxial mesoderm is segmented into somites". BMC Developmental Biology. 10: 24. doi:10.1186/1471-213X-10-24. PMC 2836991. PMID 20184730.
- ^ Gomez, C; et al. (2008). "Control of segment number in vertebrate embryos". Nature. 454 (7202): 335–339. Bibcode:2008Natur.454..335G. doi:10.1038/nature07020. PMID 18563087. S2CID 4373389.
- ^ Gilbert, S.F. (2010). Developmental Biology (9th ed.). Sinauer Associates, Inc. pp. 413–415. ISBN 978-0-87893-384-6.