원시 줄무늬
Primitive streak| 원시 줄무늬 | |
|---|---|
 | |
| 세부 사항 | |
| 카네기 단계 | 6b |
| 날들 | 15 |
| 식별자 | |
| 라틴어 | 원시적인 것을 긋기 |
| MeSH | D054240 |
| 해부학 용어 | |
원시 줄무늬는 초기 배아에서 양막에 형성되는 구조입니다.[1]양서류에서는 이와 동등한 구조가 배반공입니다.[2]초기 배아 발달 동안, 배아 디스크는 타원형이 되고, 배 모양이 되며, 넓은 끝은 앞쪽으로, 좁은 영역은 뒤쪽으로 돌출됩니다.원시적인 줄무늬는 배쪽의 발달하는 배아의 더 좁은 뒤쪽 (코끼리) 영역에서 종방향 중간선 구조를 형성합니다.[3]처음 형성될 때 원시적인 줄무늬는 배아의 길이의 반만큼 뻗어 있습니다.인간 배아에서 이것은 6기, 약 17일까지 나타납니다.[4]
원시 줄무늬는 양쪽 대칭을 확립하고 위 조절 부위를 결정하며 생식기 층 형성을 시작합니다.원시 줄무늬 중간엽 줄기세포를 형성하기 위해 두 번째 배아축을 형성하고, 위 조절 및 생식층 형성 과정에서 세포가 진입하고 이동할 위치를 설정하는 예비 중간선을 따라 배열됩니다.[5]
원시 줄무늬는 이 중간선을 통해 뻗어 왼쪽-오른쪽 및 두개-코아 몸체 축을 만듭니다.[6][7]위 조절은 중배엽 전구물질의 유입과 그들의 궁극적인 위치로의 이동을 포함하며,[6][8] 여기서 그들은 내배엽 및 외배엽 층과 함께 성체 유기체의 모든 조직을 생성할 중배엽 세균 층으로[5] 분화할 것입니다.
구조.

양막배아원반의 단일 상피층인 상피세포는 양막배아원반의 모든 배아물질의 원천이며, 일부 세포는 원시적인 줄무늬를 생성할 것입니다.[5][8]양서류에서는 이와 동등한 구조가 배반공입니다.[2]원시 줄무늬는 등 쪽의 발육 배아의 더 좁은 꼬리 부분에서 종방향 중간선 구조를 형성합니다.[3]처음 형성될 때 원시적인 줄무늬는 배아의 길이의 반만큼 뻗어 있습니다.인간 배아에서 이것은 카네기 6기, 약 17일에 나타납니다.[4]
디스크의 두개골(내부) 끝을 향해 원시 줄무늬가 확장되어 가스 조절을 위한 조직자인 원시 노드로 알려진 영역으로 확장됩니다.[9]병아리를 포함한 조류에서 이 조직화 마디는 헨센 마디라고 불립니다.처음 발견된 양서류에서는 스페만-망골드 조직체로 알려져 있습니다.
마디 가운데에는 원시 구덩이라는 이름의 원형 움푹 들어간 곳이 있습니다.원시 구덩이는 원시 홈이라고 불리는 원시 줄무늬에서 좁은 움푹 패인 곳으로 꼬리 끝을 향해 뻗어 있습니다.[9]이 홈은 심낭세포를 인폴딩해서 만들어집니다.[10][11]
마디, 구덩이, 홈의 모양과 형성에 따라, 줄무늬는 조심스럽게 퇴보하기 시작합니다.인간 배아에서 20일경에, 줄무늬의 나머지 부분들은 꼬리의 싹 또는 꼬리의 융모라고 불리는 중간선의 꼬리 세포 덩어리를 생성하기 위해 커집니다.[9]또한 그 때 노처드 코드는 원시 노드에서 두개골로 발달합니다.22일째에는 원시적인 줄무늬가 배아 길이의 10%에서 20% 사이로 퇴보하고 26일째에는 겉보기에는 사라진 것처럼 보입니다.[9]

형성
모델 유기체로서의 병아리 배아는 원시적인 줄무늬의 형성에 대해 많은 정보를 제공했습니다.병아리 배반에서 그것의 형성은 상피세포의 세포들의 조직화된 움직임과 재배치를 포함합니다.[12]두 개의 역회전하는 세포 흐름이 뒤쪽 끝에서 만나는데, 여기서 줄무늬가 형성됩니다.[12]이러한 흐름의 중심에는 거의 움직임이 없는 반면, 소용돌이의 주변부에서는 가장 큰 움직임이 관찰됩니다.[7]폴로네즈 운동과 유사한 소용돌이 운동은 원시적인 줄무늬를 형성하는 데 핵심입니다.[13]병아리 배아의 후단에 있는 콜러 낫을 겹쳐 놓은 세포는 중간선을 향해 이동하고, 만나 상피세포의 중심을 향해 방향을 바꿉니다.측면 후방 변연부의 세포들은 콜러 낫을 떠난 세포들을 이 영역의 중심에서 만나 방향을 바꾸고 앞으로 뻗어나가는 것으로 대체합니다.[8][14]이 세포들이 움직이고 배아의 후단에 집중함에 따라, 줄무늬는 거시적으로 보이는 구조를 만드는 단층 상피 시트 전이를 겪습니다.[8]원시 줄무늬를 형성하는 데 필요한 세포 운동의 특성을 설명하기 위해 활성 증식, 배향 세포 분할, 세포-세포 삽입 및 화학적 세포 운동을 포함한 여러 메커니즘이 제안되었습니다.[15][8]
병아리 배아의 주변부는 줄기세포에 기여할 세포를 포함하고 있습니다.[8]이 영역은 원시적인 줄무늬를 유도하는 능력에서 정의된 전후 기울기를 가지고 있으며, 후단은 가장 높은 잠재력을 가지고 있습니다.[16]에피블라스트의 모든 세포는 주변 영역의 신호에 반응할 수 있지만,[5] 일단 주어진 영역이 이러한 신호에 의해 유도되고 줄무늬 형성을 거치면, 에피블라스트의 나머지 세포들은 더 이상 이러한 유도 신호에 반응하지 않고 또 다른 줄무늬의 형성을 막습니다.[16]
후두엽의 기저에는 배아 외 조직이 기원하는 저모세포가 있습니다.[8]병아리에서, 저모세포의 부재는 다수의 연쇄를 낳으며,[17] 이는 그 존재가 단일 원시 연쇄의 형성을 조절하는데 중요하다는 것을 암시합니다.쥐와 다른 포유동물에서 이 구조는 전내장내배엽(AVE)으로 알려져 있습니다.[17]AVE는 내장 내배엽(hypoblast)에서 마이그레이션됩니다.[18]저모세포는 줄무늬 형성의 조절에도 중요한 역할을 합니다.병아리의 저모세포를 제거하면 정확하게 패턴화된 이소성 줄무늬가 생성되며, 이는 저모세포가 원시 줄무늬의 형성을 억제하는 역할을 한다는 것을 암시합니다.[19]
신호 경로

병아리의 원시 줄무늬 형성은 신호 경로의 복잡한 네트워크에 의해 크게 조절됩니다.이 과정을 위해서는 줄무늬 형성 부위에 인접한 다양한 분비 인자(Vg1, Nodal, Wnt8C, FGF8 및 Chordin) 및 전사 인자(Brachyury 및 Gooscoid)의 활성화가 필요합니다.[20][21][22][23][19]
Vg1 및 Wnt 시그널링
마찬가지로, Vg1(transforming growth factor beta family member (TGF-β))의 오발현과 병아리의 후연부 영역의[16] 이식은 또한 이소성 줄무늬를 유도할 수 있지만, 배아의 변연부 영역 내에서만 가능하며,[22] 줄무늬 형성을 유도하는 능력에 있어서 이 영역의 특정한 특성을 나타냅니다.여러 증거 라인은 이러한 능력의 결정 요인으로 Wnt 표현을 지적합니다.마우스 배아에서 Wnt3를 삭제하면 B-catenin 돌연변이 배아의 표현형과 유사하게 줄무늬 형성이 없습니다.[24]또한, Wnt 신호전달의 세포내 음성 조절기, Axin [25]및 병아리 cWnt8C의[26] 오발현을 변이시키는 것은 마우스 배아에서 다수의 줄무늬를 생성합니다.Wnt와 그 경로의 성분인 Lef1 및 B-catenin의 국소화는 한계 영역에서 줄무늬 유도 역할을 추가로 지원합니다.[22]또한, 변방 영역의 줄무늬 유도 능력에 대응하여 [22][23]후방에서 전방으로 감소하는 기울기로 표현됩니다.Vg1 또는 Wnt1의 오발현만으로는 병아리의 이소성 줄무늬를 유도하지 못했지만, 이들의 오발현과 함께 이소성 줄무늬 형성이 이루어졌으며, 이는 후단 경계 영역의 줄무늬 유도 능력이 Wnt 신호[22] 전달에 기인할 수 있으며 Vg1과 Wnt가 이러한 과정을 유도하기 위해 협력해야 함을 확인했습니다.Wnt 길항제인 Crescent 또는 Dkk-1과 함께 Vg1의 오발현은 이소성 줄무늬의 형성을 막으며,[22] Vg1 유도 이소성 줄무늬의 형성에서 Wnt 활성의 중요성을 보여주고 따라서 정상적인 원시 줄무늬 형성에서 그것의 의미를 나타냅니다.
노달 신호
변형성장인자 베타 패밀리(TFB 패밀리)의 알려진 중배엽 유도체인 노달(nodal)은 줄무늬 형성과 관련되어 있습니다.[19]Nodal을 위해 돌연변이 된 마우스 배아는 위 조절에 실패하고 대부분의 중배엽이 부족하지만,[27] Nodal은 중배엽 유도에서 역할을 하는 것 이상으로 원시 줄무늬의 유도 및/또는 유지를 조절합니다.[27]저모세포가 존재하는 경우 노달은 병아리 배아에 이소성 줄무늬를 유도할 수 없는 반면, 제거는 노달, 초딘 및 브라큐리의 발현을 유도하여 [19]저모세포가 노달 신호 전달에 일정한 억제 효과를 가져야 함을 시사합니다.실제로 Nodal, Wnt 및 BMP 신호전달의 다기능 길항제인 Cerberus(저모세포에서 생성됨) 및 Cerberus-Short(노달만 억제함)는 Nodal 신호전달에 대한 효과를 통해 줄무늬 형성을 억제합니다.[19]결국, 저모세포는 움직이는 내모세포에 의해 전방으로 이동하게 되고, 후단에 줄무늬를 형성할 수 있게 됩니다.전방 말단에는 저모세포와 그것이 분비하는 길항제, 예를 들어 세르베루스는 노달의 발현을 억제하고, 따라서 줄무늬 형성을 후방 말단에만 제한합니다.[19]병아리의 저모세포와 유사하게, 마우스의 AVE는 노달 신호의 두 길항제인 세르베루스 유사체, 세르엘 및 레프티1을 분비합니다.[19][28]마우스에서 Cer-/-; Lefty1-/- 이중 돌연변이는 Brachyury의 이소성 발현에서 알 수 있듯이 여러 가닥의[17] 줄무늬가 발생하고 Nodal 유전자의 한 사본을 제거함으로써 부분적으로 구제될 수 있습니다.[17]마우스에서 AVE는 Cer1과 Lefty1의 중복 기능을 통해 줄무늬 형성을 제한하며, 이는 Nodal 신호를 부정적으로 조절합니다.[17]단일 원시 줄무늬의 형성을 보장하는 마우스의 AVE의 역할은 병아리의 저모세포에서 진화적으로 보존됩니다.[17][19]
FGF 신호전달
원시 줄무늬의 형성을 조절하는 또 다른 중요한 경로는 FGF인데, FGF는 이러한 과정을 조절하기 위해 노달과 협력하는 것으로 생각됩니다.[29]우세한 음성 수용체의 발현을 통한 FGF 신호전달 억제, FGF 수용체 억제제(SU5402) 또는 FGF 리간드의 고갈은 중배엽 형성을[7] 억제하고,[8] 이는 다시 줄무늬 형성을 억제합니다.또한, Vg1에 의해 유도된 이소성 줄무늬 형성은 FGF 신호전달을 필요로 했습니다.[29]
BMP 시그널링
마지막으로, BMP 신호전달은 병아리 배아의 줄무늬 형성 과정을 조절하는 데에도 중요합니다.줄무늬 형성 부위는 낮은 BMP 신호로 특징지어지는 반면, 에피블라스트의 나머지 부분은 높은 수준의 BMP 활성화를 나타냅니다.[30]또한 BMP4 또는 BMP7의 오발현은 줄무늬 형성을 방지하는 반면, BMP 억제제 Chordin은 병아리에서 이소성 줄무늬 형성을 유도하여 줄무늬 형성이 BMP 억제를 필요로 할 가능성이 있음을 시사합니다.[31]
윤리적 의미
원시 줄무늬는 생명 윤리학에서 중요한 개념인데, 일부 전문가들은 인간 배아에 대한 실험이 허용되지만, 원시 줄무늬가 발달하기 전에만, 일반적으로 존재 14일경에 가능하다고 주장합니다.그러한 생명윤리학자들에 의해 원시적인 줄무늬의 발달은 독특한 인간의 창조를 나타내는 것으로 받아들여집니다.[32]일부 국가에서는 여성의 몸 밖에서 14일 이상 인간 배아를 배양하는 것이 불법입니다.[33]
참고 항목
추가영상
-
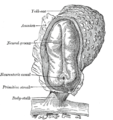
인간 배아—길이, 2 mm.양막이 열려있는 등쪽 시야.X 30.
-
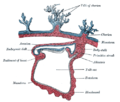
포유류 배반 디스크를 통한 측면 단면.
참고문헌
- ^ "Definition of AMNIOTE". www.merriam-webster.com. Retrieved 11 May 2022.
- ^ a b Wolpert, Lewis (2015). Principles of development (Fifth ed.). Oxford, United Kingdom. p. 113. ISBN 9780199678143.
{{cite book}}: CS1 유지 관리: 위치 누락 게시자(링크) - ^ a b Schoenwolf, Gary C. (2015). Larsen's human embryology (Fifth ed.). Philadelphia, PA. p. 57. ISBN 9781455706846.
{{cite book}}: CS1 유지 관리: 위치 누락 게시자(링크) - ^ a b Standring, Susan (2016). Gray's anatomy : the anatomical basis of clinical practice (Forty-first ed.). [Philadelphia]. p. 181. ISBN 9780702052309.
{{cite book}}: CS1 유지 관리: 위치 누락 게시자(링크) - ^ a b c d Mikawa T, Poh AM, Kelly KA, Ishii Y, Reese DE (2004). "Induction and patterning of the primitive streak, an organizing center of gastrulation in the amniote". Dev Dyn. 229 (3): 422–32. doi:10.1002/dvdy.10458. PMID 14991697. S2CID 758473.
- ^ a b Downs KM (2009). "The enigmatic primitive streak: prevailing notions and challenges concerning the body axis of mammals". BioEssays. 31 (8): 892–902. doi:10.1002/bies.200900038. PMC 2949267. PMID 19609969.
- ^ a b c Chuai M, Zeng W, Yang X, Boychenko V, Glazier JA, Weijer CJ (2006). "Cell movement during chick primitive streak formation". Dev. Biol. 296 (1): 137–49. doi:10.1016/j.ydbio.2006.04.451. PMC 2556955. PMID 16725136.
- ^ a b c d e f g h Chuai M, Weijer CJ (2008). "The mechanisms underlying primitive streak formation in the chick embryo". Curr Top Dev Biol. Current Topics in Developmental Biology. 81: 135–56. doi:10.1016/S0070-2153(07)81004-0. ISBN 978-0-12-374253-7. PMID 18023726.
- ^ a b c d Schoenwolf, Gary C. (2015). Larsen's human embryology (Fifth ed.). Philadelphia, PA. pp. 78–80. ISBN 9781455706846.
{{cite book}}: CS1 유지 관리: 위치 누락 게시자(링크) - ^ Moore, Keith L.; Persaud, T. V. N.; Torchia, Mark G. (2018). "4 - Third Week of Human Development". The Developing Human (11th ed.). Saunders. pp. 47–63. ISBN 9780323611541.
- ^ Standring, Susan (2020). "10 - Cell populations at gastrulation". Gray's Anatomy (42nd ed.). Elsevier. pp. 188–195. ISBN 9780702077050.
- ^ a b Cui C, Yang X, Chuai M, Glazier JA, Weijer CJ (2005). "Analysis of tissue flow patterns during primitive streak formation in the chick embryo". Dev. Biol. 284 (1): 37–47. doi:10.1016/j.ydbio.2005.04.021. PMID 15950214.
- ^ Saadaoui, M; Rocancourt, D; Roussel, J; Corson, F; Gros, J (24 January 2020). "A tensile ring drives tissue flows to shape the gastrulating amniote embryo". Science. 367 (6476): 453–458. Bibcode:2020Sci...367..453S. doi:10.1126/science.aaw1965. PMID 31974255. S2CID 92787648.
- ^ Hatada Y, Stern CD (1994). "A fate map of the epiblast of the early chick embryo". Development. 120 (10): 2879–89. doi:10.1242/dev.120.10.2879. PMID 7607078.
- ^ Mikawa, Takashi; Poh, Alisa M.; Kelly, Kristine A.; Ishii, Yasuo; Reese, David E. (2004). "Induction and patterning of the primitive streak an organizing centre of gastrulation in the amniote". Developmental Dynamics. 229 (3): 422–432. doi:10.1002/dvdy.10458. PMID 14991697. S2CID 758473.
- ^ a b c Khaner O, Eyal-Giladi H (1989). "The chick's marginal zone and primitive streak formation. I. Coordinative effect of induction and inhibition". Dev. Biol. 134 (1): 206–14. doi:10.1016/0012-1606(89)90090-0. PMID 2731648.
- ^ a b c d e f Perea-Gomez A, Vella FD, Shawlot W, Oulad-Abdelghani M, Chazaud C, Meno C, Pfister V, Chen L, Robertson E, Hamada H, Behringer RR, Ang SL (2002). "Nodal antagonists in the anterior visceral endoderm prevent the formation of multiple primitive streaks". Dev Cell. 3 (5): 745–56. doi:10.1016/S1534-5807(02)00321-0. PMID 12431380.
- ^ Gilbert, Scott F. (2006). Developmental biology (8th ed.). Sunderland, Mass.: Sinauer Associates Publishers. p. 358. ISBN 9780878932504.
- ^ a b c d e f g h Bertocchini F, Stern CD (2002). "The hypoblast of the chick embryo positions the primitive streak by antagonizing nodal signaling". Dev Cell. 3 (5): 735–44. doi:10.1016/S1534-5807(02)00318-0. PMID 12431379.
- ^ Shah SB, Skromne I, Hume CR, Kessler DS, Lee KJ, Stern CD, Dodd J (1997). "Misexpression of chick Vg1 in the marginal zone induces primitive streak formation". Development. 124 (24): 5127–38. doi:10.1242/dev.124.24.5127. PMID 9362470.
- ^ Bachvarova RF, Skromne I, Stern CD (1998). "Induction of primitive streak and Hensen's node by the posterior marginal zone in the early chick embryo". Development. 125 (17): 3521–34. doi:10.1242/dev.125.17.3521. PMID 9693154.
- ^ a b c d e f Skromne I, Stern CD (2001). "Interactions between Wnt and Vg1 signalling pathways initiate primitive streak formation in the chick embryo". Development. 128 (15): 2915–27. doi:10.1242/dev.128.15.2915. PMID 11532915.
- ^ a b Skromne I, Stern CD (2002). "A hierarchy of gene expression accompanying induction of the primitive streak by Vg1 in the chick embryo". Mech. Dev. 114 (1–2): 115–8. doi:10.1016/S0925-4773(02)00034-5. PMID 12175495.
- ^ Liu P, Wakamiya M, Shea MJ, Albrecht U, Behringer RR, Bradley A (1999). "Requirement for Wnt3 in vertebrate axis formation". Nat. Genet. 22 (4): 361–5. doi:10.1038/11932. PMID 10431240. S2CID 22195563.
- ^ Zeng L, Fagotto F, Zhang T, Hsu W, Vasicek TJ, Perry WL 3rd, Lee JJ, Tilghman SM, Gumbiner BM, Costantini F (1997). "The mouse Fused locus encodes Axin, an inhibitor of the Wnt signaling pathway that regulates embryonic axis formation". Cell. 90 (1): 181–92. doi:10.1016/S0092-8674(00)80324-4. PMID 9230313.
- ^ Pöpperl H, Schmidt C, Wilson V, Hume CR, Dodd J, Krumlauf R, Beddington RS (1997). "Misexpression of Cwnt8C in the mouse induces an ectopic embryonic axis and causes a truncation of the anterior neuroectoderm". Development. 124 (15): 2997–3005. doi:10.1242/dev.124.15.2997. PMID 9247341.
- ^ a b Conlon FL, Lyons KM, Takaesu N, Barth KS, Kispert A, Herrmann B, Robertson EJ (1994). "A primary requirement for nodal in the formation and maintenance of the primitive streak in the mouse". Development. 120 (7): 1919–28. doi:10.1242/dev.120.7.1919. PMID 7924997.
- ^ C Perea-Gomez A, Rhinn M, Ang SL (2001). "Role of the anterior visceral endoderm in restricting posterior signals in the mouse embryo". Int J Dev Biol. 45 (1): 311–20. PMID 11291861.
- ^ a b Bertocchini F, Skromne I, Wolpert L, Stern CD (2004). "Determination of embryonic polarity in a regulative system: evidence for endogenous inhibitors acting sequentially during primitive streak formation in the chick embryo". Development. 131 (14): 3381–90. doi:10.1242/dev.01178. PMID 15226255. S2CID 942758.
- ^ Faure S, de Santa Barbara P, Roberts DJ, Whitman M (2002). "Endogenous patterns of BMP signaling during early chick development". Dev. Biol. 244 (1): 44–65. doi:10.1006/dbio.2002.0579. PMID 11900458.
- ^ Streit A, Lee KJ, Woo I, Roberts C, Jessell TM, Stern CD (1998). "Chordin regulates primitive streak development and the stability of induced neural cells, but is not sufficient for neural induction in the chick embryo". Development. 125 (3): 507–19. doi:10.1242/dev.125.3.507. PMID 9425145.
- ^ "The President's Council on Bioethics, Human Cloning and Human Dignity: An Ethical Inquiry. Chapter 6". July 2002.
- ^ "Prohibition of Human Cloning for Reproduction Act 2002". Government of Australia Department of Health and Ageing. 22 Dec 2008.