유황 순환
Sulfur cycle| 시리즈의 일부 |
| 생물 지구 화학적 순환 |
|---|
 |
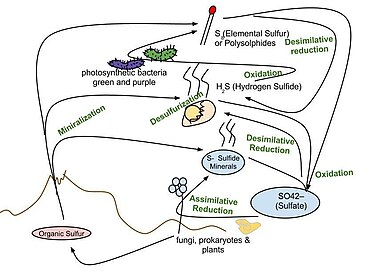
유황 순환은 유황이 암석, 수로, 생물계 사이를 이동하는 생물 지구 화학적 순환이다.황은 많은 단백질과 보조 인자의 구성 요소인 필수 요소(CHNOPS)이며, 황 화합물은 미생물 [1]호흡에서 산화제나 환원제로 사용될 수 있기 때문에 지질학에서나 생물에 영향을 미치기 때문에 중요하다.지구 유황 순환은 지질학적, 생물학적 과정 모두에서 중요한 역할을 하는 다른 산화 상태를 통한 유황 종의 변화를 포함한다.유황 주기의 단계는 다음과 같습니다.
- 황화수소(HS2), 원소황, 황화물 광물 등 유기황의 무기화.
- 황화수소, 황화수소, 원소황(S)을 황산(SO2−
4)으로 산화시킨다. - 황산염을 황화물로 환원한다.
- 유기화합물(금속 함유 유도체 포함)에 황화물 혼입
이들은 종종 다음과 같이 불립니다.
- 황산염(SO)이2−
4 식물, 곰팡이 및 다양한 원핵생물에 의해 환원되는 동화성 황산염 환원(황 동화 참조).황의 산화 상태는 황산염에서 +6, R–SH에서 -2이다. - 황을 함유한 유기분자를 탈황하여 황화수소가스(HS2, 산화상태=–2)를 발생시키는 탈황.유기질소화합물에 대한 유사한 과정은 탈아미네이션이다.
- 황화수소의 산화는 원소황(S8)을 생성하며, 산화상태 = 0이다.이 반응은 광합성 녹색과 보라색 유황 박테리아와 일부 화학석영양생물에서 일어난다.종종 원소 유황은 다황화물로 저장된다.
- 황산화제에 의한 원소 유황의 산화는 황산염을 생성한다.
- 원소 황을 황화수소로 환원할 수 있는 파괴성 황 환원.
- 황산 환원제가 황산염에서 황화수소를 발생시키는 파괴성 황산염 환원.
황산화 상태
황은 자연에서 -2, +2, +4, +6의 네 가지 주요 산화 상태를 가지고 있습니다.각 산화 상태의 일반적인 황종은 다음과 같다.
S2−: HS2, (CH3)2S, BaaS
S0: 천연 또는 원소 유황
S2+2: SCL
S4+: SO2, 아황산염(SO2−
3)
S6+: SO2−
4(HSO24, CaaS4), SF6
유황원 및 싱크대
황은 SO의2−
4 +6에서 황화물의 -2까지의 산화상태에서 발견된다.따라서 원소 유황은 환경에 따라 전자를 주거나 받을 수 있다.무산소 초기 지구에서는 황철광(FeS)과2 같은 광물에 대부분의 황이 존재했다.지구의 역사를 통해, 이동성 유황의 양은 화산 활동과 산소가 함유된 대기 중 [1]지각의 풍화를 통해 증가했다.지구의 주요 유황 흡수원은 SO로2−
4, SO가 주요 산화제이다.[2]
| 식품의 종류 | 산성배출량(단백질 100g당 SOeq2) |
|---|---|
| 쇠고기 | 343.6 |
| 치즈 | 165.5 |
| 돼지고기 | 142.7 |
| 램 앤 머튼 | 139.0 |
| 양식 갑각류 | 133.1 |
| 가금류 | 102.4 |
| 양식 물고기 | 65.9 |
| 계란 | 53.7 |
| 땅딸기 | 22.6 |
| 완두류 | 8.5 |
| 두부 | 6.7 |
유기체에2−
4 의해 SO가 동화되면, SO는 환원되고 단백질의 필수 성분인 유기 황으로 전환된다.그러나, 생물권은 유황의 주요 흡수원으로 작용하지 않고, 대신 황의 대부분은 황철광 리치 쉐일즈, 증발암(무수물 및 바리테), 칼슘과 마그네슘 탄산염(탄산염 관련 황산염)을 포함한 해수 또는 퇴적암에서 발견됩니다.바다의 황산염 양은 세 가지 주요 과정에 [4]의해 제어된다.
- 하천으로부터의 투입
- 대륙붕과 경사면에 황산염 환원 및 황화물 재처리
- 해양 지각에 무수광과 황철광의 매장
대기 중 황의 주요 천연 공급원은 바다 스프레이나 바람에 날리는 황이 풍부한 [5]먼지이며, 둘 다 대기 중에 오래 살지 않습니다.최근 석탄과 다른 화석연료의 연소로 인한 황의 대량 투입은 대기 오염물질로 작용하는 상당한 양의2 SO를 추가했다.지질학적 과거 석탄 측정치에 대한 화성 침입은 이러한 측정치를 대규모로 연소시키고 결과적으로 황을 대기로 방출시켰다.이것은 기후 시스템에 상당한 혼란을 초래했고 페름기-트라이아스기 멸종 [citation needed]사건의 제안된 원인 중 하나이다.
디메틸설피드[(CH3)2S 또는 DMS]는 해양의 광대에서 식물성 플랑크톤 세포의 소멸로부터 디메틸설포니오프로피온산염(DMS)이 분해되어 생성되며, 해안선을 [1]따라 특유의 "바다의 냄새"를 일으키는 주요 생물 발생 가스이다.DMS는 황가스의 가장 큰 원천이지만 대기 중 체류시간은 하루 정도밖에 되지 않고 대부분 육지로 가기보다는 바다에 재흡장된다.하지만, 그것은 구름 형성에 관여하기 때문에 기후 체계에서 중요한 요소이다.
생물학적, 열화학적으로 구동되는 황산염 환원

(유황 사이클의 주요 중간체)
불활성 황산염 환원 경로를 통해 황산염을 세균적으로 환원(황산균 환원)하거나 유기적으로 환원(열화학 황산염 환원)할 수 있다.이 경로는 유기 화합물에 의해 황산염이 환원되어 황화수소가 생성되며, 두 과정 모두에서 발생합니다.
황산세균 환원(BSR)과 황산세균 환원(TSR)의 주요 산물과 반응물은 매우 유사하다.두 가지 모두 다양한 유기화합물과 용존황산염이 반응물이며, 생성물 또는 부산물은 HS2, CO2, 탄산염, 원소황,[6] 금속황화물과 같다.그러나 반응성 유기화합물은 서로 배타적인 온도조건 때문에 BSR과 TSR이 다르다.유기산은 BSR의 주요 유기 반응물이며 분기/n-알칸은 TSR의 주요 유기 반응물이다.BSR과 TSR의 무기반응 생성물은 HS(HS−)와−
3 HCO(CO2)[7]이다2.
이러한 과정은 황산염이 감소하는 두 가지 매우 다른 열 방식이 있기 때문에 발생합니다. 특히 [6]저온 및 고온 환경에서 그렇습니다.BSR은 보통 0~80°C의 낮은 온도에서 발생하는 반면 TSR은 100~140°[7]C의 훨씬 높은 온도에서 발생합니다.TSR의 온도는 잘 정의되어 있지 않습니다.최저 확인된 온도는 127°C이며 최고 온도는 160~180°[7]C의 범위에서 발생합니다.이 두 가지 다른 형태가 나타나는 이유는 높은 온도에서 대부분의 황산염 환원 미생물이 단백질의 변성이나 [8]효소의 불활성화로 인해 더 이상 신진대사를 할 수 없기 때문입니다. 그래서 TSR이 대신합니다.그러나 열수 분출구 주변의 고온 퇴적물에서는 최대 [9]110°C의 온도에서 BSR이 발생할 수 있습니다.
BSR과 TSR은 깊이가 다릅니다.BSR은 저온 환경에서 발생합니다.저온 환경에서는 유전이나 가스전과 같이 얕게 설정되어 있습니다.BSR은 또한 해수 [10]속에 용해된 황산염이 고농도로 존재하기 때문에 미생물이 대량으로 감소하는 성층 내해, 대륙붕, 유기물이 풍부한 삼각주, 열수 퇴적물과 같은 현대 해양 퇴적 환경에서도 발생할 수 있다.또한, 유전과 가스전에서 발견되는 많은 양의 황화수소는 [11]황산염에 의한 석유 탄화수소의 산화로 인해 발생하는 것으로 생각된다.이러한 반응은 미생물 작용에 의해 발생하는 것으로 알려져 있지만, TSR이 이러한 반응의 대부분을 담당한다는 것은 일반적으로 인정되고 있습니다. 특히 깊은 저장고나 고온 [12]저장고에서 그렇습니다.따라서 TSR은 온도가 훨씬 높은 깊은 저장소에서 발생합니다.BSR은 대부분의 지질 환경에서 지질학적으로 순간적인 반면 TSR은 수십만 [13][6]년의 속도로 발생한다.BSR보다 훨씬 느리지만 TSR조차 지질학적으로 상당히 빠른 프로세스로 보입니다.
얕은 환경의 BSR과 깊은 저수지의 TSR은 해양 유황 [14][6]순환의 핵심 과정이다.HS의 약2 10%(총 가스 중)는 BSR 설정에서 생산되는 반면, HS의2 90%는 TSR [7]설정에서 생산됩니다.깊은 탱크에 HS가2 몇 % 이상 존재할 경우 TSR이 인계받은 것으로 간주됩니다.이는 탄화수소의 열적 균열이 HS의2 2%를 넘지 못하기 때문이다.HS의 양은2 유기 반응 물질과 황산염의 가용성, 염기 및 [15]전이 금속의 존재/가용성 등의 여러 요인에 의해 영향을 받습니다.
열수분출구 내 황산화균
열수분출구는 황화수소를 산소로 산화시켜 황산염이나 [16]황산염을 생성하는 화학석영양균의 탄소고정을 지원하는 황화수소를 배출한다.화학반응은 다음과 같다.
- CO2 + 4 HS2 + O2 → CHO2 + 4 S0 + 3 HO2
- CO2 + HS2 + O2 + HO2 → CHO2 + SO2–
4 + 2+ H
현대 해양에서 티오미로스피라, 할로티오바실루스, 베기아토아는 1차 [16]황산화세균으로 동물 [17]숙주와 화학합성 공생한다.숙주는 공생체에 대사 기질(예: CO2, O2, HO2)을 제공하는 반면, 공생체는 숙주의 대사 활동을 유지하기 위해 유기 탄소를 생성한다.생성된 황산염은 보통 침출된 칼슘 이온과 결합하여 석고를 형성하는데, 이는 근해 중앙 확산 [18]중심부에 광범위한 침전물을 형성할 수 있습니다.
§ S34
25개의 알려진 황 동위원소가 있지만 안정적이고 지구 화학적 중요성을 지닌 동위원소는 4개뿐입니다.이들 4개 중 2개(32S, 빛, S, 무거운 것)는 지구상의 황(99.22%)을 차지한다.황은 대부분(95.02%)이 S로 발생하며, S는 4.21%에 불과하다.이 두 동위원소의 비율은 태양계에서 고정되어 있으며, 태양계가 형성된 이후 계속되어 왔다.지구의 부피가 큰 황 동위원소 비율은 [19]운석인 캐니언 디아블로 트롤라이트(CDT)에서 측정한 22.22의 비율과 같은 것으로 추정된다.이 비율은 국제 표준으로 인정되므로 θ = 0.00으로 설정된다.0.00으로부터의 편차는 δS로34 나타내며, δS는 mill당 비율(θ)이다.양의 값은 S의 수준 증가와 관련이 있는 반면, 음의 값은 표본의 S가 더 큰 것과 관련이 있습니다.
비생물생성공정에 의한 황광물의 형성은 가볍고 무거운 동위원소를 실질적으로 구별하지 못하기 때문에 석고나 바라이트 내 황 동위원소 비율은 강수 시 물기둥 내 전체 동위원소 비율과 동일해야 한다.생물학적 활성을 통한 황산염 환원은 S.[19] 황산염 대사와의 효소 반응이 더 빠르기 때문에 두 동위원소 간의 분화가 심하고 산화 및 환원 주기가 반복되면 최대 -50µ의 값이 된다.현재 평균 해수값 'S34'는 +21'이다.
지질학적 역사를 통해 황 순환과 동위원소 비율은 생물학적으로 구동되는 황산염 감소가 증가함에 따라 생물권이 전반적으로 더 부정적이 되면서 함께 진화해 왔지만, 상당한 양의 편차를 보였다.일반적으로 황 동위원소의 양성 이탈은 육지에 [19]노출된 황화물 광물의 산화가 아니라 황철석 침적이 과도하다는 것을 의미한다.
해양 유황 순환
해양 환경에서의 황 순환은 δS로34 표현되는 황 동위원소 계통학을 통해 잘 연구되어 왔다.현대의 지구 해양은 1.3×[20]10kg의18 유황 저장량을 가지고34 있으며, 주로 δS 값이 +21인 [21]황산염으로 발생한다.전체 입력 플럭스는 1.0×1011 kg/a이며, 황 동위원소 조성은 ~[21]3µ이다.황화물 광물의 육지 풍화(sS34 = +6μ)에서 유래한 황산강은 황이 바다로 유입되는 주요 물질이다.다른 원인으로는 변성 및 화산 탈가스 및 열수 활동(δS34 = 0µ)이 있으며, 이는 환원된 유황 종(HS2, S0 등)을 방출한다.바다에서 나오는 유황의 주요 생산물은 두 가지가 있다.첫 번째 싱크에는 해양 증발물(석고 등) 또는 탄산염10 관련 황산염(CAS)이 매장되어 있으며, 이는 6×10 kg/a(µS34 = +21 µ)를 차지한다.두 번째 유황 제거원은 선반 퇴적물 또는 해저 심층 퇴적물(4×1010 kg/a, µS34 = -20µ)[22]에 황철광 매몰이다.총 해양 유황 배출 플럭스는 1.0×10 kg/a로11 입력 플럭스와 일치하며, 이는 현대의 해양 유황 버젯이 안정적인 [21]상태임을 의미합니다.현대 세계 해양에서 유황의 체류기간은 1300만 [23]년이다.
유황 사이클의 진화
퇴적 황화물의 동위원소 구성은 황 순환의 진화에 대한 일차적인 정보를 제공한다.
지구 표면의 황 화합물 총량(약 10kg의19 유황)은 지질학적 [24][19]시간에 걸친 황의 총 배출량을 나타냅니다.유황 함량에 대해 분석된 암석은 일반적으로 유기물이 풍부한 셰일즈로, 이는 생물유황 감소에 의해 제어될 가능성이 높다는 것을 의미합니다.지질학적 시간에 걸쳐 퇴적된 증발물에서 평균 해수 곡선이 생성되는데, 이는 다시 말해 중황 동위원소와 경황 동위원소를 구별하지 않기 때문에 퇴적 시점의 해양 성분과 유사해야 하기 때문이다.
46억 년 전에 지구가 형성되었고 이론적인 δS34 값은 0이었다.초기 지구에는 생물활동이 없었기 때문에 동위원소 [21]분류는 없을 것이다.대기 중의 모든 유황은 화산 폭발 중에 방출될 것이다.바다가 지구에 응축되었을 때, 대기는 물에 녹는 높은 용해성 때문에 본질적으로 유황 가스를 깨끗이 쓸어내렸다.태고시대(4.6–2.5 Ga)의 대부분에서 대부분의 계는 황산염이 제한적인 것으로 보였다.몇몇 작은 시생대 증발암 퇴적물은 황산염이 과포화되어 용액 [25]밖으로 침전되기 위해 최소한 국소적으로 높은 농도(아마도 국소 화산 활동 때문에)가 존재해야 한다.
3.8–3.6 Ga는 노출된 지질 기록의 시작을 나타낸다. 왜냐하면 이것은 지구에서 가장 오래된 암석의 나이이기 때문이다.생물권이 [26]유황을 분류할 만큼 충분히 개발되지 않았기 때문에 이 시기의 메타세토암은 여전히 동위원소 값이 0이다.
3.5 Ga의 산소원성 광합성이 확립되어 황산염 농도가 놀라울 정도로 낮은 전지구 바다에 약한 황산염원을 제공하며, δS는34 여전히 기본적으로 [25]0이다.잠시 후 3.4 Ga에서 마그마로 유도된 황화물과 관련하여 증발 황산염에서 최소 분화가 이루어졌다는 첫 번째 증거를 암석 기록에서 볼 수 있다.이 분류는 비산소성 광영양 박테리아에 대한 가능한 증거를 보여준다.
2.8 Ga는 광합성을 통한 산소 생성의 첫 번째 증거이다.대기 중에 산소가 없으면 황산화가 일어날 수 없기 때문에 이것은 중요하다.이것은 생물권뿐만 아니라 산소와 유황 순환의 공진화의 예를 보여준다.
2.7–2.5 Ga는 황산염 [25]감소에 대한 첫 번째 설득력 있는 증거를 제공하는 고갈된 δ S를 가진 가장 오래된 퇴적암의 나이이다.
2.3 Ga 황산염은 1mM 이상으로 증가합니다. 이러한 황산염의 증가는 지구 표면의 산화환원 조건이 환원에서 [27]산화로 근본적으로 전환되었다고 대부분의 작업자가 생각하는 "대산소 이벤트"와 일치합니다.이러한 변화는 황산염 풍화의 엄청난 증가로 이어졌을 것이고, 이는 바다에서 황산염의 증가로 이어졌을 것이다.박테리아 감소와 관련된 큰 동위원소 분율이 처음으로 생성되었다.이 시기에 해수 황산염이 뚜렷하게 증가했지만 여전히 현재 [27]수준의 5~15% 미만일 가능성이 높다.
1.8Ga의 띠철층(BIF)은 시생대와 고생대 전반에 걸쳐 흔한 퇴적암으로 바닷물의 화학 작용에 뚜렷한 변화가 있습니다.BIF는 산화철과 섀트의 층을 번갈아 가지고 있습니다.BIF는 용존철(Fe2+)에서 물이 과포화되도록 허용될 경우에만 형성됩니다. 즉, 물기둥에는 유리 산소나 황이 존재할 수 없습니다. 이는 물이 Fe(녹) 또는 황철을 형성하고3+ 용액이 침전되기 때문입니다.이 과포화 후 철이 풍부한 띠가 침전하려면 물이 산소가 되어야 하며, 그렇지 않으면 Fe 대신 황산염이3+ 형성될 수 있습니다.인구증가 단계를 가진 광합성 생물의 초기 진화 과정에서 BIF가 형성되어 산소의 과잉생산을 유발한다는 가설이 있다.이러한 과잉 생산으로 인해 그들은 스스로 독살되어 대량 폐사를 일으킬 것이고, 이로 인해 산소의 원천이 차단되고 몸의 부패를 통해 많은 양의 이산화탄소가2 생성되어 또 다른 박테리아가 번식할 수 있게 될 것이다.1.8 Ga 이후 황산염 농도는 [25]황산염 감소율을 바다에 철의 공급 플럭스보다 크게 증가시키기에 충분했다.
BIF의 소멸과 함께, 고생대 생물의 끝은 또한 광물과 바닷물 속의 황산염 양의 증가 사이의 연관성을 보여주는 최초의 대규모 퇴적물 퇴적물이기도 하다.고생대에서는 바닷물의 황산염이 시생대보다 더 많이 증가했지만, 여전히 현재의 [27]수치보다 낮았다.원생대의 황산염 수치는 또한 산소가 존재하는 대륙의 풍화를 통해 대부분 생성되기 때문에 대기 산소의 대용물 역할을 합니다.원생대의 낮은 수치는 단순히 대기 산소 수치가 Phaneroze의 풍부함과 시생의 부족함 사이에서 떨어졌음을 암시한다.
7억 5천만 년 전(Ma) 해양 화학에 중대한 변화를 나타내는 BIF의 새로운 퇴적물이 있습니다.이것은 바다를 포함한 지구 전체가 산소 공급을 [28]차단하는 얼음 층으로 덮여 있는 눈덩이 같은 지구의 사건 때문일 것이다.후기 신생대 고탄소 매몰률은 대기 산소 수준을 현재 값의 10% 이상으로 증가시켰다.최신 신생물학에서는 지구 표면에서 또 다른 주요한 산화 현상이 발생했는데, 이것은[check spelling] 독성이 있는 심해를 만들어냈고 다세포 [27]생명체의 출현을 가능하게 했을 수도 있다.
지난 6억 년 동안 해수4 SO는 일반적으로 µS34 단위로 +10µ에서 +30µ 사이에서 변화했으며, 평균값은 오늘날과 거의 비슷했다.특히 해수 δS의34 변화는 [29][30][31][32][33][34][35]멸종과 기후 사건 동안 발생했다.
짧은 시간 동안(1천만 년)의 유황 주기 변화는 관찰하기가 더 쉽고 산소 동위원소로 더 잘 제한될 수 있습니다.황산소 산화를 통해 산소가 황순환에 지속적으로 유입되었다가 황산소가 다시 [4]환원될 때 방출된다.바다 내의 다른 황산염 공급원이 뚜렷한 산소 동위원소 값을 가지고 있기 때문에 산소를 사용하여 황 순환을 추적할 수 있을 것이다.생물학적 황산염 환원은 가벼운 황 동위원소가 선호되는 것과 같은 이유로 가벼운 산소 동위원소를 우선적으로 선택한다.지난 1000만[36] 년 동안 해양 퇴적물의 산소 동위원소를 연구함으로써, 같은 시기에 바닷물 속의 유황 농도를 더 잘 억제할 수 있었다.그들은 플리오센과 플레이스토세 빙하 주기에 의한 해수면 변화가 대륙붕의 면적을 변화시켰으며 이는 유황 처리를 방해하여 바닷물의 황산염 농도를 낮춘다는 것을 발견했다.이것은 2백만 년 전의 빙하기 이전과 비교하면 급격한 변화였다.
대산화 현상과 황 동위원소 질량비의존적 분화
GOE(Great Oxitiation Event)는 약 24억5000만 년 전의 퇴적물 기록에서 유황 동위원소 질량 독립 분획(MIF)이 사라진 것이 특징이다.[37]황 동위원소 δS의33 MIF는 질량 의존분획법에 따라 측정된 δS3334 값과 측정된 δS33 값의 편차로 정의된다.산화 대사건은 전지구 유황 순환의 거대한 변화를 상징한다.대산화이벤트 이전에는 유황 사이클이 자외선(UV) 방사선과 관련된 광화학 반응에 크게 영향을 받아 유황 동위원소 질량비의존분획(δS33 0 0)을 유도했다.황 동위원소 질량 비의존 분획 신호를 보존하려면 현재 대기 수준(PAL)[24]의 10보다 낮은−5 대기2 O가 필요하다.황 동위원소 질량 비의존적 분화가 약 2.45 Ga에서 사라진 것은 대기2 pO가 대산소 이벤트 [37]이후 현재 대기 레벨 10을 초과했음을−5 의미한다.산소는 황화물의 [38]산화적 풍화 등 대산소화 사건 이후 지구 유황 순환에 필수적인 역할을 했다.황철광의 퇴적물 매몰은 지구 표면 환경에서 [39]유리 O의2 축적을 야기한다.
경제적 중요성
황은 산화제나 환원제 역할을 하기 때문에 화석 연료와 금속 퇴적물의 생산에 밀접하게 관여한다.지구상의 주요 광상의 대부분은 퇴적 발기 퇴적물(SEDEX), 탄산염 호스트형 납-아연 광상(미시시피 밸리-타입 MVT) 및 포르피리 구리 퇴적물을 포함하지만 이에 한정되지는 않습니다.황화철, 갈레나 및 스팔레라이트는 각각의 전이 또는 비금속들이 존재하거나 황산염 환원 [7]사이트로 운반되는 한 황화수소 생성의 부산물로 형성됩니다.시스템에 반응성 탄화수소가 소진되면 경제적으로 사용할 수 있는 원소 유황 침전물이 형성될 수 있습니다.황은 또한 많은 천연 가스 저장고에서 환원제 역할을 하며 일반적으로 광석 형성 유체는 고대 탄화수소 침출구 [27]또는 환기구와 밀접한 관계를 가지고 있습니다.
광상의 유황의 중요한 공급원은 일반적으로 깊이 자리 잡고 있지만, 그것들은 또한 지역의 바위, 바닷물 또는 해양 증발기에서 나올 수 있습니다.황의 유무는 귀금속 농도와 용액의 침전에 대한 제한 요인 중 하나이다. pH, 온도, 특히 산화환원 상태는 황화물의 침전 여부를 결정한다.대부분의 황화물 염수는 환원 조건, 높은 pH 또는 낮은 온도에 도달할 때까지 농도를 유지합니다.
광석 유체는 일반적으로 확장 구조 환경에서 높은 열 조건 하에서 퇴적 분지 내에서 가열된 금속이 풍부한 물과 연결됩니다.유역 암석의 산화환원 조건은 금속 수송 유체의 산화환원 상태에 중요한 제어를 하며 [27]유체의 산화환원으로부터 침전물이 형성될 수 있다.금속이 풍부한 광석액은 필연적으로 황화물이 부족한 경향이 있기 때문에 상당부분은 다른 광원으로부터 광물을 공급받아야 한다.황화물의 필수 공급원은 해수 황산염 또는 oxinic(무독성 및 HS2 함유) 물기둥의 세균 환원이다.바라이트의 δS34 값은 일반적으로 바닷물 황산염원과 일치하며, 주변 [27]바닷물 중 열수성 바륨과 황산염의 반응에 의한 바리테 형성을 시사한다.
일단 화석 연료나 귀금속이 발견되고 연소되거나 제분되면, 유황은 적절하게 처리되어야 하는 폐기물이 되거나 오염물질이 될 수 있다.화석연료의 연소로 인해 현재의 대기 중 유황의 양이 크게 증가했다.유황은 오염물질과 경제적 자원의 역할을 동시에 한다.
인체에 미치는 것
인간의 활동은 지구의 유황 순환에 큰 영향을 미친다.석탄, 천연가스, 그리고 다른 화석연료의 연소는 대기와 해양의 유황의 양을 크게 증가시켰고 퇴적암 싱크대를 고갈시켰다.인간의 충격이 없다면 유황은 지각 현상을 통해 떠오르고 침식과 풍화 과정을 통해 방출될 때까지 수백만 년 동안 바위에 묶여 있을 것이다.그 대신 드릴로 구멍을 뚫고 펌프로 펌핑하고 연소하는 속도가 꾸준히 증가하고 있습니다.가장 오염된 지역에서 황산염 [40]퇴적량이 30배나 증가했습니다.
황 곡선은 지질학적 과거 순황 산화와 순황 감소 사이의 변화를 보여주지만, 현재의 인간 영향의 규모는 지질학적 기록상 전례가 없을 것이다.인간의 활동은 대기로의 유황의 흐름을 크게 증가시키고, 그 중 일부는 전 세계로 운반된다.인간은 석탄을 채굴하고 지구의 지각에서 석유를 추출하고 있는데, 이는 100년 [41]전에 비해 두 배 이상 빠른12 150 x 10 gS/r를 동원하는 속도이다.이러한 과정에 대한 인간의 영향의 결과는 지구 지각에 감소된 유황의 저장고를 희생시키면서 지구 순환에서 산화4 황(SO)의 풀을 증가시킵니다.따라서, 인간의 활동은 전지구적인 유황 웅덩이에 큰 변화를 일으키지는 않지만,[19] 대기 중의 유황의 연간 플럭스에 큰 변화를 일으킨다.
대기 오염물질로 SO가2 배출되면 대기 중의 물과 반응하여 황산을 형성한다.산이 물에서 완전히 분리되면 pH가 4.3 이하로 떨어져 인공 시스템과 자연 시스템 모두에 손상을 줄 수 있습니다.EPA에 따르면 산성비는 질산과 황산이 정상보다 많이 함유된 대기 중 습식 퇴적물과 건식 퇴적물의 혼합물을 말한다.이산화탄소를 포함하지 않는 증류수(용존성분이 없는 물)의 pH는 7이다. 비는 이산화탄소와 공기 중의 물이 반응하여 매우 약한 산인 탄산을 생성하기 때문에 자연적으로 약산성 pH가 5.6이다.하지만 워싱턴 D.C. 주변의 평균 강우량은 4.2에서 4.4 사이이다.pH가 로그 척도에 있으므로(일반 빗물과 산성비의 차이) 산의 강도에 극적인 영향을 미칩니다.미국에서는 약2 3분의 2의 SO와 4분의3 1의 NO가 석탄과 같은 화석연료의 연소에 의존하는 발전에서 나온다.
유황은 식물의 중요한 영양소이기 때문에 비료의 성분으로 많이 사용되고 있습니다.최근 유럽의 [42][43][44]많은 나라에서 유황 결핍이 널리 퍼지고 있다.산성비의 대기 중 유황 투입량을 제한하기 위한 조치 때문에 유황 비료를 [45][46]사용하지 않는 한 유황 투입량 부족이 증가할 가능성이 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c Madigan MT, Martino JM (2006). Brock Biology of Microorganisms (11th ed.). Pearson. p. 136. ISBN 978-0-13-196893-6.
- ^ Bickle MJ, Alt JC, Teagle DA (1994). "Sulfur transport and sulphur isotope fractionations in ocean floor hydrothermal systems". Mineralogical Magazine. 58A (1): 88–89. Bibcode:1994MinM...58...88B. doi:10.1180/minmag.1994.58A.1.49.
- ^ Poore J, Nemecek T (June 2018). "Reducing food's environmental impacts through producers and consumers". Science. 360 (6392): 987–992. Bibcode:2018Sci...360..987P. doi:10.1126/science.aaq0216. PMID 29853680.
- ^ a b Turchyn, Alexandra V. (2005). Oxygen isotopes in marine sulfate and the sulfur cycle over the last 140 million years (PhD). Harvard University. 3174055.
- ^ Reheis MC, Kihl R (May 1995). "Dust deposition in southern Nevada and California, 1984–1989: Relations to climate, source area, and source lithology". Journal of Geophysical Research: Atmospheres. 100 (D5): 8893–8918. Bibcode:1995JGR...100.8893R. doi:10.1029/94JD03245.
- ^ a b c d Machel HG, Krouse HR, Sassen R (1995). "Products and distinguishing criteria of bacterial and thermochemical sulfate reduction". Applied Geochemistry. 10 (4): 373–389. Bibcode:1995ApGC...10..373M. doi:10.1016/0883-2927(95)00008-8.
- ^ a b c d e Machel HG (2001). "Bacterial and thermochemical sulfate reduction in diagenetic settings — old and new insights". Sedimentary Geology. 140 (1–2): 143–175. Bibcode:2001SedG..140..143M. doi:10.1016/S0037-0738(00)00176-7.
- ^ Barton L (1995). Sulfate-reducing bacteria. New York: Plenum Press. ISBN 0-306-44857-2. OCLC 32311676.
- ^ Jørgensen BB, Isaksen MF, Jannasch HW (December 1992). "Bacterial Sulfate Reduction Above 100{degrees}C in Deep-Sea Hydrothermal Vent Sediments". Science. 258 (5089): 1756–1757. doi:10.1126/science.258.5089.1756. PMID 17831655. S2CID 129371120.
- ^ Aharon P, Fu B (2000). "Microbial sulfate reduction rates and sulfur and oxygen isotope fractionations at oil and gas seeps in deepwater Gulf of Mexico". Geochimica et Cosmochimica Acta. 64 (2): 233–246. Bibcode:2000GeCoA..64..233A. doi:10.1016/S0016-7037(99)00292-6.
- ^ Goldstein TP, Aizenshtat Z (1994). "Thermochemical sulfate reduction a review". Journal of Thermal Analysis. 42 (1): 241–290. doi:10.1007/BF02547004. ISSN 0368-4466. S2CID 95526523.
- ^ Krouse HR, Viau CA, Eliuk LS, Ueda A, Halas S (1988). "Chemical and isotopic evidence of thermochemical sulphate reduction by light hydrocarbon gases in deep carbonate reservoirs". Nature. 333 (6172): 415–419. Bibcode:1988Natur.333..415K. doi:10.1038/333415a0. ISSN 0028-0836. S2CID 4354648.
- ^ Muyzer G, Stams AJ (June 2008). "The ecology and biotechnology of sulphate-reducing bacteria". Nature Reviews. Microbiology. 6 (6): 441–454. doi:10.1038/nrmicro1892. PMID 18461075. S2CID 22775967.
- ^ Jørgensen BB (1982). "Mineralization of organic matter in the sea bed—the role of sulphate reduction". Nature. 296 (5858): 643–645. Bibcode:1982Natur.296..643J. doi:10.1038/296643a0. ISSN 0028-0836. S2CID 4308770.
- ^ Holmer M, Storkholm P (2001). "Sulphate reduction and sulphur cycling in lake sediments: a review". Freshwater Biology. 46 (4): 431–451. doi:10.1046/j.1365-2427.2001.00687.x. ISSN 0046-5070.
- ^ a b Sievert SM, Hügler M, Taylor CD, Wirsen CO (2008). Dahl C, Friedrich CG (eds.). "Sulfur Oxidation at Deep-Sea Hydrothermal Vents". Microbial Sulfur Metabolism. Springer Berlin Heidelberg: 238–258. doi:10.1007/978-3-540-72682-1_19. ISBN 978-3-540-72679-1.
- ^ Klotz MG, Bryant DA, Hanson TE (2011). "The microbial sulfur cycle". Frontiers in Microbiology. 2: 241. doi:10.3389/fmicb.2011.00241. PMC 3228992. PMID 22144979.
- ^ Pedersen RB, Rapp HT, Thorseth IH, Lilley MD, Barriga FJ, Baumberger T, et al. (November 2010). "Discovery of a black smoker vent field and vent fauna at the Arctic Mid-Ocean Ridge". Nature Communications. 1 (8): 126. Bibcode:2010NatCo...1..126P. doi:10.1038/ncomms1124. PMC 3060606. PMID 21119639.
- ^ a b c d e Schlesinger WH (1997). Biogeochemistry an analysis of global change (2nd ed.). San Diego, California: Academic Press. ISBN 9780126251555.
- ^ Brimblecombe P (2014). "The global sulfur cycle". Treatise on Geochemistry. Vol. 10. Amsterdam: Elsevier. pp. 559–591. doi:10.1016/B978-0-08-095975-7.00814-7. ISBN 9780080983004.
- ^ a b c d Fike DA, Bradley AS, Rose CV (2015). "Rethinking the Ancient Sulfur Cycle". Annual Review of Earth and Planetary Sciences. 43 (1): 593–622. Bibcode:2015AREPS..43..593F. doi:10.1146/annurev-earth-060313-054802. S2CID 140644882.
- ^ Canfield DE (2004). "The evolution of the Earth surface sulfur reservoir". American Journal of Science. 304 (10): 839–861. Bibcode:2004AmJS..304..839C. doi:10.2475/ajs.304.10.839.
- ^ Kah LC, Lyons TW, Frank TD (October 2004). "Low marine sulphate and protracted oxygenation of the Proterozoic biosphere". Nature. 431 (7010): 834–838. Bibcode:2004Natur.431..834K. doi:10.1038/nature02974. PMID 15483609. S2CID 4404486.
- ^ a b Johnston DT (2011). "Multiple sulfur isotopes and the evolution of Earth's surface sulfur cycle". Earth-Science Reviews. 106 (1–2): 161–183. Bibcode:2011ESRv..106..161J. doi:10.1016/j.earscirev.2011.02.003.
- ^ a b c d Canfield DE, Raiswell R (1999). "The evolution of the sulfur cycle". American Journal of Science. 299 (7–9): 697–723. Bibcode:1999AmJS..299..697C. doi:10.2475/ajs.299.7-9.697.
- ^ Schidlowski M, Hayes JM, Kaplan IR (1983). "Isotopic inferences of ancient biochemistries-Carbon, sulfur, hydrogen, and nitrogen.". In Schopf JW (ed.). Earth's Earliest Biosphere. Princeton, New Jersey: Princeton University Press.
- ^ a b c d e f g Lyons TW, Gellatly AM, McGoldrick PJ, Kah LC (2006). "Proterozoic sedimentary exhalative (SEDEX) deposits and links to evolving global ocean chemistry". In Kesler SE, Ohmoto H (eds.). Evolution of Early Earth's Atmosphere, Hydrosphere, and Biosphere—Constraints from Ore Deposits. Geological Society of America Memoir. Vol. 198. pp. 169–184. ISBN 978-0-8137-1198-0.
- ^ Hoffman PF, Kaufman AJ, Halverson GP, Schrag DP (August 1998). "A neoproterozoic snowball earth". Science. 281 (5381): 1342–1346. Bibcode:1998Sci...281.1342H. doi:10.1126/science.281.5381.1342. PMID 9721097. S2CID 13046760.
- ^ Gill BC, Lyons TW, Young SA, Kump LR, Knoll AH, Saltzman MR (January 2011). "Geochemical evidence for widespread euxinia in the later Cambrian ocean". Nature. 469 (7328): 80–83. Bibcode:2011Natur.469...80G. doi:10.1038/nature09700. PMID 21209662. S2CID 4319979.
- ^ John EH, Wignall PB, Newton RJ, Bottrell SH (August 2010). "δ34SCAS and δ18OCAS records during the Frasnian–Famennian (Late Devonian) transition and their bearing on mass extinction models". Chemical Geology. 275 (3–4): 221–234. Bibcode:2010ChGeo.275..221J. doi:10.1016/j.chemgeo.2010.05.012.
- ^ Newton RJ, Pevitt EL, Wignall PB, Bottrell SH (February 2004). "Large shifts in the isotopic composition of seawater sulphate across the Permo–Triassic boundary in northern Italy". Earth and Planetary Science Letters. 218 (3–4): 331–345. Bibcode:2004E&PSL.218..331N. doi:10.1016/S0012-821X(03)00676-9.
- ^ Gill BC, Lyons TW, Jenkyns HC (December 2011). "A global perturbation to the sulfur cycle during the Toarcian Oceanic Anoxic Event". Earth and Planetary Science Letters. 312 (3–4): 484–496. Bibcode:2011E&PSL.312..484G. doi:10.1016/j.epsl.2011.10.030.
- ^ Paytan, A. (1998-11-20). "Sulfur Isotopic Composition of Cenozoic Seawater Sulfate". Science. 282 (5393): 1459–1462. doi:10.1126/science.282.5393.1459. PMID 9822370.
- ^ Paytan, A. (2004-06-11). "Seawater Sulfur Isotope Fluctuations in the Cretaceous". Science. 304 (5677): 1663–1665. Bibcode:2004Sci...304.1663P. doi:10.1126/science.1095258. ISSN 0036-8075. PMID 15192227. S2CID 10539452.
- ^ Owens JD, Gill BC, Jenkyns HC, Bates SM, Severmann S, Kuypers MM, et al. (November 2013). "Sulfur isotopes track the global extent and dynamics of euxinia during Cretaceous Oceanic Anoxic Event 2". Proceedings of the National Academy of Sciences of the United States of America. 110 (46): 18407–18412. Bibcode:2013PNAS..11018407O. doi:10.1073/pnas.1305304110. PMC 3831968. PMID 24170863.
- ^ 타이친 등(2004) 불완전한 참조
- ^ a b Farquhar J, Bao H, Thiemens M (August 2000). "Atmospheric influence of Earth's earliest sulfur cycle". Science. 289 (5480): 756–759. Bibcode:2000Sci...289..756F. doi:10.1126/science.289.5480.756. PMID 10926533. S2CID 12287304.
- ^ Konhauser KO, Lalonde SV, Planavsky NJ, Pecoits E, Lyons TW, Mojzsis SJ, et al. (October 2011). "Aerobic bacterial pyrite oxidation and acid rock drainage during the Great Oxidation Event". Nature. 478 (7369): 369–373. Bibcode:2011Natur.478..369K. doi:10.1038/nature10511. PMID 22012395. S2CID 205226545.
- ^ Berner RA, Raiswell R (1983). "Burial of organic carbon and pyrite sulfur in sediments over phanerozoic time: a new theory". Geochimica et Cosmochimica Acta. 47 (5): 855–862. Bibcode:1983GeCoA..47..855B. doi:10.1016/0016-7037(83)90151-5.
- ^ Pham M, Müller JF, Brasseur GP, Granier C, Mégie G (May 1996). "A 3D model study of the global sulphur cycle: Contributions of anthropogenic and biogenic sources". Atmospheric Environment. 30 (10–11): 1815–1822. Bibcode:1996AtmEn..30.1815P. doi:10.1016/1352-2310(95)00390-8.
- ^ Brimblecombe P, Hammer C, Rodhe H, Ryaboshapko A, Boutron CF (1989). "Human Influences on the sulphur cycle.". In Brimblecombe P, Lein AY (eds.). Evolution of the Global Biogeochemical Sulphur Cycle. New York: Wiley. pp. 77–121. ISBN 978-0-471-92251-3.
- ^ Zhao F, Hawkesford M, McGrath SP (1999). "Sulphur Assimilation and Effects on Yield and Quality of Wheat". Journal of Cereal Science. 30 (1): 1–17. doi:10.1006/jcrs.1998.0241.
- ^ Blake-Kalff MM (2000). "Diagnosing sulfur deficiency in field-grown oilseed rape (Brassica napus L.) and wheat (Triticum aestivum L.)". Plant and Soil. 225 (1−2): 95–107. doi:10.1023/A:1026503812267. S2CID 44208638.
- ^ Ceccotti SP (1996). "Plant nutrient sulphur—a review of nutrient balance, environmental impact and fertilizers". Fertilizer Research. 43 (1–3): 117–125. doi:10.1007/BF00747690. S2CID 42207099.
- ^ Glossary, United States: NASA Earth Observatory, acid rain, archived from the original on December 13, 2011, retrieved February 15, 2013
- ^ 비료로서의 유황.Sulphurinstitute.org 를 참조해 주세요.2012년 8월 16일에 취득.