바스카 콤플렉스
Vaska's complex | |
 | |
 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 (SP-4-1)-카르보닐클로로비디스(트리페닐인산)아이리듐(I) | |
| 기타 이름 이리듐(I)비스(트리페닐인산염) 염화 카보닐 바스카 콤플렉스 바스카 화합물 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.035.386 |
| EC 번호 |
|
펍켐 CID |
|
| |
| |
| 특성. | |
| IrCl(CO)[P(C6H5)3]2. | |
| 어금질량 | 780.25 g/mb |
| 외관 | 황색 결정체 |
| 녹는점 | 215°C(419°F, 488K) (손상) |
| 비등점 | 360°C(680°F, 633K) |
| 건방진 | |
| 구조 | |
| 제곱 평면 | |
| 위험 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 | 없는 |
| GHS 라벨 표시: | |
  | |
| 위험 | |
| H301, H302, H311, H312, H315, H319, H331, H332, H335 | |
| P261, P264, P270, P271, P280, P301+P310, P301+P312, P302+P352, P304+P312, P304+P340, P305+P351+P338, P311, P312, P321, P322, P330, P332+P313, P337+P313, P361, P362, P363, P403+P233, P405, P501 | |
| 관련 화합물 | |
기타 음이온 | 이리(CO)[P(CH65)]32 |
기타 양이온 | RhCl(CO)[P(C6H5)3]2 |
관련 화합물 | Pd[P(C6H5)3]4 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
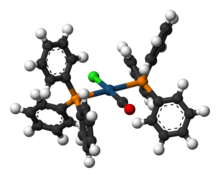
바스카의 콤플렉스는 IrCl(CO)[P(CH65)]32라는 공식을 가진 화학성분 트랜스 카르보닐클로로비스(트리페닐인산)iridium(I)의 사소한 이름이다. 이 정사각형 평면 직경 유기체 단지는 중앙 이리듐 원자로 구성되어 있으며, 상호 교차 트리페닐인산인산 리간드, 일산화탄소 및 염화 이온 2개에 결합되어 있다. 이 단지는 1961년 J. W. DiLuzio와 Lauri Vaska에 의해 처음 보고되었다.[1] 바스카의 콤플렉스는 산화적 덧셈을 겪을 수 있으며 O에2 역행적으로 결합하는 능력이 돋보인다. 그것은 밝은 노란색 결정체 고체다.
준비
합성에는 거의 모든 이리듐 염화염소금을 트리페닐인산염과 일산화탄소 공급원으로 가열하는 것이 포함된다. 가장 인기 있는 방법은 디메틸포름아미드(DMF)를 용매로 사용하며, 때로는 아닐린(aniline)을 첨가해 반응을 가속화하기도 한다. 또 다른 인기 용제는 2메톡시네탄올이다. 그 반응은 전형적으로 질소하에서 행해진다. 합성에서, 트리페닐인산염은 리간드와 환원제 역할을 하며, 카보닐 리간드는 아마도 중간 Ir-C(O)H 종의 디삽입을 통해 디메틸포름아미드의 분해에 의해 유도된다. 다음은 이 복잡한 반응에 대해 가능한 균형 방정식이다.[2]
- IrCl3(HO2)3 + 3 P(CH65)3 + HCON(CH3)2 + CHNH652 → IrCl(CO)[P(CH65)]322 + [CHNH32]Cl + OP(CH65)3 + [CHNH653]Cl + 2 HO2
이 준비물에 사용되는 이리듐의 대표적인 공급원은 IrCl3·xHO와2 HIrCl이다26.
반응
Vaska의 복합체에 대한 연구는 동질 촉매에 대한 개념적 프레임워크를 제공하는 데 도움이 되었다. 바스카의 콤플렉스는 16개의 발란스 전자를 가진 것으로 "조화적으로 불포화"된 것으로 간주되어, 따라서 1개의 2전자 또는 2개의 1전자 리간드에 결합하여 18개의 발란스 전자로 전자적으로 포화될 수 있다. 1전자 리간드 2개를 더하는 것을 산화 첨가라고 한다.[3] 산화 첨가 시 이리듐의 산화 상태는 Ir(I)에서 Ir(III)로 증가한다. 시작단지의 네 개의 조정된 사각 평면 배치는 팔면, 여섯 개의 조정된 제품으로 전환된다. 바스카의 콤플렉스는 할로겐과 같은 재래식 산화제, HCl과 같은 강산, 그리고 요오드메탄(CI3)과 같은 전기생성 물질로 반응하는 것으로 알려진 다른 분자들과 함께 산화적 첨가 과정을 거친다.
Vaska의 콤플렉스는 O를2 역방향으로 묶는다.
- IrCl(CO)[P(C6H5)3]2 + O2 ⇌ IrCl(CO)[P(C6H5)3]2O2
다이옥시겐 리간드는 측면 접합이라고 불리는 두 산소 원자에 의해 Ir에 결합된다. 반면 미오글로빈과 헤모글로빈에서는 O가2 두 개의 산소 원자 중 하나만 통해 금속과 결합하면서 엔드온으로 결합한다. 결과 다이옥시겐 인덕트는 주황색에서 황색으로 색상 변화에 의해 신호를 받은 불활성 가스로 용액을 가열하거나 퍼징할 때 모체 복합체로 되돌아간다.[2]
분광학
적외선 분광법은 바스카 콤플렉스에 산화물이 첨가된 것을 분석하는데 사용될 수 있는데, 그 반응은 조정된 일산화탄소의 스트레칭 주파수의 특성 변화를 유도하기 때문이다.[4] 이러한 변화는 새로 연결된 리간드가 허용하는 π-백 본딩의 양에 따라 달라진다. 바스카의 복잡하고 산화적으로 첨가된 리간드에 대한 CO 스트레칭 주파수는 문헌에 기록되어 있다.[5]
- 바스카 콤플렉스: 1967 cm−1
- 바스카 콤플렉스 + O2: 2015 cm−1
- 바스카 콤플렉스 + MeI: 2047cm−1
- 바스카 콤플렉스 + I: 2067cm2−1
Ir(III) 제품을 주는 산화성 첨가제는 π 본딩을 Ir에서 C로 줄여 카보닐 스트레칭 밴드의 빈도를 증가시킨다. 스트레칭 주파수 변경은 추가된 리간드에 따라 다르지만 Ir(III) 복합체의 경우 항상 주파수가 2000cm−1 이상이다.
역사
IrCl(CO)(PPH3)2에 대한 가장 초기의 언급은 바스카와 디루지오에 의한 것이다.[6] 밀접하게 연관된 IrBr(CO)(PPH3)2은 1959년 마리아 안골레타에 의해 설명되었는데, 그는 아세톤 용액에서 IrBr(2CO)(p-toluidine)을 PPh로3 처리하여 콤플렉스를 준비했다.[7] 1957년에 린다 발레리노는 RhCl(CO3)을 보고했었다.2[8]
참조
- ^ Lauri Vaska; J. W. DiLuzio (1961). "Carbonyl and Hydrido-Carbonyl Complexes of Iridium by Reaction with Alcohols. Hydrido Complexes by Reaction with Acid". Journal of the American Chemical Society. 83 (12): 2784–2785. doi:10.1021/ja01473a054.
- ^ a b Girolami, G.S.; Rauchfuss, T.B.; Angelici, R.J. (1999). Synthesis and Technique in Inorganic Chemistry (3rd ed.). Sausalito, CA: University Science Books. p. 190. ISBN 0-935702-48-2.
- ^ Labinger, Jay A. (2015). "Tutorial on Oxidative Addition". Organometallics. 34 (20): 4784–4795. doi:10.1021/acs.organomet.5b00565.
- ^ Lauri Vaska; DiLuzio, J. W. (1962). "Activation of Hydrogen by a Transition Metal Complex at Normal Conditions Leading to a Stable Molecular Dihydride". Journal of the American Chemical Society. 84 (4): 679–680. doi:10.1021/ja00863a040.
- ^ Crabtree, R. (2001). The Organometallic Chemistry of the Transition Metals (3rd ed.). Canada: John Wiley & Sons. p. 152.
- ^ Rein U. Kirss (2013). "Fifty Years of Vaska's Compound". Bull. Hist. Chem. 38.
- ^ Maria Angoletta (1959). "Derivati carbonilici dell'iridio.-Nota III. Alogenuri di dicarbonilamminoiridio(I)". Gazzetta chimica Italiano. 89: 2359–2370.
- ^ Vallarino, L. (1957). "Carbonyl Complexes of Rhodium. I. Complexes with Triarylphosphines, Triarylarsines, and Triarylstibines". Journal of the Chemical Society: 2287–92. doi:10.1039/jr9570002287.


