3'-포스포아데노신-5'-포스포설페이트
3'-Phosphoadenosine-5'-phosphosulfate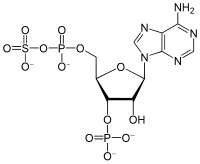 | |
| 이름 | |
|---|---|
| IUPAC 이름 3'-O-포스포노-5'-아데닐릴 황산수소 | |
| 체계적 IUPAC 이름 [(2R,3S,4R,5R)-5-(6-Amino-9H-purin-9-yl)-4-hydroxy-3-(phosphonooxy)oxolan-2-yl]methyl hydrogen (sulfooxy)phosphonate | |
| 기타이름 PAPS 3'-포스포아데닐릴설페이트 포스포아데노신인산 3'-포스포-5'-아데닐릴 황산염 | |
| 식별자 | |
3D 모델(Jsmol) | |
| 약어 | PAPS |
| ChEBI | |
| 켐스파이더 | |
| ECHA 인포카드 | 100.222.927 |
| EC 번호 |
|
| KEGG | |
펍켐 CID | |
| 유니아이 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C10H15N5O13P2S | |
| 어금니 질량 | 507.266 |
달리 명시된 경우를 제외하고는 표준 상태(25°C [77°F], 100kPa)에 있는 재료에 대한 데이터가 제공됩니다. | |
3'-포스포아데노신-5'-포스포설페이트(PAPS)는 3' 위치에서 인산화되고 5' 인산에 황산기가 부착된 아데노신 일인산(AMP)의 유도체입니다. 술포트랜스퍼라제 반응에서 가장 흔한 조효소이며, 따라서 술포트랜스퍼라제의 일부입니다.[1] 그것은 중간 대사 물질인 아데노신 5'-포스포설페이트(APS)의 인산화를 통해 유기체에 의해 내생적으로 합성됩니다.[2] 인간에서 이러한 반응은 ATP를 인산 공여체로 사용하는 2관능 3'-포스포아데노신 5'-포스포설페이트 합성효소(PAPSS1 및 PAPSS2)에 의해 수행됩니다.[3][4]
형성 및 축소
APS와 PAPS는 황산염 환원 박테리아에 의해 수행되는 발열 전환인 아황산염으로의 황산염 환원의 중간체입니다. 이들 유기체에서 황산염은 호기성 유기체가 O를2 전자 수용체로 사용하는 것과 유사하게 전자 수용체 역할을 합니다. 황산염은 직접 환원되지 않고 APS 또는 PAPS의 형성에 의해 활성화되어야 합니다. 활성화된 황산염의 이러한 운반체는 ATP와의 반응에 의해 생성됩니다. 첫 번째 반응은 ATP 설퓨릴라제에 의해 촉매됩니다.
- SO + ATP ⇌ APS + PP
APS에서 PAPS로의 전환은 APS 키나제에 의해 촉매됩니다.
- APS + ATP ⇌ PAPS + ADP

APS의 감소는 아황산염으로 이어지는데, 아황산염은 다시 황화수소로 환원되어 배설됩니다. 이 과정을 해리성 황산염 환원이라고 합니다. 더욱 정교한 황산에스테르인 PAPS의 환원은 황화수소로도 이어집니다. 그러나 이 경우 생성물은 생합성, 예를 들어 시스테인 생산에 사용됩니다. 후자의 과정을 황산염이 동화되기 때문에 동화적 황산염 환원이라고 합니다.[5]
참고문헌
- ^ Günal S; Hardman R; Kopriva S; Mueller JW (2019). "Sulfation pathways from red to green". J. Biol. Chem. 294 (33): 12293–12312. doi:10.1074/jbc.REV119.007422. PMC 6699852. PMID 31270211.
- ^ Negishi M; Pedersen LG; Petrotchenko E; et al. (2001). "Structure and function of sulfotransferases". Arch. Biochem. Biophys. 390 (2): 149–57. doi:10.1006/abbi.2001.2368. PMID 11396917.
- ^ Xu, Zhen-Hua; Otterness, Diane M.; Freimuth, Robert R.; Carlini, Edward J.; Wood, Thomas C.; Mitchell, Steve; Moon, Eunpyo; Kim, Ung-Jin; Xu, Jing-Ping; Siciliano, Michael J.; Weinshilboum, Richard M. (February 2000). "Human 3′-Phosphoadenosine 5′-Phosphosulfate Synthetase 1 (PAPSS1) and PAPSS2: Gene Cloning, Characterization and Chromosomal Localization". Biochemical and Biophysical Research Communications. 268 (2): 437–444. doi:10.1006/bbrc.2000.2123. PMID 10679223.
- ^ Venkatachalam, K. V. (2003). "Human 3′-phosphoadenosine 5′-phosphosulfate (PAPS) synthase: Biochemistry, molecular biology and genetic deficiency". IUBMB Life. 55 (1): 1–11. doi:10.1080/1521654031000072148. PMID 12716056. S2CID 37733913.
- ^ M. T. Madigan, J. M. Martinko, J. Parker "미생물의 블록 생물학" 프렌티스 홀, 1997. ISBN 0-13-520875-0.

