오토레셉터
Autoreceptor자동수용기는 사전 시냅스 신경세포의 막에 위치한 수용기의 일종이다.그것은 신호 전달에서 음성 피드백 루프의 일부 역할을 한다.그것은 오직 자동수용기가 앉아 있는 뉴런에 의해 분비되는 신경전달물질이나 호르몬에 민감할 뿐이다.마찬가지로 이질감각제는 자신이 앉아 있는 세포에 의해 분비되지 않는 신경전달물질과 호르몬에 민감하다.주어진 수용체는 그것이 내장된 셀에 의해 방출되는 송신기의 유형에 따라 자동수용체 또는 이질수용체 역할을 할 수 있다.
자동수용기는 덴드라이트, 셀 본체, 액손 또는 액손 단자의 세포막의 어떤 부분에 위치할 수 있다.[1]
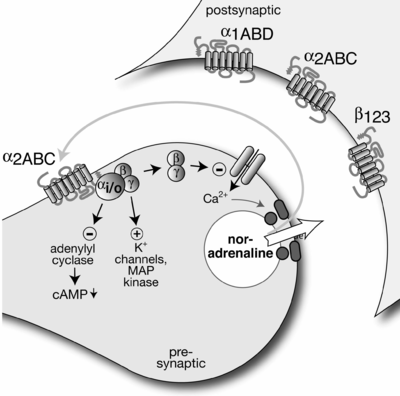
시냅스 전 뉴런은 시냅스 구획에 걸쳐 신경전달물질을 방출하여 시냅스 후 뉴런에서 수용체에 의해 검출된다.사전 시냅스 뉴런의 자동수용체도 이 신경전달물질을 감지하고 내부 세포 과정을 제어하는 기능을 하는 경우가 많으며, 일반적으로 신경전달물질의 추가 방출이나 합성을 억제한다.따라서 신경전달물질의 방출은 부정적인 피드백에 의해 조절된다.오토레셉터는 보통 (전송기 게이트 이온 채널이 아닌) G단백질 결합 수용체로서 두 번째 메신저를 통해 작용한다.[2]
예
예를 들어 교감 뉴런에서 방출된 노레피네프린은 알파-2A 및 알파-2C 아드레날린 수용체와 상호작용하여 노레피네프린의 추가 방출을 억제할 수 있다.마찬가지로 부교감 뉴런에서 방출되는 아세틸콜린은 더 이상의 아세틸콜린의 방출을 억제하기 위해 M2 및 M4 수용체와 상호작용할 수 있다.비정상적인 예는 송신기 방출을 증가시키는 작용을 하는 교감 주변 신경계의 β-아드레날린 자동수용기에 의해 제시된다.[1]
D2sh 자동수용기는 최근 뇌 내 모노아민성계를 조절하기 위해 G-커플링 단백질 수용체 GPCR인 추적아민성결합수용체 1(TAAR1)과 상호작용하는 것으로 나타났다.[3]활성 TAAR1은 도파민 트랜스포터(DAT)를 비활성화하여 자동 감지기의 활동에 반대한다.[4]모노아민성 시스템의 TAAR1에 대한 검토에서, 시냅스 도파민이 DAT를 활성화시키는 도파민 자동수용기에 결합하는 도표계를 제안했다.도파민은 사전 시냅스 세포에 들어가 아데닐 시클라아제 활성을 증가시키는 TAAR1과 결합한다.이를 통해 결국 세포질 내 미량아민의 변환과 주기적인 뉴클레오티드 이온 채널의 활성화가 가능해져 TAAR1을 더욱 활성화하고 도파민을 시냅스에 덤프할 수 있다.PKA 및 PKC와 관련된 일련의 인산화 이벤트를 통해 활성 TAAR1은 DAT를 비활성화하여 시냅스에서 도파민이 흡수되는 것을 방지한다.[5]모노아민 전달 기능을 조절하는 역기능을 가진 두 개의 시냅스 후 수용체가 존재하면 모노아민계통 조절이 가능하다.
자동 수신기 활동은 또한 쌍체 펄스 촉진(PPF)을 감소시킬 수 있다.[citation needed]피드백 셀은 (부분적으로) 분극화된 후 시냅스 뉴런에 의해 활성화된다.피드백 셀은 신경전달물질을 방출하는데, 이 신경전달물질은 사전 시냅스 뉴런의 자동수용체가 수용성이 있다.자동수용기는 칼슘 채널의 억제(칼슘 이온 유입을 느리게 함)와 사전 시냅스 막에서 칼륨 채널의 개방(칼륨 이온 유출 증가)을 유발한다.이러한 이온 농도의 변화는 시냅스 구획으로 프리시냅스 단자에 의해 방출되는 원래의 신경전달물질의 양을 효과적으로 감소시킨다.이것은 시냅스 후 뉴런의 활동에 최종적인 우울증을 유발한다.따라서 피드백 주기는 완료된다.
참조
- ^ a b Siegel GJ, Agranoff BW, Albers RW, et al., eds. (1999). "Catecholamine Receptors". Basic Neurochemistry: Molecular, Cellular and Medical Aspects (6th ed.). Lippincott-Raven.
- ^ Bear; Connors; Paradiso (2006). Neuroscience: Exploring the Brain (3rd ed.). p. 119.
- ^ Xie z, W. S. (2007). "Rhesus Monkey Trace Amine-Associated Receptor 1 Signaling: Enhancement by Monoamine Transporters and Attenuation by the D2 Autoreceptor in Vitro". Journal of Pharmacology and Experimental Therapeutics. 321 (1): 116–127. doi:10.1124/jpet.106.116863. PMID 17234900.
- ^ Xie Z, Westmoreland SV, Miller GM (2008). "Modulation of Monoamine Transporters by Common Biogenic Amines via Trace Amine-Associated Receptor 1 and Monoamine Autoreceptors in Human Embryonic Kidney 293 Cells and Brain Synaptosomes". Journal of Pharmacology and Experimental Therapeutics. 325 (2): 629–640. doi:10.1124/jpet.107.135079. PMID 18310473.
- ^ Xie Z, Miller GM (2009). "Trace Amine-Associated Receptor 1 as a Monoaminergic Modulator in Brain". Biochemical Pharmacology. 78 (9): 1095–1104. doi:10.1016/j.bcp.2009.05.031. PMC 2748138. PMID 19482011.