클로닝 벡터
Cloning vector
클로닝 벡터는 생체 내에서 안정적으로 유지될 수 있는 작은 DNA 조각으로 복제를 [1]위해 외부 DNA 조각을 삽입할 수 있다.복제 벡터는 바이러스에서 채취한 DNA일 수도 있고 고등 유기체의 세포일 수도 있고 박테리아의 플라스미드일 수도 있다.벡터에는 예를 들어 제한 부위의 존재를 통해 벡터에 DNA 조각을 쉽게 삽입하거나 벡터로부터 제거할 수 있는 특징이 있습니다.벡터와 외부 DNA는 DNA를 절단하는 제한 효소로 처리될 수 있으며, 이로 인해 생성된 DNA 조각은 스틱 엔드로 알려진 뭉툭한 끝 또는 돌출부를 포함하며, 그 후 호환되는 끝을 가진 벡터 DNA와 외부 DNA는 분자 결찰에 의해 결합될 수 있다.DNA 단편이 복제 벡터로 복제된 후, 더 특정한 사용을 위해 설계된 다른 벡터에 추가될 수 있다.
복제 벡터에는 많은 종류가 있지만, 가장 일반적으로 사용되는 것은 유전적으로 조작된 플라스미드이다.복제는 일반적으로 대장균을 사용하여 처음 수행되며 대장균의 복제 벡터는 플라스미드, 박테리오파지(phage δ와 같은), 우주체 및 박테리아 인공 염색체(BACs)를 포함한다.그러나 예를 들어 매우 큰 DNA 조각과 같은 일부 DNA는 대장균에서 안정적으로 유지될 수 없으며 효모와 같은 다른 유기체가 사용될 수 있다.효모의 클로닝 벡터에는 효모 인공염색체(YACs)가 포함된다.
클로닝 벡터의 특징
분자생물학에서 일반적으로 사용되는 모든 복제 벡터는 적절한 복제 부위 및 선택 가능한 마커와 같은 기능에 필요한 주요 특징을 가지고 있습니다.그 외의 제품에는, 용도에 고유의 추가 기능이 있는 경우가 있습니다.쉽고 편리한 이유로, 복제는 종종 대장균을 사용하여 수행됩니다.따라서 사용되는 복제 벡터는 종종 복제의 기능적 기원(ori)과 같은 대장균의 번식 및 유지에 필요한 요소를 가지고 있다.복제의 ColE1 기원은 많은 플라스미드에서 발견됩니다.어떤 벡터들은 또한 대장균 외에 다른 유기체에서도 유지될 수 있게 해주는 요소들을 포함하고 있으며, 이러한 벡터들은 셔틀 벡터라고 불린다.
복제 사이트
모든 복제 벡터는 유전자가 벡터에 쉽게 삽입되거나 벡터에서 제거될 수 있도록 하는 특징을 가지고 있다.이는 여러 개의 고유한 제한 사이트를 포함하는 다중 복제 사이트(MCS) 또는 폴리링커일 수 있습니다.MCS의 제한 부위는 먼저 제한 효소에 의해 절단되고, 그 후 동일한 효소로 소화되는 PCR 증폭 표적 유전자가 DNA 연결효소를 사용하여 벡터에 결합된다.원하는 경우 표적 DNA 배열을 특정 방향으로 벡터에 삽입할 수 있습니다.제한 [2]부위는 필요에 따라 다른 벡터로 서브클로닝하기 위해 추가로 사용될 수 있다.
다른 클로닝 벡터는 리가아제 대신 토포이소머라아제를 사용할 수 있으며 클로닝은 벡터 또는 삽입물의 제한적인 소화 없이 보다 빠르게 이루어질 수 있다.본 발명의 TOPO 클로닝방법은 토포이소머라아제 I를 단부에 부착함으로써 선형화 벡터를 활성화하고, 이 "TOPO 활성화" 벡터는 PCR 생성물의 양끝을 결속시켜 토포이소머라아제를 방출하고,[3] 그 과정에서 원형 벡터를 형성함으로써 PCR 생성물을 수용해도 된다.DNA 다이제스트 및 연결효소를 사용하지 않는 복제의 또 다른 방법은 예를 들어 게이트웨이 복제 [4][5]시스템에서 사용되는 DNA 재조합에 의한 것이다.일단 복제 벡터(이 방법에서는 엔트리 클론이라고 함)로 복제되면, 그 유전자는 [6]재조합에 의해 다양한 발현 벡터에 쉽게 도입될 수 있다.
선택 가능한 마커
선택 가능한 마커가 벡터에 의해 반송되어 적극적으로 변환된 셀을 선택할 수 있다.항생제 내성은 종종 표지로 사용되는데, 예를 들어 암피실린과 같은 베타 락탐 항생제의 페니실린 그룹에 내성을 부여하는 베타 락타마아제 유전자가 그것이다.일부 벡터는 2개의 선택 가능한 마커를 포함하고 있으며, 예를 들어 플라스미드 pACYC177은 암피실린 및 카나마이신 내성 [7]유전자를 모두 가지고 있다.제오신과 하이그로마이신 B에 대한 저항성과 같은 선택 가능한 마커가 다른 세포 유형에서 효과적이지만, 두 개의 다른 유기체에서 유지되도록 설계된 셔틀 벡터는 두 개의 선택 가능한 마커를 필요로 할 수도 있다.또한 최소한의 배지에서 보조영양 생물이 성장할 수 있도록 하는 보조영양 선택 마커도 사용할 수 있다. 이들 중 LEU2 및 URA3는 대응하는 보조영양주 [8]효모와 함께 사용된다.
또 다른 종류의 선택 가능한 마커는 복제된 유전자에 의한 플라스미드의 양성 선택을 가능하게 한다.이것은 바나제,[9] Ccda,[10] parD/parE [11][12]독소와 같은 숙주 세포에 치명적인 유전자의 사용을 포함할 수 있다.이것은 전형적으로 복제 과정 동안 치명적인 유전자를 파괴하거나 제거함으로써 작용하며, 치명적인 유전자가 아직 그대로 남아 있는 성공하지 못한 복제는 숙주 세포를 죽일 수 있기 때문에 성공적인 복제만 선택된다.
리포터 유전자
리포터 유전자는 성공적인 복제를 쉽게 식별할 수 있도록 하는 이러한 유전자의 특징을 사용함으로써 성공적인 복제의 선별을 용이하게 하기 위해 일부 복제 벡터에 사용된다.클로닝 벡터에 존재하는 그러한 특징은 청백색 선택에서 α보완을 위한 lacZα 단편 및/또는 융합단백질의 생산을 촉진하기 위해 MCS와 프레임 내 마커 유전자 또는 리포터 유전자가 될 수 있다.선별에 사용될 수 있는 융합 파트너의 예로는 녹색 형광 단백질(GFP)과 루시페라아제가 있습니다.
식을 위한 요소
클로닝 벡터는 프로모터 및 리보솜 결합부위(RBS)와 같은 클로닝 대상 유전자의 발현에 적합한 요소를 포함할 필요는 없지만 많은 요소가 포함되며, 그 후 발현 벡터로 기능할 수 있다.표적 DNA는 선택된 숙주에서 표적 유전자의 발현에 필요한 특정 프로모터의 통제 하에 있는 부위에 삽입될 수 있다.프로모터가 존재하는 경우, 단백질은 필요할 때만 생성되도록 유전자의 발현을 엄격하게 제어하고 유도하는 것이 바람직하다.일반적으로 사용되는 프로모터로는 T7과 LAC 프로모터가 있습니다.청백색 선택과 같은 스크리닝 기법을 사용할 때는 프로모터가 있어야 합니다.
예를 들어, 대장균 세포에 독성이 있는 유전자의 클로닝에 프로모터나 복제 DNA 배열을 위한 RBS가 없는 클로닝 벡터가 사용되기도 한다.복제 유전자는 일반적으로 발현을 필요로 하는 경우 보다 적절한 발현 벡터에 서브 서브 서브레이드 되기 때문에 복제 DNA 배열에 대한 프로모터 및 RBS도 클론의 게놈 또는 cDNA 라이브러리를 처음 만들 때 불필요하다.
일부 벡터는 예를 들어 시험관 내 mRNA 생산을 위해 이종 단백질이 발현되지 않은 상태에서 전사를 위해 설계된다.이러한 벡터를 전사 벡터라고 합니다.폴리아데닐화 및 종단에 필요한 배열이 부족할 수 있으므로 단백질 생성에 사용되지 않을 수 있습니다.
클로닝 벡터 유형
다수의 클로닝 벡터를 사용할 수 있으며, 벡터의 선택은 삽입 크기, 복사 번호, 클로닝 방법 등 여러 요소에 따라 달라집니다.특히 복사 수가 많은 복제 벡터는 대형 삽입물이 일반 복제 벡터로 안정적으로 유지되지 않을 수 있으므로 대형 단편 복제에는 보다 전문적인 복제 [13]벡터가 필요할 수 있습니다.
플라스미드
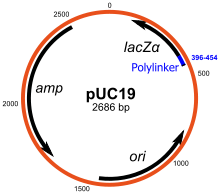
플라스미드는 원형 염색체외 DNA를 자율적으로 복제하는 것이다.이들은 표준 복제 벡터이며 가장 일반적으로 사용됩니다.대부분의 일반적인 플라스미드는 최대 15kb 크기의 DNA 삽입물을 복제하는 데 사용될 수 있습니다.가장 먼저 일반적으로 사용되는 복제 벡터 중 하나는 pBR322 플라스미드이다.다른 클로닝 벡터에는 pUC 계열의 플라스미드가 포함되어 있으며, 다수의 다른 클로닝 플라스미드 벡터가 이용 가능하다.많은 플라스미드는 예를 들어 [14]pUC19는 셀당 500~700개의 복사수를 가지며, 높은 복사수는 후속 조작을 위한 재조합 플라스미드의 수율을 증가시키기 때문에 유용하다.단, 예를 들어 복제유전자로부터의 단백질이 [15]세포에 독성이 있는 경우에 저복사수 플라스미드를 사용하는 것이 바람직하다.
일부 플라스미드는 복제의 M13 박테리오파지 기원을 포함하며 단일 가닥 DNA를 생성하는 데 사용될 수 있습니다.이것들은 phagemid라고 불리며, 복제 벡터의 pBluescript 시리즈가 그 예입니다.
박테리오파지
복제에 사용되는 박테리오파지는 λ파지와 M13파지다.파지에 포장할 수 있는 DNA의 양에는 상한(최대 53kb)이 있으므로 파지 DNA에 외래 DNA를 삽입할 수 있도록 하기 위해 파지 클로닝 벡터는 일부 비필수 유전자를 삭제해야 할 수 있다. 예를 들어 파지 β를 클로닝 벡터로서 사용하는 것은 용존 [16]사이클만을 수반하기 때문이다.γ 파지 벡터는 삽입 벡터와 치환 벡터 두 가지가 있습니다.삽입 벡터는 5~11kb 크기의 외부 DNA를 삽입할 수 있는 독특한 절단 부위를 포함한다.치환 벡터에서는 분해 부위가 용해 사이클에 필수적이지 않은 유전자를 포함하는 영역에 측면으로 배치되며, 이 영역은 삭제되어 복제 프로세스에서 DNA 삽입으로 대체될 수 있으며, 8~24kb의 더 큰 크기의 DNA를 [17]삽입할 수 있다.
또한 파지에 포장될 수 있는 DNA의 낮은 크기 제한이 있고, 너무 작은 벡터 DNA는 파지에 적절하게 포장될 수 없습니다.이 속성은 선택에 사용할 수 있습니다. 삽입되지 않은 벡터가 너무 작을 수 있으므로 [18]전파를 위해 삽입된 벡터만 선택할 수 있습니다.
코스미드
코스미드는 박테리오파지 δDNA의 일부를 포함하는 플라스미드이며, 이는 DNA를 δ입자로 포장하는 데 필요한 요소를 포함하는 응집성 말단부위(cos)를 가진다.보통 28Kb에서 45Kb [13]사이의 큰 DNA 조각을 복제하는 데 사용됩니다.
세균인공염색체
삽입 크기는 최대 350kb까지 박테리아 인공 염색체(BAC)에서 복제할 수 있습니다.BAC는 세포당 [17]1개의 복사본 번호로 대장균에 보관됩니다.BAC는 F 플라스미드에 기초하고, PAC라고 불리는 또 다른 인공 염색체는 P1 파지에 기초한다.
효모인공염색체
효모 인공염색체는 1메가베이스(1Mb=1000kb) 이상의 DNA 단편을 복제하기 위한 벡터로 사용된다.그것들은 인간 게놈 프로젝트와 같은 게놈 지도 작성에 필요한 더 큰 DNA 조각 복제에 유용하다.그것은 자율적으로 복제되는 염기서열인 텔로미어 염기서열을 포함한다.이 벡터들은 또한 선택 가능한 마커로 사용되는 유전자뿐만 아니라 외래 DNA를 복제하기 위한 적절한 제한 부위를 포함한다.
인간 인공 염색체
인간 인공염색체는 인간 세포에 유전자를 전달하기 위한 유전자 전달 벡터 및 발현 연구 및 인간 염색체 기능을 결정하는 도구로서 잠재적으로 유용할 수 있다.매우 큰 DNA 조각(실용상 크기 상한 없음)을 운반할 수 있기 때문에 다른 벡터의 복제능력이 제한되는 문제가 없고 바이러스 [19][20]벡터에 의한 숙주 염색체로의 통합에 의한 삽입 돌연변이 유발 가능성도 회피된다.
동식물 바이러스 벡터
식물과 동물 세포를 감염시키는 바이러스 또한 외래 유전자를 식물과 동물 세포에 도입하도록 조작되었다.바이러스가 세포에 흡착하고, DNA를 도입하고, 복제하는 타고난 능력은 바이러스를 배양 중인 진핵 세포에 외래 DNA를 이식하는 데 이상적인 매개체로 만들었다.포유류 세포를 포함한 첫 복제 실험에 시미안 바이러스 40(SV40)에 기초한 벡터를 사용했다.아데노바이러스와 유두종 바이러스와 같은 다른 종류의 바이러스에 기초한 많은 벡터들이 포유류의 유전자를 복제하는데 사용되어 왔다.현재 레트로바이러스 벡터는 포유류 세포 내 유전자 복제에 인기가 있다.콜리플라워 모자이크 바이러스와 같은 식물의 경우, 담배 모자이크 바이러스와 제미니 바이러스가 제한적으로 사용되었습니다.
스크리닝: 블루/화이트 스크린 예시
pUC19와 같은 많은 범용 벡터는 보통 쉽게 채점된 표현형의 손실에 기초하여 복제된 DNA 단편의 존재를 검출하는 시스템을 포함한다.가장 널리 사용되는 유전자는 대장균 β-갈락토시다아제를 코드하는 유전자로, 대장균 β-갈락토시다아제는 수용성 무색 기질 X-gal(5-bromo-4-클로로-3-인딜릴-베타-d-갈락토시드)을 불용성 청색 제품(5, 5'-d-dibo)으로 가수분해시키는 효소의 기능에 의해 쉽게 검출될 수 있다.β-갈락토시드가수분해효소의 벡터 기반의 lacZα 배열 내에서 DNA 단편을 복제하는 것은 활성효소의 생성을 막는다.선택적 한천판에 X-gal이 포함되어 있으면 일반적으로 DNA가 삽입되지 않은 벡터는 파란색, 복제된 DNA 단편을 포함한 벡터는 흰색이다.
「 」를 참조해 주세요.
레퍼런스
- ^ "Definition of cloning vector". Genome Dictionary. Retrieved 2012-10-18.
- ^ Gorman; et al. (2015). "Adaptability and reproducibility of alternative splice and restriction sites in differential cloning vectors: a study and literature review". Journal of Biomolecular Technology. 30 (19): 120–142.
- ^ "The Technology Behind TOPO® Cloning". Invitrogen.
- ^ Esposito D, Garvey LA, Chakiath CS (2009). "Gateway cloning for protein expression". High Throughput Protein Expression and Purification. Methods in Molecular Biology. Vol. 498. pp. 31–54. doi:10.1007/978-1-59745-196-3_3. ISBN 978-1-58829-879-9. PMID 18988017.
- ^ "Cloning Methods - Recombination cloning systems". EMBL.
- ^ "Gateway® Recombination Cloning Technology". Invitrogen.
- ^ Nicola Casali; Andrew Preston (2003). E. coli plasmid vectors. Methods in Molecular Biology. Vol. 235. p. 23. ISBN 978-1-58829-151-6.
- ^ Romanos MA, Scorer CA, Clare JJ (1992). "Foreign gene expression in yeast: a review" (PDF). Yeast. 8 (6): 423–88. doi:10.1002/yea.320080602. PMID 1502852. S2CID 15674832.
- ^ Yazynin SA, Deyev SM, Jucovic M, Hartley RW (1996). "A plasmid vector with positive selection and directional cloning based on a conditionally lethal gene". Gene. 169 (1): 131–2. doi:10.1016/0378-1119(95)00814-4. PMID 8635737.
- ^ Philippe Bernard (1996). "Positive Selection of Recombinant DNA by CcdB". BioTechniques. 21 (2): 320–323. doi:10.2144/96212pf01. PMID 8862819.
- ^ Gabant P, Van Reeth T, Drèze PL, Faelen M, Szpirer C, Szpirer J (2000). "New positive selection system based on the parD (kis/kid) system of the R1 plasmid". BioTechniques. 28 (4): 784–8. PMID 10769758.
- ^ Kim HG, Kim HS, Hwang HJ, Chung SK, Lee JM, Chung DK (2004). "Construction of a pTOC-T vector using GST-ParE toxin for direct cloning and selection of PCR products". Biotechnology Letters. 26 (21): 1659–63. doi:10.1007/s10529-004-3518-z. PMID 15604816. S2CID 10312859.
- ^ a b Andrew Preston (2003-07-03). E. coli plasmid vectors. Methods in Molecular Biology. Vol. 235. pp. 19–20. ISBN 978-1-58829-151-6.
- ^ Nicola Casali; Andrew Preston (2003). E. Coli Plasmid Vectors: Methods and Applications. Humn Press. p. 22. ISBN 978-1588291516.
- ^ "Copy number". Genetics Institute, Inc. Archived from the original on 2013-04-19. Retrieved 2013-03-06.
- ^ B. R. Glick; J. J. Pasternak (2005). Molecular Biotechnology Principles and Applications of Recombinant DNA (3rd ed.). ASM Press. ISBN 9781555816124.
- ^ a b Andrew Preston (2003-07-03). E. coli plasmid vectors (PDF). Methods in Molecular Biology. Vol. 235. pp. 21–22. ISBN 978-1-58829-151-6.
- ^ TA Brown (2010-04-19). Gene Cloning and DNA Analysis: An Introduction. Wiley-Blackwell. p. 100. ISBN 978-1444334074.
- ^ Kim JH, Kononenko A, Erliandri I, Kim TA, Nakano M, Iida Y, Barrett JC, Oshimura M, Masumoto H, Earnshaw WC, Larionov V, Kouprina N (Dec 13, 2011). "Human artificial chromosome (HAC) vector with a conditional centromere for correction of genetic deficiencies in human cells". Proc Natl Acad Sci U S A. 108 (50): 20048–53. Bibcode:2011PNAS..10820048K. doi:10.1073/pnas.1114483108. PMC 3250132. PMID 22123967.
- ^ Kouprina N, Earnshaw WC, Masumoto H, Larionov V (2013). "A new generation of human artificial chromosomes for functional genomics and gene therapy". Cellular and Molecular Life Sciences. 70 (7): 1135–48. doi:10.1007/s00018-012-1113-3. PMC 3522797. PMID 22907415.