디스코더몰라이드
Discodermolide | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 (3Z,5S,6S,7S,8R,9S,11Z,13S,14S,15S,16Z,18S)-8,14,18-Trihydroxy-19-[(2S,3R,4S,5R)-4-hydroxy-3,5-dimethyl-6-oxooxan-2-yl]-5,7,9,11,13,15-hexamethylnonadeca-1,3,11,16-tetraen-6-yl carbamate | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐벨 | |
| 켐스파이더 | |
| 케그 | |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C33H55NO8 | |
| 어금질량 | 593.79 g/190 |
| 녹는점 | 112 ~ 113 °C(234 ~ 235 °F, 385 ~ 386 K) |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
(+)-Discodermolide은polyketide 자연 제품 미소관을 안정시킬 발견했다.(+)-discodermolide Gunasekera과 항구 파출소 해양과 햑 연구소에서 그의 직장 동료들에 의해 1990.[1](+)-Discodermolide의 심해 스펀지 Discodermia dissoluta로부터 격리되었다 몇 MDR 암 종양의 세포 성장의 강력한 억제제 발견되었다. 셀l 선(+-----)-데르몰라이드는 또한 선형 백본 구조, 체외 및 체내 면역 억제 특성,[2][3] 가속 노화 표현형식의 강력한 유도,[4] paclitaxel과 결합한 시너지 항진화 활성을 포함한 몇 가지 독특한 문자를 보여준다.[5]디스코더몰라이드는 튜불린 조립의 가장 강력한 천연 촉진제 중 하나로 인정받았다.(+-discodermolide)의 총합성을 향한 많은 노력이 흥미로운 생물학적 활동과 자연 발생원의 극한 희소성(냉동 해양 스펀지로부터 0.002%w/w)에 의해 이루어졌다.완전한 임상시험에 필요한 복합공급은 수확, 격리, 정화만으로는 충족될 수 없다.2005년 현재 발효에 의한 합성이나 반합성 시도는 성공하지 못한 것으로 입증되었다.그 결과, 임상 전 연구와 임상 실험에 사용되는 모든 디스코더몰라이드는 대규모의 총합성으로부터 나온 것이다.[6]
역사
디스코더몰라이드는 1990년 화학자인 사라스 구나세라 박사와 생물학자 로스 롱리 박사에 의해 카리브해 해양 스펀지 디스코더미아 용해로부터 처음 격리되었다.[1]스펀지에는 디스코더몰라이드 0.002%(7mg/434g 스펀지)가 들어 있었다.화합물은 빛에 민감하기 때문에 스펀지는 최소 수심 33m에서 수확해야 한다.디스코데르몰라이드는 초기에 면역억제 및 항응고 활동을 하는 것으로 밝혀졌다.
구조
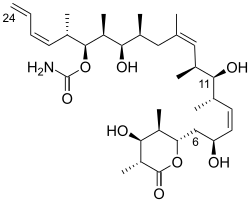
(+---디스코더몰라이드는 선형 폴리프로필산 백본을 가지고 있으며, C(8,9)와 C(13,14), C(21–24), 13개의 스테레오제닉 센터(이차 히드록실 4개와 7개의 메틸 대체물 포함), 카바마이트 및 완전 대체 D-락톤이 있다.상대적 입체화학은 X선 결정학에 의해 결정되었다.[1](+-discodermolide)의 절대 입체화학은 슈라이버와 그의 동료들에 의해 1993년에 보고되었다.[7]디스코데르몰라이드는 U자형 순응을 채택하는데, 여기서 내부(Z)-알케인은 등뼈를 따라 아군 변형과 싱-펜탄 상호작용을 최소화하여 순응형 잠금장치의 역할을 한다.D-락톤은 보트처럼 순응하고 있다.
생물학적 활동
면역억제 특성
Longley 그룹에 의한 (+-discodermolide)의 초기 생물학적 평가는 그것이 체외와[2] 체내 모두에서 면역억제적 특성을 가지고 있다는 것을 보여주었다.[3]면역억제 반응은 시험관내(+-discodermolide)가 독성이 없는 비교적 낮은 농도에서 관찰되었다.인간 말초혈액 백혈구와 뮤린 스플렌세포 모두에서 (+-discodermolide)가 양방향 혼합 림프구 반응을 억제하는 것으로 밝혀졌다.또한 말초혈구 백혈구의 유사성 반응도 (+-discodermolide)에 의해 억제되었다.후속 실험은 (+-discodermolide) 또한 여러 다른 비림포이드 세포 라인에서 반선호작용 효과가 있다는 것을 입증했다.
항진화 및 항진화 특성
(+---Discodermolide는 매우 강력한 항균제다.[5] (+--Discodermolide 처리된 뮤린 Do11.10T 하이브리드종 세포는 정상적인 세포 순환을 진행할 수 없다.미처리 대조군에서는 G1상에서는 68%의 셀이 발견되었고, S상에서는 31%가 발견되었으며, G2/M상에서는 1% 미만의 셀이 발견되었다.그러나 3시간(+-discodermolide) 치료 후 G1상 52%, S상 40%, G2상·M상 58%가 발견됐다.이 결과는 (+-discodermolide)가 G2와 M상에서의 셀 주기를 차단한다는 것을 나타냈다.이러한 억제 효과도 되돌릴 수 있는 것으로 나타났다.세포 배양 배지에서 (+)-디스코더몰라이드를 제거한 후 48시간 이내에 정상 사이클을 재개한다. (+--Discodermolide) 미세관망의 결합과 안정화를 통해 세포 사이클을 정지한다.유사분열 스핀들의 초안정화는 G2와 M 단계에서 세포주기가 정지되고 결국 세포사멸에 의한 세포사멸을 초래한다.10µM 농도에서는 (+-discodermolide) 미세관 관련 단백질과 GTP 없이 미세관 조립을 촉진할 수 있다.미세관류 관련 단백질과 GTP를 제시하면 10µM(+-discodermolide)이 0°C에서 튜불린 중합화를 시작할 수 있다.[8][9]
가속 세포 노화의 잠재력 인덕터
(+---Discodermolide는 노화 표현형을 유도할 수 있다. (-)-Discodermolide 처리된 Hela, MDA-MB-231, HCT-116, A549 세포는[4] 4개 세포 라인 모두에서 높은 수준의 β-갈락토시다아제 활성을 보였다.β-갈락토시다아제 활성은 노쇠의 특징 중 하나이다.[10]다른 일반적인 특징으로는 증식의 중단과 세포질 영역 증가가 있다. (+--Discodermolide) 또한 세 가지 단백질(p66Shc, Erk1, Erk2)에서 상향조절과 활성화를 유도했다.
신경보호제
(+--Discodermolide는 최근 알츠하이머 연구에서도 신경보호성이 있는 것으로 밝혀졌다.[11](+)-디스코더몰라이드의 미세관 안정화 기능은 아밀로이드 유도 격리 작용으로 인해 붕괴된 뉴런 기능을 복원하는 데 사용되었다.타우 단백질은 건강한 뉴런에서 미세관망을 안정시키는 것으로 알려져 있다.[12]액틴, 튜불린, 미토콘드리아, 신경전달물질 관련 효소, 메신저 단백질을 운반하는 베실 등이 전달되는 '철도 궤도' 역할을 했다.세포에 아밀로이드가 존재하면 타우 단백질의 집적과 미세관수 감소로 이어질 수 있다.인간 타우병증에 대한 유전자이전 마우스 모델에서 (+--discodermolide)는 미세관을 안정시키고 세포 내 빠른 축 이송을 회복시켜 타우 단백질의 집계에 의한 기능 상실을 상쇄한다.운동 장애가 있는 쥐들은 (+-discodermolide) 치료로 정상적인 움직임을 완전히 회복하는 모습을 보였다.
투불린 어셈블리의 강력한 천연 촉진제
디스코더몰라이드는 미세관 결합을 위해 페이크리탁셀과[13] 경쟁하지만 친화력이 높아 페이크리탁셀과 에피틸론 내성 암세포에도 효과가 있다.디스코데르몰라이드는 또한 고체 상태, 용액, 튜불린에 묶여 있을 때 3D 분자 순응이 현저하게 일관되는 것으로 보인다; 디스코데르몰라이드의 순응 유연성을 가진 분자는 보통 다른 환경에서 매우 다른 순응을 나타낸다.
생합성
해면체에서 흔히 발견되는 많은 해양 유래 폴리케티드는 자연환경에서 배양될 수 없다.스펀지에서 파생된 폴리케티드의 생합성을 담당하는 유전자를 찾는 것은 스펀지의 식민성 때문에 달성하기 어려운 과제. 과학자들은 아직 스펀지를 배양할 수 없기 때문에 (+-discodermolide)의 생합성 유전자는 아직 발견되지 않았다.[14]
총합성
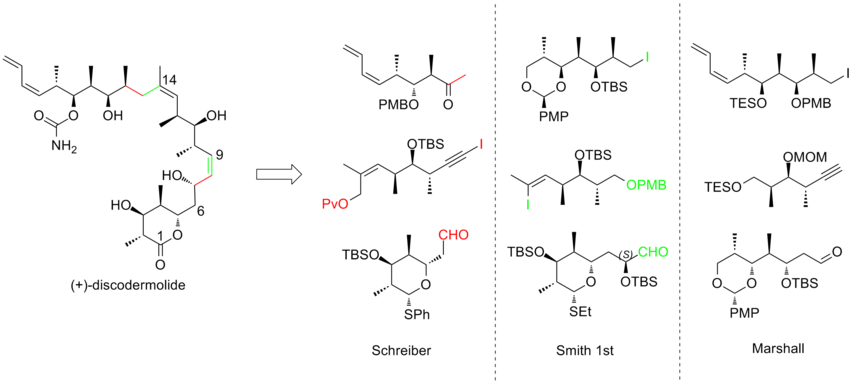
임상 프로파일 연구에 대한 증가하는 관심을 충족시키기 위해 (+-discodermolide)의 총합성을 위해 강도 높은 노력을 기울였다.여러 연구 단체에서 십여 편이 넘는 합성이 발표되었다.디스코데르몰라이드 합성은 10년간의 작업 끝에 더욱 융복합적이고 실용적이 되었다.모든 총합성 접근방식은 대략 동등한 복잡성의 3가지 주요 파편을 만드는 것으로 시작되었으며, 각 파편에는 디스코데르몰라이드 표적의 입체적 특성에 맞는 연속적인 중심부의 메틸-하이드록실-메틸 트라이아드가 포함되어 있다.다음은 (+-discodermolide)의 역합성 해석의 세 가지 예:
부자연스러운 대격변(---discodermolide)의 총합물
슈라이버 합성법(---discodermolide)
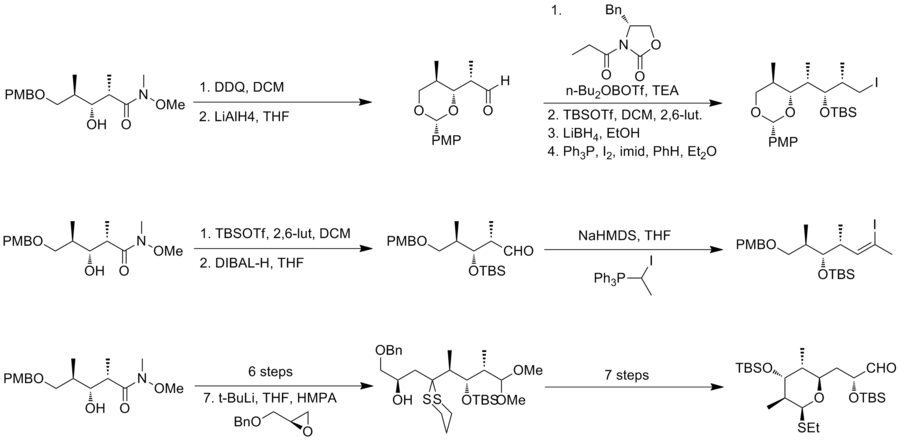
1993년 슈라이버와 그의 동료들은[7] 부자연스러운 대격막(----discodermolide)의 최초의 총합성을 보고하고 천연물의 절대적 입체화학성을 결정했다.슈라이버 팀은 디스코데르몰라이드에서 올레피니컬 유닛으로 분리되어 있는 대략 동일한 복잡성의 3개 파편을 인정했다.두 개의 시작 물질인 호모릴릭 알코올은 둘 다 3-하이드록시-2-메틸프로피온산염에서 쉽게 파생된다.
첫 파편의 삼분해효소(Z)-alkene은 스틸-제나리 시약을 사용하여 생성되었다.그리고 나서 길버트의 시약을 아세틸렌에 호몰로로그인하는 데 사용되었다.그 후 괴젠과 기시법을 사용하여 원하는 파편인 이오도아세틸렌을 얻었다.같은 호모알코올이 4단계로 디올로 전환됐다.케토알데히드로 산화한 뒤 팔라듐-카타민화 브롬화 비닐진화 결합에 의해 디엔에 호몰롤화돼 2부 파편을 생성했다.6-membed 링 서브 유닛은 아세트로부터 변형되었는데, 아세트에서는 추정 헤미아세트 중간의 근육 내 1,4 추가에 의해 얻어졌다.
슈라이버 팀은 NiCl과2 CrCl이2 알데히드에 알킬니라이드 요오드 추가를 효과적으로 추진했다는 것을 발견했다.그 반응은 원하는 제품과 그것의 이소체를 2:1로 혼합한 것이다.그러나 원하지 않는 이소머는 스웨른 산화, 코레이의 비대칭 감소를 포함한 세 단계로 원하는 에피머로 재활용할 수 있다.Pd는 알킨의 부분 수소를 촉매하여 C(8)–C(9)에서 Z 구성을 설정하였다.그리고 나서 피발로일록시 그룹은 최종 결합을 위해 브롬화물로 변환되었다.두 번째 파편에서 파생된 리튬 에놀레이트와의 아군산 브롬화 사이의 입체적 에놀레이트 알킬화는 이소머의 3:1 혼합물을 제공하고 (---discodermolide)의 백본 조립을 완료했다.최종 변환 중, 케톤 NaBH4 감소는 분리 가능한 2.5:1 이소머 혼합물을 제공했다.슈라이버 합성의 (---discodermolide)는 전체 수율이 3.2%로 24단계와 36단계로 가장 긴 선형 시퀀스를 가지고 있다.슈라이버 그룹은 1996년 유사한 합성 전략(전체 수율 4.3%, 36계단, 24계단 최장 선형 시퀀스)으로 천연 디스코더몰라이드의 총합성을 발표했다.
스미스 1세대 합성(---discodermolide)
1995년에 스미스와 그의 동료들은[15] (--discodermolide)의 두 번째 총합성을 보고했다.스미스는 슈라이버 합성의 삼각 융합 전략을 채택했다.스미스의 전략에서 세 조각 모두 공통의 전구체를 공유했는데, 이는 수율이 59%인 3-하이드록시-2-메틸프로피온산염에서 고효율 50g 스케일 5단계 변환의 산물이었다.원하는 입체 화학적 결과를 얻기 위해 에반스 신 알돌 반응이 이용되었다.
조각 A의 합성인 알킬 요오드화물은 에반스의 아킬옥사졸리디논법을 적용했다.히드록실 보호 및 키랄 보조의 환원 제거 후, A 파편을 감당할 수 있도록 요오드화 작업을 실시했다.조각 B의 준비는 TBS 보호와 DIBAL 축소로 시작되었다.결과 알데히드는 6:1 선택성으로 원하는 Z-분산 비닐 할라이드로 변환할 수 있다.조각 C의 합성의 주요 특징은 디티아네에서 추출한 음이온을 벤질 글리시딜 에테르에 첨가한 것이었다.
팔라듐(0)은 요오드화 비닐과 알킬라이드의 오가노진크 파생 모델의 교차 결합으로 66%의 수율을 제공한다.해당 인산염으로 2단계 전환 후, 인산염과 알데히드, 파편 C의 결합이 76%의 수율과 양호한 선택성으로 진행되었다.이 합성의 마지막 특징은 디엔의 티타늄 매개 설치였다.(---discodermolide)의 스미스 합성은 전체 수율이 2.0%로 29단계와 42단계로 구성된 가장 긴 선형 시퀀스를 가지고 있다.
몰리드의 밀레스합성
1997년, Myles와 그의[16] 동료들은 킬레이트 제어 알킬화를 사용한 (--discodermolide)의 총합성을 키 커플링으로 묘사했다.알데히드와 대니셰프스키 디엔의 티타늄 매개 헤테로-디엘-알데르 반응은 아군 요오드화 파편에서 도전적인 Z-트리분해 C(13)–C(14) 올레핀을 성공적으로 생성했다.C(16)-C(21) 하위 유닛의 입체성은 에반스 알돌 화학 작용으로 유도되었다.최종 파편의 입체성은 양철로 추진한 비대칭적 제휴에 의해 설정되었다.특히 이 파편의 C(1)에서 정확한 산화 상태는 파편 결합 후 단계 수를 감소시킬 것이다.마일즈 합성(---discodermolide)은 전체 수율이 1.5%로 25단계와 44단계로 가장 긴 선형 시퀀스를 가지고 있다.
자연 항정신병합물(+-discodermolide) 총합물
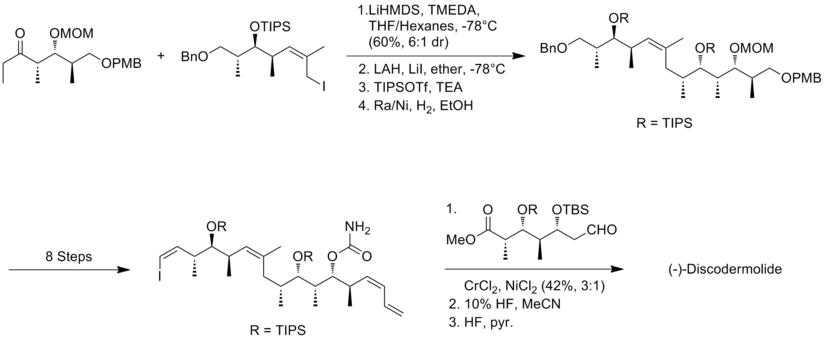
마샬 합성 (+-discodermolide)
마샬과 그의 동료들은[17] (+-discodermolide)의 폴리프로피온테 프레임워크를 구축하기 위해 비대칭 알렌닐메탈-호모말돌 전술을 사용했다.마샬 접근방식의 새로운 점은 (S)-3-실록시-2-메틸롭프로판(S)에 비레이스 알렌릴메탈 시약을 추가하여 3개의 스테레오트리아드 서브유닛을 조립하여 동기/동기/안티 유도물을 모두 생성한다는 것이다.알킬 요오드화 조각의 합성을 위한 중심적인 특징은 BF3 에더레이트 존재에서 알알데히드를 알렌틸리부틸스타네인으로 처리하여 싱크로나이즈 이소머를 얻은 것이었다.신/안티 메틸-하이드록실-메틸 스테레오트리아드는 알데히드와 호모키랄 알렌닐진시약 사이의 반응을 통해 얻었다.
마셜 합성에서는 알카인 파편과 알데히드 파편과의 결합이 92%의 수율에서 진행되었으며 85:15 이염률이었다.수율 40%와 (Z)와 (E) 이소머의 분리할 수 없는 85:15의 혼합물을 생산하는 이오도데틸리덴 트리페닐인스포레인을 이용한 알데히드의 응결이 가장 어려운 단계였다.마지막 커플링은 알키요오드화합물에서 파생된 붕소산염과 요오드화 비닐의 스즈키 유니온을 통해 수행되었다.(+-discodermolide)의 마샬 합성은 전체 수율이 1.3%이며 가장 긴 선형 순서는 30계단, 총 48계단이다.
에반스 합성 (+-discodermolide)
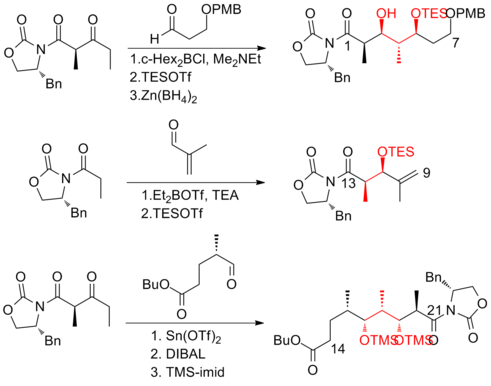
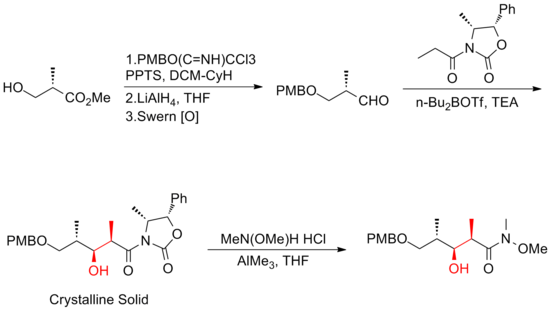
에반스와 그의 동료들은[18] 다엽제 등뼈의 생산을 위해 비대칭적인 알돌 방법론에 크게 의존하는 전략을 개발했다.그들은 C(13)–C(14) 삼분해 Z-olefin을 만들기 위해 Claisen 응축 반응을 이용했다.에반스 합성(+-discodermolide)은 전체 수율이 6.4%로 31단계와 49단계 중 가장 긴 선형 시퀀스를 가지고 있다.
(+-discodermolide)의 스미스 그램 스케일 합성
1999년에 스미스와 그의 동료들은[19] 잠재적인 화학요법제로서 (+)-디스코더몰라이드의 개발을 가능하게 하는 (+)-디스코더몰라이드의 첫 번째 그램 규모의 합성을 보고했다.이 합성 루트는 노바티스 제약회사에 허가되었다.주요 개선사항 중 하나는 중간인 알돌 인덕트가 결정체 고체로 되어 있기 때문에 공통의 전구체를 향한 5단계의 첫 4단계에서는 정화가 필요하지 않다는 것이었다.킬레이트 제어 무카이야마알돌 반응은 락톤 파편의 C(5)로 입체감을 설정하기 위해 사용되었다.
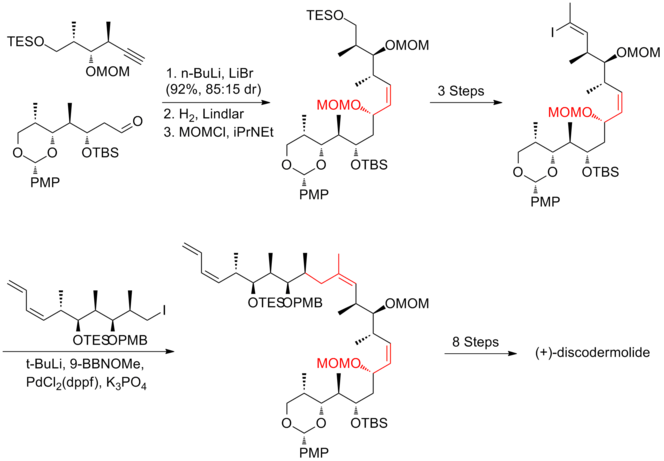
2년 후, 스미스와 그의 동료들은 요오드화 전구체의 C(11)에 있는 부피가 큰 TBS 에테르 보호 그룹이 덜 장황하게 부호화된 그룹인 MOM으로 대체된 3세대 합성을 발표한다. 이 수정은 원하는 인산염 소금의 형성을 선호한다.스미스 3세대 합성의 (+-discodermolide)는 총 생산량이 6.0%로 21단계, 총 35단계로 구성된 가장 긴 선형 시퀀스를 가지고 있다.
(+-discodermolide)의 4세대 스미스 합성
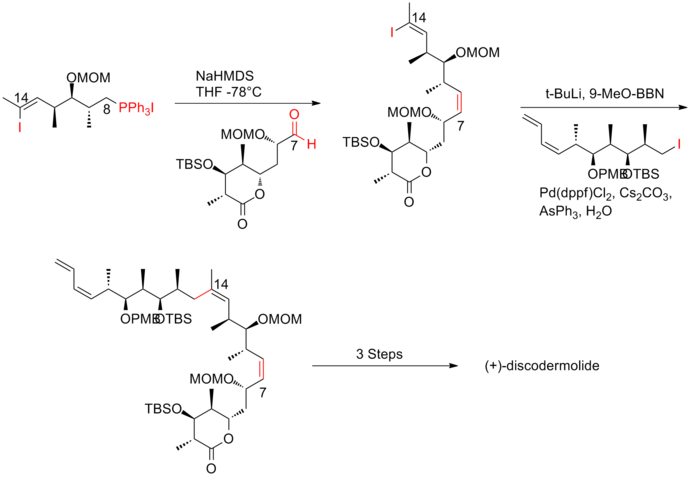
4세대[20] 접근법의 주요 특징은 양방향 파편, 요오드화비닐/인산염 소금의 활용이었다.인산염 소금은 삼분화 비닐 요오드화물이 알킬 요오드화물에 비해 반응성이 낮기 때문에 쉽게 얻을 수 있다.알킬 요오드화(Alkyl Iodide)와 스즈키 커플링에 따른 위틱 반응은 (+-discodermolide)의 등뼈를 효율적으로 공급했다.스미스 4세대 합성의 (+-discodermolide)는 전체 수율이 9.0%로 17단계와 36단계로 가장 긴 선형 시퀀스를 가지고 있다.
1세대 패터슨 합성(+-discodermolide)
패터슨과 캠브리지 대학의 그의 동료들은[21] 서브 유닛 연결에 대한 높은 선택성과 함께 새로운 킬레이트 제어와 시약 제어 알돌 반응을 이용하는 전략을 개발했다.이 합성의 또 다른 특징은 스틸-제나리 호너-와드워스-에몬스 반응을 통해 시스 기하학이 있는 C(8)-C(9) 올레핀을 유도한 것이다.패터슨 1세대 합성의 (+--discodermolide)는 전체 수율이 10.3%로 23단계, 42단계로 구성된 가장 긴 선형 시퀀스를 가지고 있다.
패터슨 2세대와 3세대 합성한 (+-discodermolide)
2003년에 패터슨과 동료들은[22] 기판 유도 스테레오콘트롤에 크게 의존하는 전략을 보고했다.패터슨 1세대 합성에서는 시약 제어 알돌 반응 대신 Dicyclohexylboron-medi-aldol을 사용하여 C(5)-C(6)를 연결했고, 이는 4:1에서 92:8로 상당한 이염률 증가를 가져왔다.특히, 스틸-제나리 수정 호너-와드워스-에몬스 반응도 이 합성의 초기 단계에서 C(13)-C(14) 삼분해 올레핀을 구성하는 데 사용되었다.패터슨 2세대 합성의 (+--discodermolide)는 전체 수율이 7.8%로 24단계와 35단계로 가장 긴 선형 시퀀스를 가지고 있다.
2004년에 패터슨과 그의 동료들은[23] (+-discodermolide)의 3세대 합성을 공개했다.이전 세대에서 C(1)~C(8) 하위 단위를 통합하기 위해 사용한 단계적 방법은 후기 Still-Gennari olefination으로 대체되어 융합이 눈에 띄게 개선되었다.패터슨 3세대 합성의 (+-discodermolide)는 전체 수율이 11.1%(현재까지 가장 높은 것으로 보고됨)이며, 21단계와 37단계에 이르는 가장 긴 선형 순서가 있다.
노바티스 60g 총합성 (+-discodermolide)
노바티스제약은[24] 2004년 초 60g 규모의 합성(+-discodermolide)의 상세 내용을 공개했다.이 합성은 스미스 그램 스케일 접근법과 패터슨 1세대 엔드게임을 활용했다.이 합성을 통해 (+-discodermolide)는 1단계 임상시험에서 고도 고체 악성종양을 보이는 성인 환자의 체내 화학요법요법으로 평가할 수 있다.(+-discodermolide)의 노바티스 합성은 전체 수율이 0.65%로 가장 긴 선형 순서가 26단계, 총 33단계에 이른다.
(+-discodermolide)의 파넥 총합성
2004년에 파넥과 그의 동료들은[25] (+-디스코데르몰라이드)의 3개 서브유닛의 절대 입체화학성을 얻기 위해 치랄 크로틸실레인 기반의 C-C 본드 건설 방법론을 활용하는 접근법을 보고했다.패터슨 접근법의 주요 특징 중 하나는 C13-C14(Z)-올레핀 건설을 위한 하이드로지르콘-크로스커플링 방법론의 활용이다.하위 유니트를 연결하기 위해 높은 수준의 1,5-안티오레오 유도와 팔라듐 매개 sp2-sp3 교차 결합 반응을 가진 아세테이트 알돌 반응이 사용된다.파넥 합성의 (+-discodermolide)는 전체 수율이 2.1%로 27단계와 42단계로 구성된 가장 긴 선형 시퀀스를 가지고 있다.
아디송 총합성(+-discodermolide)
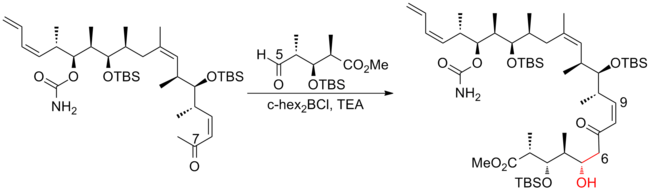
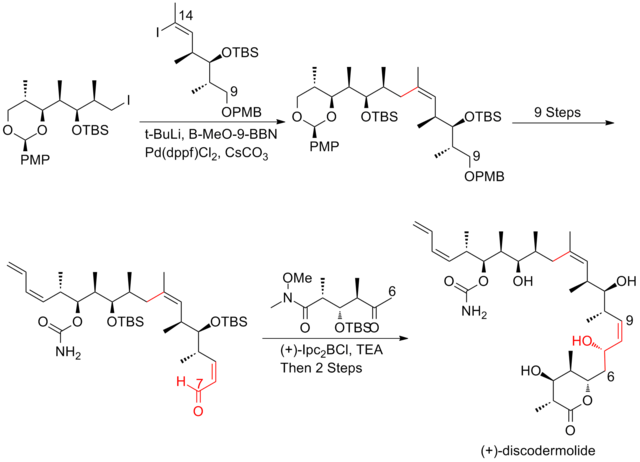
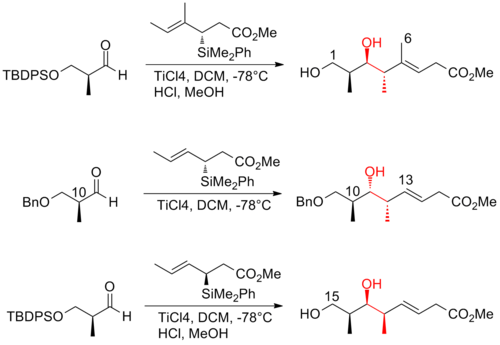
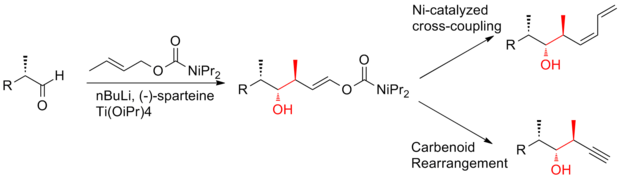
2008년 아르디송과 그의 동료들은[26] 선택성이 뛰어난 호모알리릭(Z)-O-에네 카르밤산 알코올을 생산하기 위해 크로틸타이타늄 반응을 반복적으로 적용하는 전략을 보고했다.이러한 크로틸타이타닉 반응은 (+)-디스코더몰라이드(-discodermolide)의 시니-안티메틸-히드록시-메틸 트라이애드를 효율적으로 생산할 뿐만 아니라, 터미널(Z)-다이엔으로 쉽게 전환할 수 있는 제품도 산출한다.C13-C14 (Z)-olefin은 고선택적 등방성 재배열을 통해 설치된다.(+-discodermolide)의 아르디션 합성은 전체 수율이 1.6%이며 21단계의 가장 긴 선형 순서가 있다.
임상발달
항만지부 해양학 협회는 (+-discodermolide to Novartis)를 허가했고, 2004년에 임상 1상을 시작했다.그 재판은 그 약이 최소한의 독성을 초래했고 새로운 행동 메커니즘을 나타낸다고 결론지었다.[27]아모스 B. Smith의 연구 그룹은 Kosan Bioscience와 협력하여 임상 전 약물 개발 프로그램을 진행 중이다.[28]
참고 항목
참조
- ^ a b c Gunasekera, S. P.; Gunasekera, M.; Longley, R. E.; Schulte, G. K. J. Org. 화학. 1990, 55, 4912-4915. (doi:10.1021/jo00303a029)
- ^ a b Longley, R. E.; Caddigan, D.; Harmody, D.; Gunasekera, M.; Gunasekera, S. P. 이식 1991, 52, 650-655.
- ^ a b Longley, R. E.; Caddigan, D.; Harmody, D.; Gunasekera, M.; Gunasekera, S. P. 이식 1991, 52, 656-661.
- ^ a b 클라인, L.; Freeze, B. S.; Smith, A. B., III; Horwitz, S. B. Cell Cycle 2005, 4, 501–507.
- ^ a b Longley, R. E.; Gunasekera, S. P.; Faherty, D.; McLane, J.; Dumont, F. Ann. N.Y. Acad.Sci. 1993, 696, 94–107.
- ^ 미켈, S. J. 외조직 프로세스 2004년 8월
- ^ a b 네렌버그, J. B.;흥, D.T.; Somers, P. K.; Schreiber, S. L. J. Am.Chem. Soc. 1993, 115, 12621–12622
- ^ Ter Haar, E.; Kowalski, R. J.; Hamel, E.; Lin, C. M.; Longley, R. E.; Gunasekera, S. P.; Rosenkranz, H. S.; Day, B. W. 생화학 1996, 35, 243–250.
- ^ 흥, D.T.; Chen, J.; Schreiber, S. L. Chem.비올. 1996, 3, 287–293.
- ^ Dimri, G.; Lee, X.; Basile, G.; Acosta, M.; Scott, G.; Roskelley, C.; Medrano, E.; Linskens, M.; Rubelj, I.; Pereira-Smith, O.; Peacocke, M.; Campisi, J. Proc.나틀. 아카드.미국 과학 95, 92, 9363–9367.
- ^ Forman, M. S.; 트로이우스키, J. Q. Lee, V. M.Y. Nat. Med. 2004, 10, 1055–1063.
- ^ Zhang, B.; Maiti, A.; Shively, S.; Lakhani, F.; McDonald- Jones, G.; Bruce, J.; Lee, E. B.; Xie, S. X.; Joyce, S.; Li, C.; Toleikis, P. M.; Lee, V. M.-Y.; Trojanowski, J. Q. Proc.나틀. 아카드.2005년 미국 과학 102, 227–231.
- ^ Martello, L. A.; McDaid, H. M.; Regl, D. L.; Yang, C.-P. H.; Meng, D.; Pettus, T. R. R.; Kaufman, M. D.; Arimoto, H.; Danishefsky, S. J.; Smith, A. B., III; Horwitz, S. B. Clin.암 발생량 2000, 6, 1978–1987
- ^ Shaw, S. J., Zhang, D., Sundermann, K. F., Myles, D. C. 조각 조립체:복합 폴리케티드 생성에 대한 대안적 접근법.합성 코뮌.2005, 35, 1735-1743.
- ^ 스미스, A. B., III; 치우, Y.; 존스, D. R.; 고바야시, K. J. Am.Chem. Soc. 1995, 117, 12011–12012
- ^ Harred, S. S.; Yang, G.; Strawn, M. A.; Myles, D. C. J. Org.1997, 62, 6098-6099
- ^ 마샬, J. A.; 존스, B. A. J. Org.1998, 63, 7885–7892
- ^ 할스테드, D. P. 박사학위논문, 하버드 대학교, 캠브리지, 1999년 MA,
- ^ 스미스, A. B., III; 카우프만, M. D. Beauchamp, T. J.; LaMarche, M. J.; 아리모토, H. Org.상트 1999, 1, 1823–1826
- ^ 스미스, A. B., III; 동결, B. S.; 시안, M.; 히로세, T. Org.2005년 7월 1825년–1828년 상트
- ^ 패터슨, I.; 플로렌스, G. J.; 게라크, K.; 스콧, J. 안젤로.화학. 인트.2000년 에드, 39, 377–380
- ^ 패터슨, I.; 델가도, 플로렌스, G. J. 리오티에, I.; 스콧, J. P.; 세레이닉, N. Org.2003, 5, 35–38 상트
- ^ 패터슨, I.; 리오티에, I. Org.2004, 6, 4933–4936
- ^ Mickel, S. J.; Niederer, D.; Daeffler, R.; Osmani, A.; Kuesters, E.; Schmid, E.; Schaer, K.; Gamboni, R.; Chen, W.; Loeser, E.; Kinder, F. R., Jr.; Konigsberger, K.; Prasad, K.; Ramsey, T. M.; Repic, O.; Wang, R.-M.; Florence, G.; Lyothier, I.; Paterson, I. Org.프로세스 리즈 2004, 8, 122–130
- ^ 아레폴로프, A.; 파넥, J. S. J. Am.Chem. Soc. 2005, 127, 5596–5603
- ^ 드모스, 엘사, 포레, 프랑수아, 재니, 부르앵, 아르노, 바르비온, 줄리엔, 아구리다스, 에반겔로스, 란노우, 마리이사벨, 코메르테콘, 알랭, 장프란코이스, 판커라지, 안젤, 아르디슨, 재닉.화학 - A European Journal(2008), 14(35), 11092-11112
- ^ 고도 고형 악성 종양이 있는 성인 환자에게 3 wk마다 투여하는 XAA296A(Discodermolide)의 1상 약동학(PK) 시험.2004년 ASCO 연차총회 ([1])
- ^ Amos B. Smith, III 현재 연구 프로젝트
외부 링크
- 화학 및 엔지니어링 뉴스: Michael Freemantle에 의한 디스코더몰라이드의 스케일업 합성
- 디스코더몰라이드의 화학 및 생물학
- (+-Discodermolide)의 Betzer와 Ardisson 합성